El silicio es un elemento químico ; su símbolo es Si y su número atómico es 14. Es un sólido cristalino duro y quebradizo con un brillo metálico gris azulado, y es un metaloide tetravalente y semiconductor . Es miembro del grupo 14 de la tabla periódica: el carbono está por encima de él; y el germanio , el estaño , el plomo y el flerovio están por debajo. Es relativamente poco reactivo. El silicio es un elemento significativo que es esencial para varios procesos fisiológicos y metabólicos en las plantas. El silicio es ampliamente considerado como el material semiconductor predominante debido a sus aplicaciones versátiles en varios dispositivos eléctricos como transistores, células solares, circuitos integrados y otros. Esto puede deberse a su importante brecha de banda, amplio rango de transmisión óptica, amplio espectro de absorción, rugosidad de la superficie y revestimiento antirreflejo eficaz. [13]
Debido a su alta afinidad química con el oxígeno, no fue hasta 1823 cuando Jöns Jakob Berzelius fue capaz de prepararlo y caracterizarlo en forma pura. Sus óxidos forman una familia de aniones conocidos como silicatos . Sus puntos de fusión y ebullición de 1414 °C y 3265 °C, respectivamente, son los segundos más altos entre todos los metaloides y no metales, superados solo por el boro . [a]
El silicio es el octavo elemento más común en el universo por masa, pero muy raramente se presenta como elemento puro en la corteza terrestre. Está ampliamente distribuido por todo el espacio en polvos cósmicos , planetoides y planetas como diversas formas de dióxido de silicio (sílice) o silicatos . Más del 90% de la corteza terrestre está compuesta de minerales de silicato , lo que convierte al silicio en el segundo elemento más abundante en la corteza terrestre (alrededor del 28% en masa), después del oxígeno .
La mayor parte del silicio se utiliza comercialmente sin separarlo, a menudo con muy poco procesamiento de los minerales naturales. Dicho uso incluye la construcción industrial con arcillas , arena de sílice y piedra . Los silicatos se utilizan en el cemento Portland para mortero y estuco , y se mezclan con arena de sílice y grava para hacer hormigón para pasarelas, cimientos y carreteras. También se utilizan en cerámicas blancas como la porcelana , y en el vidrio sódico-cálcico tradicional a base de silicato y muchos otros vidrios especiales . Los compuestos de silicio como el carburo de silicio se utilizan como abrasivos y componentes de cerámicas de alta resistencia. El silicio es la base de los polímeros sintéticos ampliamente utilizados llamados siliconas .
El período comprendido entre finales del siglo XX y principios del XXI se ha descrito como la Era del Silicio (también conocida como la Era Digital o la Era de la Información ) debido al gran impacto que tiene el silicio elemental en la economía mundial moderna. La pequeña porción de silicio elemental muy purificado que se utiliza en la electrónica de semiconductores (<15%) es esencial para los transistores y chips de circuitos integrados que se utilizan en la mayoría de las tecnologías modernas, como los teléfonos inteligentes y otras computadoras . En 2019, el 32,4% del segmento del mercado de semiconductores se destinaba a redes y dispositivos de comunicación, y se proyecta que la industria de semiconductores alcance los 726.730 millones de dólares en 2027. [14]
El silicio es un elemento esencial en biología. La mayoría de los animales solo necesitan trazas de este elemento, pero algunas esponjas marinas y microorganismos, como las diatomeas y los radiolarios , secretan estructuras esqueléticas hechas de sílice. El sílice se deposita en muchos tejidos vegetales. [15]
Debido a la abundancia de silicio en la corteza terrestre , los materiales naturales a base de silicio se han utilizado durante miles de años. Los cristales de roca de silicio eran familiares para varias civilizaciones antiguas , como los egipcios predinásticos que lo usaban para cuentas y pequeños jarrones , así como los antiguos chinos . El vidrio que contenía sílice fue fabricado por los egipcios desde al menos 1500 a. C., así como por los antiguos fenicios . Los compuestos de silicato natural también se utilizaron en varios tipos de mortero para la construcción de las primeras viviendas humanas . [16]

En 1787, Antoine Lavoisier sospechó que el sílice podría ser un óxido de un elemento químico fundamental , [17] pero la afinidad química del silicio por el oxígeno es lo suficientemente alta como para que no tuviera medios para reducir el óxido y aislar el elemento. [18] Después de un intento de aislar el silicio en 1808, Sir Humphry Davy propuso el nombre "silicium" para el silicio, del latín silex , silicis para pedernal, y agregó la terminación "-ium" porque creía que era un metal. [19] La mayoría de los demás idiomas utilizan formas transliteradas del nombre de Davy, a veces adaptadas a la fonología local (por ejemplo, alemán Silizium , turco silisyum , catalán silici , armenio Սիլիցիում o Silitzioum ). Algunos otros utilizan en su lugar un calco de la raíz latina (por ejemplo, el ruso кремний , de кремень "pedernal"; el griego πυρίτιο de πυρ "fuego"; el finlandés pii de piikivi "pedernal", el checo křemík de křemen "cuarzo", "pedernal"). [20]
Se cree que Gay-Lussac y Thénard prepararon silicio amorfo impuro en 1811, mediante el calentamiento del metal potasio recientemente aislado con tetrafluoruro de silicio , pero no purificaron ni caracterizaron el producto, ni lo identificaron como un nuevo elemento. [21] El silicio recibió su nombre actual en 1817 por el químico escocés Thomas Thomson . Conservó parte del nombre de Davy pero agregó "-on" porque creía que el silicio era un no metal similar al boro y al carbono . [22] En 1824, Jöns Jacob Berzelius preparó silicio amorfo utilizando aproximadamente el mismo método que Gay-Lussac (reduciendo fluorosilicato de potasio con potasio metálico fundido), pero purificando el producto hasta obtener un polvo marrón lavándolo repetidamente. [23] Como resultado, generalmente se le atribuye el descubrimiento del elemento. [24] [25] El mismo año, Berzelius se convirtió en el primero en preparar tetracloruro de silicio ; El tetrafluoruro de silicio ya había sido preparado mucho antes, en 1771, por Carl Wilhelm Scheele disolviendo sílice en ácido fluorhídrico . [18] En 1823, Jacob Berzelius descubrió por primera vez el tetracloruro de silicio (SiCl 4 ). [26] En 1846, Von Ebelman sintetizó el tetraetilo ortosilicato (Si(OC 2 H 5 ) 4 ). [27] [26]
El silicio en su forma cristalina más común no fue preparado hasta 31 años después, por Deville . [28] [29] Al electrolizar una mezcla de cloruro de sodio y cloruro de aluminio que contenía aproximadamente un 10% de silicio, pudo obtener un alótropo ligeramente impuro de silicio en 1854. [30] Más tarde, se han desarrollado métodos más rentables para aislar varias formas alótropas, siendo la más reciente el siliceno en 2010. [31] [32] Mientras tanto, la investigación sobre la química del silicio continuó; Friedrich Wöhler descubrió los primeros hidruros volátiles de silicio, sintetizando triclorosilano en 1857 y el propio silano en 1858, pero una investigación detallada de los silanos solo se llevó a cabo a principios del siglo XX por Alfred Stock , a pesar de las primeras especulaciones sobre el asunto que se remontan a los inicios de la química orgánica sintética en la década de 1830. [33] [34] De manera similar, el primer compuesto de organosilicio , el tetraetilsilano, fue sintetizado por Charles Friedel y James Crafts en 1863, pero la caracterización detallada de la química del organosilicio recién fue realizada a principios del siglo XX por Frederic Kipping . [18]
A partir de la década de 1920, el trabajo de William Lawrence Bragg sobre cristalografía de rayos X dilucidó las composiciones de los silicatos, que previamente se conocían a partir de la química analítica pero aún no se habían entendido, junto con el desarrollo de la química cristalina de Linus Pauling y el desarrollo de la geoquímica de Victor Goldschmidt . A mediados del siglo XX se produjo el desarrollo de la química y el uso industrial de los siloxanos y el uso creciente de polímeros de silicona , elastómeros y resinas . A finales del siglo XX, se trazó un mapa de la complejidad de la química cristalina de los siliciuros , junto con la física del estado sólido de los semiconductores dopados . [18]
Los primeros dispositivos semiconductores no usaban silicio, sino galena , incluido el detector de cristal del físico alemán Ferdinand Braun en 1874 y el detector de cristal de radio del físico indio Jagadish Chandra Bose en 1901. [35] [36] El primer dispositivo semiconductor de silicio fue un detector de cristal de radio de silicio, desarrollado por el ingeniero estadounidense Greenleaf Whittier Pickard en 1906. [36]
En 1940, Russell Ohl descubrió la unión p-n y los efectos fotovoltaicos en el silicio. En 1941, se desarrollaron técnicas para producir cristales de silicio y germanio de alta pureza para los cristales detectores de microondas de radar durante la Segunda Guerra Mundial . [35] En 1947, el físico William Shockley teorizó un amplificador de efecto de campo hecho de germanio y silicio, pero no logró construir un dispositivo que funcionara, antes de finalmente trabajar con germanio en su lugar. El primer transistor que funcionó fue un transistor de contacto puntual construido por John Bardeen y Walter Brattain más tarde ese año mientras trabajaban con Shockley. [37] En 1954, el químico físico Morris Tanenbaum fabricó el primer transistor de unión de silicio en Bell Labs . [38] En 1955, Carl Frosch y Lincoln Derick en Bell Labs descubrieron accidentalmente que el dióxido de silicio ( SiO
2) podrían crecer en silicio. [39] [40] En 1957, Frosch y Derick publicaron su trabajo sobre los primeros transistores de óxido semiconductor SiO2 fabricados ; los primeros transistores planares, en los que el drenaje y la fuente estaban adyacentes en la misma superficie. [41]
La "Era del Silicio" se refiere al período comprendido entre finales del siglo XX y principios del siglo XXI. [43] [44] [45] Esto se debe a que el silicio es el material dominante de la Era del Silicio (también conocida como la Era Digital o la Era de la Información ), de manera similar a cómo la Edad de Piedra , la Edad de Bronce y la Edad de Hierro fueron definidas por los materiales dominantes durante sus respectivas eras de civilización . [43]
Debido a que el silicio es un elemento importante en los dispositivos semiconductores de alta tecnología, muchos lugares del mundo llevan su nombre. Por ejemplo, el valle de Santa Clara en California recibió el sobrenombre de Silicon Valley , ya que el elemento es el material base en la industria de semiconductores allí. Desde entonces, muchos otros lugares han sido apodados de manera similar, incluidos Silicon Wadi en Israel; Silicon Forest en Oregón; Silicon Hills en Austin, Texas; Silicon Slopes en Salt Lake City, Utah; Silicon Saxony en Alemania; Silicon Valley en India; Silicon Border en Mexicali, México; Silicon Fen en Cambridge, Inglaterra; Silicon Roundabout en Londres; Silicon Glen en Escocia; Silicon Gorge en Bristol, Inglaterra; Silicon Alley en la ciudad de Nueva York; y Silicon Beach en Los Ángeles. [46]

Un átomo de silicio tiene catorce electrones . En el estado fundamental, están dispuestos en la configuración electrónica [Ne]3s 2 3p 2 . De ellos, cuatro son electrones de valencia , que ocupan el orbital 3s y dos de los orbitales 3p. Al igual que los demás miembros de su grupo, el carbono más ligero y los más pesados germanio , estaño y plomo , tiene el mismo número de electrones de valencia que de orbitales de valencia: por lo tanto, puede completar su octeto y obtener la configuración estable de gas noble del argón formando orbitales híbridos sp 3 , formando SiX tetraédricos.
4derivados donde el átomo central de silicio comparte un par de electrones con cada uno de los cuatro átomos a los que está unido. [48] Las primeras cuatro energías de ionización del silicio son 786,3, 1576,5, 3228,3 y 4354,4 kJ/mol respectivamente; estas cifras son lo suficientemente altas como para descartar la posibilidad de una química catiónica simple para el elemento. Siguiendo las tendencias periódicas , su radio covalente de enlace simple de 117,6 pm es intermedio entre los del carbono (77,2 pm) y el germanio (122,3 pm). El radio iónico hexacoordinado del silicio puede considerarse de 40 pm, aunque esto debe tomarse como una cifra puramente nocional dada la falta de un Si simple.4+
catión en la realidad. [49]
A temperatura y presión estándar, el silicio es un semiconductor brillante con un lustre metálico gris azulado; como es típico de los semiconductores, su resistividad cae a medida que aumenta la temperatura. Esto surge porque el silicio tiene una pequeña brecha de energía ( banda prohibida ) entre sus niveles de energía ocupados más altos (la banda de valencia) y los desocupados más bajos (la banda de conducción). El nivel de Fermi está aproximadamente a medio camino entre las bandas de valencia y conducción y es la energía en la que un estado tiene la misma probabilidad de estar ocupado por un electrón o no. Por lo tanto, el silicio puro es efectivamente un aislante a temperatura ambiente. Sin embargo, dopar el silicio con un pnicógeno como el fósforo , el arsénico o el antimonio introduce un electrón adicional por dopante y estos pueden luego ser excitados en la banda de conducción ya sea térmica o fotolíticamente, creando un semiconductor de tipo n . De manera similar, dopar silicio con un elemento del grupo 13 como boro , aluminio o galio da como resultado la introducción de niveles aceptores que atrapan electrones que pueden ser excitados desde la banda de valencia llena, creando un semiconductor de tipo p . [50] Unir silicio de tipo n a silicio de tipo p crea una unión p–n con un nivel de Fermi común; los electrones fluyen de n a p, mientras que los huecos fluyen de p a n, creando una caída de voltaje. Esta unión p–n actúa así como un diodo que puede rectificar la corriente alterna que permite que la corriente pase más fácilmente en un sentido que en el otro. Un transistor es una unión n–p–n, con una fina capa de silicio débilmente de tipo p entre dos regiones de tipo n. Polarizar el emisor a través de un pequeño voltaje directo y el colector a través de un gran voltaje inverso permite que el transistor actúe como un amplificador de triodo . [50]
El silicio cristaliza en una estructura covalente gigante en condiciones estándar, específicamente en una red cristalina cúbica de diamante ( grupo espacial 227 ). Por lo tanto, tiene un alto punto de fusión de 1414 °C, ya que se requiere mucha energía para romper los fuertes enlaces covalentes y fundir el sólido. Al fundirse, el silicio se contrae a medida que la red tetraédrica de enlaces de largo alcance se rompe y los huecos en esa red se llenan, de manera similar al hielo de agua cuando se rompen los enlaces de hidrógeno al fundirse. No tiene ningún alótropo termodinámicamente estable a presión estándar, pero se conocen varias otras estructuras cristalinas a presiones más altas. La tendencia general es la de un número de coordinación creciente con la presión, que culmina en un alótropo hexagonal compacto a unos 40 gigapascales conocido como Si–VII (la modificación estándar es Si–I). Un alótropo llamado BC8 (o bc8), que tiene una red cúbica centrada en el cuerpo con ocho átomos por celda unitaria primitiva ( grupo espacial 206 ), se puede crear a alta presión y permanece metaestable a baja presión. Sus propiedades se han estudiado en detalle. [51]
El silicio hierve a 3265 °C: aunque esta temperatura es alta, todavía es más baja que la temperatura a la que su congénere más ligero, el carbono, sublima (3642 °C) y, de manera similar, el silicio tiene un calor de vaporización más bajo que el carbono, lo que es coherente con el hecho de que el enlace Si-Si es más débil que el enlace C-C. [50]
También es posible construir capas de siliceno análogas al grafeno . [31] [32]
El silicio natural se compone de tres isótopos estables , 28 Si (92,23 %), 29 Si (4,67 %) y 30 Si (3,10 %). [52] De estos, solo el 29 Si se utiliza en espectroscopia de RMN y EPR , [53] ya que es el único con un espín nuclear ( I = 1/2 ). [33] Los tres se producen en supernovas de tipo Ia [54] [55] a través del proceso de quema de oxígeno , siendo el 28Si el que se produce como parte del proceso alfa y, por lo tanto, el más abundante. La fusión del 28Si con partículas alfa por reordenamiento por fotodesintegración en las estrellas se conoce como proceso de quema de silicio ; es la última etapa de la nucleosíntesis estelar antes del colapso rápido y la explosión violenta de la estrella en cuestión en una supernova de tipo II . [56]
Se han caracterizado veinte radioisótopos , siendo los dos más estables el 32Si con una vida media de unos 150 años, y el 31Si con una vida media de 2,62 horas. [52] Todos los isótopos radiactivos restantes tienen vidas medias inferiores a siete segundos, y la mayoría de ellos tienen vidas medias inferiores a una décima de segundo. [52] El silicio tiene un isómero nuclear conocido , el 34mSi , con una vida media inferior a 210 nanosegundos. [52] El 32Si sufre una desintegración beta de baja energía a 32P y luego a 32S estable . El 31Si puede producirse por la activación neutrónica del silicio natural y, por tanto , es útil para el análisis cuantitativo; puede detectarse fácilmente por su desintegración beta característica a 31P estable , en la que el electrón emitido transporta hasta 1,48 MeV de energía. [33]
Los isótopos conocidos del silicio varían en número de masa de 22 a 44. [52] El modo de desintegración más común de los isótopos con números de masa menores que los tres isótopos estables es la desintegración beta inversa , que forma principalmente isótopos de aluminio (13 protones) como productos de desintegración . [52] El modo de desintegración más común para los isótopos inestables más pesados es la desintegración beta, que forma principalmente isótopos de fósforo (15 protones) como productos de desintegración. [52]
El silicio puede entrar en los océanos a través de las aguas subterráneas y el transporte fluvial . Los grandes flujos de entrada de silicio en las aguas subterráneas tienen una composición isotópica que es distinta de la de los aportes fluviales. Las variaciones isotópicas en las aguas subterráneas y los transportes fluviales contribuyen a las variaciones en los valores oceánicos de 30 Si. Actualmente, existen diferencias sustanciales en los valores isotópicos de las aguas profundas en las cuencas oceánicas del mundo . Entre los océanos Atlántico y Pacífico, hay un gradiente de 30 Si en aguas profundas de más de 0,3 partes por mil. El 30 Si se asocia más comúnmente con la productividad en los océanos. [57]
El silicio cristalino a granel es bastante inerte, pero se vuelve más reactivo a altas temperaturas. Al igual que su vecino, el aluminio, el silicio forma una capa superficial delgada y continua de dióxido de silicio ( SiO
2) que protege al metal de la oxidación. Por lo tanto, el silicio no reacciona de forma medible con el aire por debajo de los 900 °C, pero la formación de dióxido vítreo aumenta rápidamente entre 950 °C y 1160 °C y cuando se alcanzan los 1400 °C, el nitrógeno atmosférico también reacciona para dar los nitruros SiN y Si
3norte
4El silicio reacciona con azufre gaseoso a 600 °C y fósforo gaseoso a 1000 °C. Sin embargo, esta capa de óxido no impide la reacción con los halógenos ; el flúor ataca al silicio vigorosamente a temperatura ambiente, el cloro lo hace a unos 300 °C y el bromo y el yodo a unos 500 °C. El silicio no reacciona con la mayoría de los ácidos acuosos, pero se oxida y compleja con mezclas de ácido fluorhídrico que contienen cloro o ácido nítrico para formar hexafluorosilicatos . Se disuelve fácilmente en álcali acuoso caliente para formar silicatos . [58] A altas temperaturas, el silicio también reacciona con haluros de alquilo ; esta reacción puede ser catalizada por cobre para sintetizar directamente cloruros de organosilicio como precursores de polímeros de silicona . Al fundirse, el silicio se vuelve extremadamente reactivo, se alea con la mayoría de los metales para formar siliciuros y reduce la mayoría de los óxidos metálicos porque el calor de formación del dióxido de silicio es muy grande. De hecho, el silicio fundido reacciona prácticamente con cualquier tipo conocido de material de crisol (excepto su propio óxido, SiO
2). [59] : 13 Esto sucede debido a las altas fuerzas de unión del silicio para los elementos ligeros y a su alto poder de disolución para la mayoría de los elementos. [59] : 13 Como resultado, los contenedores para silicio líquido deben estar hechos de materiales refractarios y no reactivos, como el dióxido de circonio o los boruros de los grupos 4, 5 y 6. [50] [60]
La coordinación tetraédrica es un motivo estructural importante en la química del silicio, al igual que lo es en la química del carbono. Sin embargo, la subcapa 3p es bastante más difusa que la subcapa 2p y no se hibrida tan bien con la subcapa 3s. Como resultado, la química del silicio y sus congéneres más pesados muestra diferencias significativas con respecto a la del carbono [61] y, por lo tanto, la coordinación octaédrica también es significativa [50] . Por ejemplo, la electronegatividad del silicio (1,90) es mucho menor que la del carbono (2,55), porque los electrones de valencia del silicio están más alejados del núcleo que los del carbono y, por lo tanto, experimentan fuerzas electrostáticas de atracción más pequeñas desde el núcleo. La escasa superposición de orbitales 3p también da como resultado una tendencia mucho menor hacia la concatenación (formación de enlaces Si-Si) para el silicio que para el carbono, debido al debilitamiento concomitante del enlace Si-Si en comparación con el enlace C-C: [62] la energía de enlace Si-Si promedio es de aproximadamente 226 kJ/mol, en comparación con un valor de 356 kJ/mol para el enlace C-C. [63] Esto da como resultado que los compuestos de silicio con enlaces múltiples sean generalmente mucho menos estables que sus contrapartes de carbono, un ejemplo de la regla del doble enlace . Por otro lado, la presencia de nodos radiales en los orbitales 3p del silicio sugiere la posibilidad de hipervalencia , como se ve en derivados de silicio de cinco y seis coordenadas, como SiX−
5y SiF2−
6. [64] [62] Por último, debido a la creciente brecha de energía entre los orbitales de valencia s y p a medida que el grupo desciende, el estado divalente crece en importancia desde el carbono hasta el plomo, de modo que se conocen unos pocos compuestos divalentes inestables para el silicio; esta disminución del estado de oxidación principal, en tándem con el aumento de los radios atómicos, da como resultado un aumento del carácter metálico en el grupo. El silicio ya muestra un comportamiento metálico incipiente, particularmente en el comportamiento de sus compuestos de óxido y su reacción con ácidos y bases (aunque esto requiere cierto esfuerzo), y por lo tanto a menudo se lo denomina metaloide en lugar de no metal. [62] El germanio muestra más, y el estaño generalmente se considera un metal. [18]
El silicio muestra claras diferencias con el carbono. Por ejemplo, la química orgánica tiene muy pocas analogías con la química del silicio, mientras que los minerales de silicato tienen una complejidad estructural que no se observa en los oxocarbonos . [65] El silicio tiende a parecerse mucho más al germanio que al carbono, y esta semejanza se ve reforzada por la contracción del bloque d , lo que da como resultado que el tamaño del átomo de germanio sea mucho más cercano al del átomo de silicio de lo que predecirían las tendencias periódicas. [66] Sin embargo, todavía existen algunas diferencias debido a la creciente importancia del estado divalente en el germanio en comparación con el silicio. Además, la menor fuerza de enlace Ge-O en comparación con la fuerza de enlace Si-O da como resultado la ausencia de polímeros de "germanona" que serían análogos a los polímeros de silicona. [63]

El silicio es el octavo elemento más abundante en el universo, después del hidrógeno , el helio , el carbono , el nitrógeno , el oxígeno , el hierro y el neón . Estas abundancias no se replican bien en la Tierra debido a la separación sustancial de los elementos que tuvo lugar durante la formación del Sistema Solar . El silicio constituye el 27,2% de la corteza terrestre en peso, solo superado por el oxígeno con un 45,5%, con el que siempre está asociado en la naturaleza. Se produjo una mayor fraccionación en la formación de la Tierra por diferenciación planetaria : el núcleo de la Tierra , que constituye el 31,5% de la masa de la Tierra, tiene una composición aproximada de Fe
25Ni
2Co
0,1S
3; el manto constituye el 68,1% de la masa de la Tierra y está compuesto principalmente de óxidos y silicatos más densos, un ejemplo es el olivino ( Mg, Fe).
2SiO
4; mientras que los minerales silíceos más ligeros, como los aluminosilicatos, suben a la superficie y forman la corteza, que representa el 0,4% de la masa de la Tierra. [67] [68]
La cristalización de rocas ígneas a partir del magma depende de varios factores; entre ellos se encuentran la composición química del magma, la velocidad de enfriamiento y algunas propiedades de los minerales individuales que se van a formar, como la energía reticular , el punto de fusión y la complejidad de su estructura cristalina. A medida que el magma se enfría, aparece primero el olivino , seguido del piroxeno , el anfíbol , la mica biotita , el feldespato ortoclasa , la mica moscovita , el cuarzo , las zeolitas y, finalmente, los minerales hidrotermales. Esta secuencia muestra una tendencia hacia unidades de silicato cada vez más complejas con el enfriamiento y la introducción de aniones hidróxido y fluoruro además de óxidos. Muchos metales pueden sustituir al silicio. Después de que estas rocas ígneas sufren meteorización , transporte y deposición, se forman rocas sedimentarias como arcilla, pizarra y arenisca. El metamorfismo también puede ocurrir a altas temperaturas y presiones, creando una variedad aún más amplia de minerales. [67]
Los flujos de silicio hacia el océano tienen cuatro orígenes: la erosión química de las rocas continentales, el transporte fluvial, la disolución de los silicatos terrígenos continentales y la reacción entre los basaltos submarinos y el fluido hidrotermal que libera el silicio disuelto. Estos cuatro flujos están interconectados en el ciclo biogeoquímico del océano, ya que todos se formaron inicialmente a partir de la erosión de la corteza terrestre. [69]
Cada año, se depositan en los océanos del mundo entre 300 y 900 megatoneladas de polvo eólico. De ese valor, entre 80 y 240 megatoneladas están en forma de silicio particulado. La cantidad total de silicio particulado depositado en el océano es aún menor que la cantidad de silicio que ingresa al océano a través del transporte fluvial. [70] Las entradas eólicas de silicio litogénico particulado en los océanos Atlántico Norte y Pacífico Norte Occidental son el resultado del polvo que se deposita en los océanos desde el Sahara y el desierto de Gobi, respectivamente. [69] Los transportes fluviales son la principal fuente de entrada de silicio al océano en las regiones costeras, mientras que la deposición de silicio en el océano abierto está muy influenciada por la sedimentación del polvo eólico. [70]
El silicio de pureza del 96-99% se obtiene mediante reducción carbotérmica de cuarcita o arena con coque de alta pureza . La reducción se lleva a cabo en un horno de arco eléctrico , con un exceso de SiO
2Se utiliza para evitar que se acumule carburo de silicio (SiC): [33]

Esta reacción, conocida como reducción carbotérmica del dióxido de silicio, se lleva a cabo habitualmente en presencia de chatarra de hierro con bajas cantidades de fósforo y azufre , produciendo ferrosilicio . [33] El ferrosilicio, una aleación de hierro y silicio que contiene proporciones variables de silicio elemental y hierro, representa alrededor del 80% de la producción mundial de silicio elemental, y China, el principal proveedor de silicio elemental, proporciona 4,6 millones de toneladas (o 2/3 de la producción mundial) de silicio, la mayor parte en forma de ferrosilicio. Le siguen Rusia (610.000 t), Noruega (330.000 t), Brasil (240.000 t) y Estados Unidos (170.000 t). [71] El ferrosilicio se utiliza principalmente en la industria del hierro y el acero (véase más adelante) con un uso principal como adición de aleación en hierro o acero y para la desoxidación del acero en plantas siderúrgicas integradas. [33]
Otra reacción, que a veces se utiliza, es la reducción aluminotérmica del dióxido de silicio, como sigue: [72]
La lixiviación de silicio en polvo con una pureza del 96-97 % con agua da como resultado silicio con una pureza de aproximadamente el 98,5 %, que se utiliza en la industria química. Sin embargo, se necesita una pureza aún mayor para aplicaciones de semiconductores, y esto se produce a partir de la reducción de tetraclorosilano (tetracloruro de silicio) o triclorosilano . El primero se obtiene clorando silicio de desecho y el segundo es un subproducto de la producción de silicona . Estos compuestos son volátiles y, por lo tanto, se pueden purificar mediante destilación fraccionada repetida, seguida de una reducción a silicio elemental con zinc metálico muy puro como agente reductor. Los trozos esponjosos de silicio así producidos se funden y luego se hacen crecer para formar monocristales cilíndricos, antes de purificarlos mediante refinación por zonas . Otras rutas utilizan la descomposición térmica de silano o tetrayodosilano ( SiI
4). Otro proceso utilizado es la reducción del hexafluorosilicato de sodio , un producto de desecho común de la industria de fertilizantes fosfatados, por sodio metálico : esto es altamente exotérmico y, por lo tanto, no requiere una fuente de energía externa. El silicio hiperfino se fabrica con una pureza mayor que casi cualquier otro material: la producción de transistores requiere niveles de impurezas en los cristales de silicio inferiores a 1 parte por 10 10 , y en casos especiales se necesitan y se alcanzan niveles de impurezas inferiores a 1 parte por 10 12 . [33]
Las nanoestructuras de silicio se pueden producir directamente a partir de arena de sílice mediante procesos metalotérmicos convencionales o mediante el método de síntesis por combustión. Estos materiales de silicio nanoestructurados se pueden utilizar en diversas aplicaciones funcionales, como el ánodo de baterías de iones de litio (LIB), otras baterías de iones, dispositivos informáticos futuros como memristores o aplicaciones fotocatalíticas. [73]
La mayor parte del silicio se utiliza industrialmente sin purificarlo, a menudo con un procesamiento comparativamente pequeño de su forma natural. Más del 90% de la corteza terrestre está compuesta de minerales de silicato , que son compuestos de silicio y oxígeno, a menudo con iones metálicos cuando los aniones de silicato cargados negativamente requieren cationes para equilibrar la carga. Muchos de estos tienen usos comerciales directos, como arcillas, arena de sílice y la mayoría de los tipos de piedra de construcción. Por lo tanto, la gran mayoría de los usos del silicio son como compuestos estructurales, ya sea como minerales de silicato o sílice (dióxido de silicio crudo). Los silicatos se utilizan para hacer cemento Portland (hecho principalmente de silicatos de calcio) que se usa en mortero de construcción y estuco moderno , pero lo que es más importante, combinados con arena de sílice y grava (que generalmente contiene minerales de silicato como el granito), para hacer el hormigón que es la base de la mayoría de los proyectos de construcción industrial más grandes del mundo moderno. [74]
La sílice se utiliza para fabricar ladrillos refractarios , un tipo de cerámica. Los minerales de silicato también se encuentran en la cerámica blanca , una clase importante de productos que generalmente contienen varios tipos de minerales de arcilla cocida (filosilicatos de aluminio naturales). Un ejemplo es la porcelana , que se basa en el mineral de silicato caolinita . El vidrio tradicional ( vidrio sódico-cálcico a base de sílice ) también funciona de muchas de las mismas formas, y también se utiliza para ventanas y contenedores. Además, las fibras de vidrio especiales a base de sílice se utilizan para la fibra óptica , así como para producir fibra de vidrio para soporte estructural y lana de vidrio para aislamiento térmico .
Las siliconas se utilizan a menudo en tratamientos impermeabilizantes , compuestos de moldeo , agentes desmoldantes , sellos mecánicos, grasas y ceras de alta temperatura y compuestos de calafateo . La silicona también se utiliza a veces en implantes mamarios , lentes de contacto, explosivos y pirotecnia . [75] La masilla Silly Putty se fabricaba originalmente añadiendo ácido bórico al aceite de silicona . [76] Otros compuestos de silicio funcionan como abrasivos de alta tecnología y nuevas cerámicas de alta resistencia basadas en carburo de silicio . El silicio es un componente de algunas superaleaciones .
El silicio elemental se añade al hierro fundido fundido en forma de aleaciones de ferrosilicio o silicocalcio para mejorar el rendimiento en la fundición de secciones delgadas y para evitar la formación de cementita cuando se expone al aire exterior. La presencia de silicio elemental en el hierro fundido actúa como un sumidero de oxígeno, de modo que el contenido de carbono del acero, que debe mantenerse dentro de límites estrechos para cada tipo de acero, se puede controlar más de cerca. La producción y el uso de ferrosilicio es un monitor de la industria del acero, y aunque esta forma de silicio elemental es extremadamente impura, representa el 80% del uso mundial de silicio libre. El silicio es un componente importante del acero para transformadores , modificando su resistividad y propiedades ferromagnéticas .
Las propiedades del silicio se pueden utilizar para modificar aleaciones con otros metales además del hierro. El silicio de "grado metalúrgico" es silicio con una pureza del 95-99%. Alrededor del 55% del consumo mundial de silicio de pureza metalúrgica se destina a la producción de aleaciones de aluminio y silicio ( aleaciones de siluminio ) para piezas fundidas de aluminio , principalmente para su uso en la industria automotriz . La importancia del silicio en la fundición de aluminio es que una cantidad significativamente alta (12%) de silicio en el aluminio forma una mezcla eutéctica que se solidifica con muy poca contracción térmica. Esto reduce en gran medida el desgarro y las grietas formadas por la tensión a medida que las aleaciones de fundición se enfrían hasta solidificarse. El silicio también mejora significativamente la dureza y, por lo tanto, la resistencia al desgaste del aluminio. [77] [78]

La mayor parte del silicio elemental producido permanece en forma de aleación de ferrosilicio, y solo aproximadamente el 20% se refina hasta alcanzar la pureza de grado metalúrgico (un total de 1,3 a 1,5 millones de toneladas métricas por año). Se estima que el 15% de la producción mundial de silicio de grado metalúrgico se refina aún más hasta alcanzar la pureza de semiconductor. [78] Por lo general, se trata de un material monocristalino con una pureza de "nueve-nueve" o 99,9999999%, [79] casi libre de defectos . [80]
El silicio monocristalino de tal pureza se produce generalmente mediante el proceso Czochralski , y se utiliza para producir obleas de silicio utilizadas en la industria de semiconductores , en electrónica y en algunas aplicaciones fotovoltaicas de alto costo y alta eficiencia . [81] El silicio puro es un semiconductor intrínseco , lo que significa que a diferencia de los metales, conduce huecos de electrones y electrones liberados de los átomos por el calor; la conductividad eléctrica del silicio aumenta con temperaturas más altas. El silicio puro tiene una conductividad demasiado baja (es decir, una resistividad demasiado alta ) para ser utilizado como un elemento de circuito en electrónica. En la práctica, el silicio puro se dopa con pequeñas concentraciones de ciertos otros elementos, que aumentan en gran medida su conductividad y ajustan su respuesta eléctrica controlando el número y la carga ( positiva o negativa ) de los portadores activados. Tal control es necesario para transistores , células solares , detectores de semiconductores y otros dispositivos semiconductores utilizados en la industria informática y otras aplicaciones técnicas. [82] En la fotónica de silicio , el silicio puede usarse como un medio láser Raman de onda continua para producir luz coherente. [83]
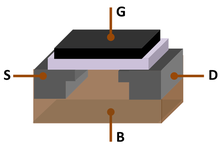
En los circuitos integrados comunes , una oblea de silicio monocristalino sirve como soporte mecánico para los circuitos, que se crean mediante dopaje y se aíslan entre sí mediante capas delgadas de óxido de silicio , un aislante que se produce fácilmente en superficies de Si mediante procesos de oxidación térmica u oxidación local (LOCOS) , que implican exponer el elemento al oxígeno en las condiciones adecuadas que se pueden predecir mediante el modelo de Deal-Grove . El silicio se ha convertido en el material más popular tanto para semiconductores de alta potencia como para circuitos integrados porque puede soportar las temperaturas más altas y la mayor actividad eléctrica sin sufrir una ruptura por avalancha (una avalancha de electrones se crea cuando el calor produce electrones libres y huecos, que a su vez pasan más corriente, lo que produce más calor). Además, el óxido aislante de silicio no es soluble en agua, lo que le da una ventaja sobre el germanio (un elemento con propiedades similares que también se puede utilizar en dispositivos semiconductores) en ciertas técnicas de fabricación. [84]
El silicio monocristalino es caro de producir y, por lo general, solo se justifica en la producción de circuitos integrados, donde las pequeñas imperfecciones del cristal pueden interferir con las pequeñas rutas de los circuitos. Para otros usos, se pueden emplear otros tipos de silicio puro. Estos incluyen el silicio amorfo hidrogenado y el silicio de grado metalúrgico mejorado (UMG-Si) utilizado en la producción de electrónica de área grande y bajo costo en aplicaciones como pantallas de cristal líquido y de células solares de película delgada de área grande y bajo costo . Estos grados de silicio semiconductor son ligeramente menos puros o policristalinos en lugar de monocristalinos, y se producen en cantidades comparables a las del silicio monocristalino: 75.000 a 150.000 toneladas métricas por año. El mercado para el grado menor está creciendo más rápidamente que para el silicio monocristalino. Para 2013, se proyectaba que la producción de silicio policristalino, utilizado principalmente en células solares, alcanzaría las 200.000 toneladas métricas por año, mientras que se esperaba que el silicio de grado semiconductor monocristalino se mantuviera por debajo de las 50.000 toneladas por año. [78]
Los puntos cuánticos de silicio se crean a través del procesamiento térmico de silsesquioxano de hidrógeno en nanocristales que van desde unos pocos nanómetros a unos pocos micrones, mostrando propiedades luminiscentes dependientes del tamaño. [85] [86] Los nanocristales muestran grandes cambios de Stokes que convierten los fotones en el rango ultravioleta a fotones en el visible o infrarrojo, dependiendo del tamaño de la partícula, lo que permite aplicaciones en pantallas de puntos cuánticos y concentradores solares luminiscentes debido a su autoabsorción limitada. Un beneficio de usar puntos cuánticos basados en silicio sobre cadmio o indio es la naturaleza no tóxica y libre de metales del silicio. [87] [88] Otra aplicación de los puntos cuánticos de silicio es para la detección de materiales peligrosos. Los sensores aprovechan las propiedades luminiscentes de los puntos cuánticos a través de la extinción de la fotoluminiscencia en presencia de la sustancia peligrosa. [89] Hay muchos métodos utilizados para la detección de productos químicos peligrosos, algunos de los cuales son la transferencia de electrones, la transferencia de energía de resonancia de fluorescencia y la generación de fotocorriente. [90] La extinción por transferencia de electrones ocurre cuando el orbital molecular desocupado más bajo (LUMO) es ligeramente más bajo en energía que la banda de conducción del punto cuántico, lo que permite la transferencia de electrones entre los dos, impidiendo la recombinación de los huecos y electrones dentro de los nanocristales. El efecto también se puede lograr a la inversa con una molécula donante que tiene su orbital molecular ocupado más alto (HOMO) ligeramente más alto que un borde de la banda de valencia del punto cuántico, lo que permite que los electrones se transfieran entre ellos, llenando los huecos y evitando la recombinación. La transferencia de energía por resonancia de fluorescencia ocurre cuando se forma un complejo entre el punto cuántico y una molécula extintora. El complejo continuará absorbiendo luz, pero cuando la energía se convierte al estado fundamental, no libera un fotón, extinguiendo el material. El tercer método utiliza un enfoque diferente al medir la fotocorriente emitida por los puntos cuánticos en lugar de monitorear la pantalla fotoluminiscente. Si la concentración del químico deseado aumenta, la fotocorriente emitida por los nanocristales cambiará en respuesta. [91]

Aunque el silicio está fácilmente disponible en forma de silicatos , muy pocos organismos lo utilizan directamente. Las diatomeas , los radiolarios y las esponjas silíceas utilizan sílice biogénica como material estructural para sus esqueletos. Algunas plantas acumulan sílice en sus tejidos y requieren silicio para su crecimiento, por ejemplo el arroz . Las plantas pueden absorber el silicio como ácido ortosilícico (también conocido como ácido monosilícico) y transportarlo a través del xilema , donde forma complejos amorfos con componentes de la pared celular. Se ha demostrado que esto mejora la resistencia de la pared celular y la integridad estructural en algunas plantas, reduciendo así la herbivoría de los insectos y las infecciones patógenas. En ciertas plantas, el silicio también puede regular positivamente la producción de compuestos orgánicos volátiles y fitohormonas que desempeñan un papel importante en los mecanismos de defensa de las plantas. [94] [95] [96] En plantas más avanzadas, los fitolitos de sílice (fitolitos de ópalo) son cuerpos microscópicos rígidos que se encuentran en la célula. [97] [98] [95]
Se sabe que varios cultivos hortícolas se protegen contra los hongos patógenos de las plantas con sílice, hasta tal punto que la aplicación de fungicidas puede fallar a menos que se acompañe de una nutrición de silicio suficiente. Las moléculas de defensa de las plantas silíceas activan algunas fitoalexinas , lo que significa que algunas de ellas son sustancias de señalización que producen inmunidad adquirida . Cuando se les priva, algunas plantas las sustituyen con una mayor producción de otras sustancias defensivas. [95]
La vida en la Tierra está compuesta en gran parte de carbono , pero la astrobiología considera que la vida extraterrestre puede tener otros tipos hipotéticos de bioquímica . El silicio se considera una alternativa al carbono, ya que puede crear moléculas complejas y estables con cuatro enlaces covalentes, necesarios para un análogo del ADN , y está disponible en grandes cantidades. [99]
Las diatomeas utilizan silicio en forma de sílice biogénica (bSi), [100] que es absorbida por la proteína de transporte de silicio (SIT) para ser utilizada predominantemente en la estructura de la pared celular como frústulas. [101] El silicio ingresa al océano en forma disuelta, como ácido silícico o silicato. [102] Dado que las diatomeas son uno de los principales usuarios de estas formas de silicio, contribuyen en gran medida a la concentración de silicio en todo el océano. El silicio forma un perfil similar al de los nutrientes en el océano debido a la productividad de las diatomeas en profundidades poco profundas. [102] Por lo tanto, la concentración de silicio es menor en el océano poco profundo y mayor en el océano profundo.
La productividad de las diatomeas en el océano superior contribuye a la cantidad de silicio exportado al océano inferior. [103] Cuando las células de diatomeas se lisan en el océano superior, sus nutrientes, como el hierro, el zinc y el silicio, se llevan al océano inferior a través de un proceso llamado nieve marina . La nieve marina implica la transferencia descendente de materia orgánica particulada mediante la mezcla vertical de materia orgánica disuelta. [104] Se ha sugerido que el silicio se considera crucial para la productividad de las diatomeas y, siempre que haya ácido silícico disponible para que lo utilicen las diatomeas, estas también pueden contribuir a otras concentraciones importantes de nutrientes en el océano profundo. [105]
En las zonas costeras, las diatomeas son los principales organismos fitoplanctónicos y contribuyen en gran medida a la producción de sílice biogénica. Sin embargo, en mar abierto, las diatomeas tienen un papel reducido en la producción anual mundial de sílice. Las diatomeas de los giros subtropicales del Atlántico Norte y del Pacífico Norte solo contribuyen con un 5-7% de la producción anual mundial de sílice marina. El océano Austral produce aproximadamente un tercio de la sílice biogénica marina mundial. [69] Se dice que el océano Austral tiene una "divisoria biogeoquímica" [106], ya que solo se transportan cantidades minúsculas de silicio fuera de esta región.
Hay algunas evidencias de que el silicio es importante para la salud humana por sus tejidos de uñas, cabello, huesos y piel, [107] por ejemplo, en estudios que demuestran que las mujeres premenopáusicas con mayor ingesta dietética de silicio tienen mayor densidad ósea , y que la suplementación con silicio puede aumentar el volumen y la densidad ósea en pacientes con osteoporosis . [108] El silicio es necesario para la síntesis de elastina y colágeno , de los cuales la aorta contiene la mayor cantidad en el cuerpo humano, [109] y ha sido considerado un elemento esencial ; [110] sin embargo, es difícil probar su esencialidad, porque el silicio es muy común y, por lo tanto, los síntomas de deficiencia son difíciles de reproducir. [111] [112]
Actualmente, la Asociación de Funcionarios de Control de Alimentos Vegetales de Estados Unidos (AAPFCO) está considerando elevar el silicio a la categoría de "sustancia beneficiosa para las plantas". [113] [114]
Las personas pueden estar expuestas al silicio elemental en el lugar de trabajo al respirarlo, tragarlo o tener contacto con la piel o los ojos. En los dos últimos casos, el silicio plantea un ligero peligro como irritante. Es peligroso si se inhala. [115] La Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido el límite legal para la exposición al silicio en el lugar de trabajo en 15 mg/m 3 de exposición total y 5 mg/m 3 de exposición respiratoria durante una jornada laboral de ocho horas. El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 10 mg/m 3 de exposición total y 5 mg/m 3 de exposición respiratoria durante una jornada laboral de ocho horas. [116] La inhalación de polvo de sílice cristalina puede provocar silicosis , una enfermedad pulmonar ocupacional caracterizada por inflamación y cicatrización en forma de lesiones nodulares en los lóbulos superiores de los pulmones . [117]
Se realizó una presentación para que Excell Minerals reconociera al silicio como un nutriente vegetal reconocido
{{cite book}}: |journal=ignorado ( ayuda )