La ecuación de Tafel es una ecuación de la cinética electroquímica que relaciona la velocidad de una reacción electroquímica con el sobrepotencial . [1] La ecuación de Tafel se dedujo primero experimentalmente y luego se demostró que tenía una justificación teórica. La ecuación recibe su nombre del químico suizo Julius Tafel .
Describe cómo la corriente eléctrica a través de un electrodo depende de la diferencia de voltaje entre el electrodo y el electrolito a granel para una reacción redox unimolecular simple. [2] [ referencia circular ]
Cuando una reacción electroquímica se produce en dos semirreacciones en electrodos separados , la ecuación de Tafel se aplica a cada electrodo por separado. En un solo electrodo, la ecuación de Tafel se puede expresar como:
dónde
Una verificación y una explicación adicional de esta ecuación se pueden encontrar aquí. [6] La ecuación de Tafel es una aproximación de la ecuación de Butler-Volmer en el caso de .
"[La ecuación de Tafel] supone que las concentraciones en el electrodo son prácticamente iguales a las concentraciones en el electrolito en masa, lo que permite expresar la corriente sólo como una función del potencial. En otras palabras, supone que la tasa de transferencia de masa del electrodo es mucho mayor que la tasa de reacción, y que la reacción está dominada por la tasa de reacción química más lenta". [7] [ referencia circular ]
Además, en un electrodo dado, la ecuación de Tafel supone que la velocidad de reacción de la mitad inversa es insignificante en comparación con la velocidad de reacción directa.
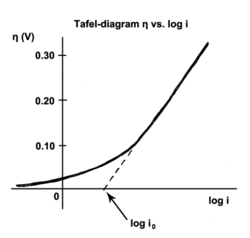
La corriente de intercambio es la corriente en equilibrio, es decir, la velocidad a la que las especies oxidadas y reducidas transfieren electrones con el electrodo. En otras palabras, la densidad de corriente de intercambio es la velocidad de reacción en el potencial reversible (cuando el sobrepotencial es cero por definición). En el potencial reversible, la reacción está en equilibrio, lo que significa que las reacciones directa e inversa progresan a la misma velocidad. Esta velocidad es la densidad de corriente de intercambio.
La pendiente de Tafel se mide experimentalmente. Sin embargo, se puede demostrar teóricamente que cuando el mecanismo de reacción dominante implica la transferencia de un solo electrón,
donde A se define como
dónde
En un caso más general,
La siguiente derivación de la ecuación de Butler-Volmer extendida es una adaptación de la de Bard y Faulkner y la de Newman y Thomas-Alyea. [8] [ referencia circular ] [ ... ] la corriente se expresa como una función no solo del potencial (como en la versión simple), sino también de las concentraciones dadas. La tasa de transferencia de masa puede ser relativamente pequeña, pero su único efecto sobre la reacción química es a través de las concentraciones alteradas (dadas). En efecto, las concentraciones también son una función del potencial. [7]
La ecuación de Tafel también se puede escribir como:
dónde
Como se ve en la ecuación ( 1 ), entonces: como se ve en la ecuación ( 2 ) y porque . porque [9] [ referencia circular ] [10] [ referencia circular ] debido a la transferencia de masa del electrodo [11] [ referencia circular ] , lo que finalmente produce la ecuación ( 3 ).
Otra ecuación es aplicable a valores bajos de polarización . En tal caso, la dependencia de la corriente con respecto a la polarización suele ser lineal (no logarítmica):
Esta región lineal se llama resistencia de polarización debido a su similitud formal con la ley de Ohm .
El ritmo al que se desarrolla la corrosión está determinado por la cinética de las reacciones involucradas, por lo que la doble capa eléctrica es fundamental.
La aplicación de un sobrepotencial a un electrodo hace que la reacción se mueva en una dirección, alejándose del equilibrio. La ley de Tafel determina la nueva velocidad y, siempre que la cinética de la reacción esté bajo control, el sobrepotencial es proporcional al logaritmo de la corriente de corrosión. [12]