El paratungstato de amonio (o APT) es una sal cristalina blanca con la fórmula química (NH 4 ) 10 (H 2 W 12 O 42 )·4H 2 O. Se describe como "la materia prima más importante para todos los demás productos de tungsteno". [2]
Los minerales de tungsteno , que son típicamente óxidos , se digieren en una base para dar soluciones de tungstato junto con muchas especies contaminantes. Este extracto crudo se acidifica y se trata con sulfuro para separar el trisulfuro de molibdeno . Tras una mayor acidificación, el APT finalmente cristaliza. [2]
Si se utiliza un WO 3 calcinado, es aconsejable refluir la solución de amoniaco para acelerar su disolución.
Calentar el paratungstato de amonio a su temperatura de descomposición de 600 °C produce óxido de tungsteno (VI) , como se describe en esta ecuación idealizada:
A partir de ahí, el trióxido se calienta en una atmósfera de hidrógeno , produciendo tungsteno elemental: [3]
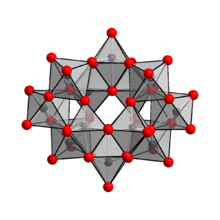
Se ha demostrado que el anión en (NH 4 ) 10 (W 12 O 41 )·5H 2 O es [H 2 W 12 O 42 ] 10− , que contiene dos átomos de hidrógeno , manteniendo dos átomos de hidrógeno dentro de la jaula. [1] Por lo tanto, la notación de fórmula correcta para el paratungstato de amonio es (NH 4 ) 10 [H 2 W 12 O 42 ]·4H 2 O. El ion [H 2 W 12 O 42 ] 10− se conoce como el ion paratungstato B , a diferencia del ion paratungstato A, que tiene la fórmula [W 7 O 24 ] 6− , similar al ion paramolibdato. Sin embargo, la existencia del ion paratungstato A no pudo confirmarse mediante espectroscopia de RMN. [4]
Antes de 1930, aproximadamente, hubo algunas disputas sobre la composición exacta de la sal, y se propusieron tanto (NH 4 ) 10 W 12 O 41 como (NH 4 ) 6 W 7 O 24. OW Gibbs comentó al respecto:
Al concentrar una solución amoniacal de ácido túngstico (es decir, WO 3 hidratado ), el producto obtenido es paratungstato de amonio. Por debajo de 50 °C, se forma el hexahidrato , mientras que cuando la temperatura de la solución es superior a 50 °C, se forma el pentahidrato o heptahidrato. El primero cristaliza como placas o prismas triclínicos, mientras que el segundo como agujas pseudorómbicas. El tetrahidrato es el más importante en un sentido comercial. También conocido como: