La Oficina para la Protección de la Investigación Humana (OHRP) es una pequeña oficina dentro del Departamento de Salud y Servicios Humanos de los Estados Unidos (DHHS), específicamente la Oficina del Subsecretario de Salud en la Oficina del Secretario del DHHS, que se ocupa de las supervisiones éticas en la investigación clínica realizada por el departamento, principalmente a través de los Institutos Nacionales de Salud (NIH). [2]
La principal función de la oficina es la implementación de 45 CFR 46 , un conjunto de regulaciones para las Juntas de Revisión Institucional (IRB) que refleja la regulación de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) que cubre la investigación clínica realizada por compañías farmacéuticas , así como otras regulaciones bajo la guía de la Política Federal para la Protección de Sujetos Humanos, que también se conoce como la " Regla Común ". [3]
Las instituciones que realizan investigaciones patrocinadas por el DHHS deben contar con una "Garantía federal" (FWA), un acuerdo con la OHRP sobre supervisión ética. La OHRP también ofrece educación a los comités de revisión institucional, brinda orientación sobre ética de la investigación y asesora al Secretario del HHS sobre cuestiones de ética médica . [2]
La experimentación humana poco ética en los Estados Unidos se ha practicado en los Estados Unidos durante mucho tiempo antes de la creación de la OHRP. [ cita requerida ] Una característica importante de la experimentación realizada durante esta época fue la indiferencia por el sufrimiento infligido a los pacientes. En la década de 1840, J. Marion Sims realizó cientos de operaciones quirúrgicas en mujeres africanas esclavizadas sin usar anestesia. [4] Robert Bartholow aplicó corrientes eléctricas en la materia cerebral expuesta de los pacientes. Un ejemplo atroz fue en 1874 cuando una señora vino para el tratamiento de una úlcera cancerosa en su cráneo que hizo un agujero de 2 pulgadas. Bartholow insertó electrodos en su cerebro y le causó una gran angustia. La señora entró en coma y murió 4 días después. [5] Otro tema de la experimentación humana en el siglo XIX y principios del XX fue el trato injusto a los pacientes de minorías étnicas. A principios del siglo XX, los médicos del ejército de los EE. UU. infectaron a 34 prisioneros filipinos con peste bubónica y beriberi. [6] Entre 1932 y 1972, el experimento de sífilis de Tuskegee observó la progresión natural de la sífilis en 600 hombres afroamericanos (399 de los cuales tenían sífilis y 201 sujetos de control que no tenían sífilis). A cambio de su participación, a los hombres se les prometió exámenes médicos gratuitos, comidas calientes y un fondo para el entierro. A los hombres nunca se les dijo que tenían sífilis ni se les proporcionó tratamiento cuando la penicilina estuvo disponible como una cura efectiva en 1947. Al final del estudio en 1972, solo 74 de los sujetos de prueba estaban vivos. De los 399 hombres originales con sífilis, 28 habían muerto de la enfermedad, 100 habían muerto de complicaciones relacionadas con la sífilis. Además, 40 esposas habían sido infectadas y 19 niños habían nacido con sífilis congénita. Un error común sobre el Experimento de Sífilis de Tuskegee es que a los sujetos se les inyectó sífilis. [7]

Antes de la fundación de la OHRP, Estados Unidos pasó por varias entidades precursoras cuyos objetivos eran manejar la ética en la experimentación humana. Muchos eran comités transitorios que no duraron más de un año o dos, como el Comité Asesor sobre Experimentos con Radiación Humana y el Consejo Asesor de Ética. [8] Uno de los primeros y más antiguos grupos preocupados por la seguridad de los sujetos experimentales fue la Asociación Estadounidense de Psicología (APA), que publicó por primera vez sus "Estándares éticos de los psicólogos" en 1953. [9] Desde entonces, la APA ha publicado muchas versiones de su Código de Ética y actualmente opera bajo el código aprobado en 2002. [9] La Ley Nacional de Investigación estableció entonces la Comisión Nacional para la Protección de Sujetos Humanos de Investigación Biomédica y Conductual , que fue la primera comisión nacional cuyo enfoque completo fue la protección de los sujetos experimentales. [10] [11] En 1978, la Administración de Alimentos y Medicamentos añadió sus primeras regulaciones para proteger a los sujetos de investigación humana, que fueron revisadas en 1981. [12] La Comisión Asesora Nacional de Bioética fue creada por el presidente Bill Clinton en octubre de 1995 y fue disuelta en octubre de 2001. [10]

El 13 de junio de 2000, la Secretaria de Salud y Servicios Humanos de los Estados Unidos , Donna Shalala , creó la OHRP como un componente de la Oficina de Salud Pública y Ciencia , con la función principal de supervisar la investigación realizada en sujetos de prueba humanos y asegurar su cumplimiento con las regulaciones establecidas por el Departamento de Salud y Servicios Humanos de los Estados Unidos . [13] La OHRP reemplazó a la Oficina para la Protección de Riesgos de Investigación, y Greg Koski fue nombrado como el primer director. [14] El director de la OHRP debía reportar al Subsecretario de Salud de los Estados Unidos bajo el Departamento de Salud y Servicios Humanos (entonces David Satcher ).
Desde su fundación, la OHRP ha intervenido en varios casos relacionados con experimentos de investigación con sujetos humanos en los que se violaron la salud y los derechos de los participantes, así como las normas establecidas para la investigación en seres humanos. En 2001, la OHRP suspendió temporalmente la licencia de investigación de la Universidad Johns Hopkins y sus instalaciones de investigación asociadas tras la muerte de un participante en un experimento de inhalación de hexametonio. [15] Se descubrió que el experimento violaba las normas porque los investigadores no informaron a los participantes de los posibles peligros del hexametonio ni obtuvieron información adecuada sobre el efecto del hexametonio antes de la experimentación. [15] En otro caso ocurrido en 2013, la OHRP cuestionó la práctica del Ensayo Aleatorio de Surfactante, Presión Positiva y Oxigenación (SUPPORT), un proyecto de investigación en el que se utilizaron 1300 bebés prematuros como sujetos para probar los niveles óptimos de oxigenación que se deben utilizar para el cuidado adecuado de los bebés prematuros en los hospitales. [16] Se determinó que este experimento violaba las regulaciones federales porque los padres de estos bebés no fueron informados de los posibles efectos del experimento en sus hijos, que incluían ceguera o muerte, y por lo tanto no pudieron dar su consentimiento informado . [16]
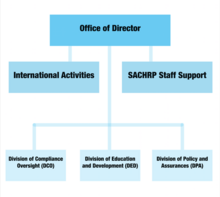
Como líder del DHHS, la Oficina del Director supervisa todas las funciones de la OHRP y trabaja en estrecha colaboración con los funcionarios del DHHS, incluidos el Secretario de Salud y Servicios Humanos y el Subsecretario de Salud, para garantizar que las políticas, los planes y los procedimientos de investigación en seres humanos cumplan con los estándares éticos. Los comités que dependen de la Oficina del Director incluyen el de Actividades Internacionales y el Comité Asesor del Secretario sobre Protección de la Investigación en Seres Humanos (SACHRP).
El SACHRP es un comité de la Oficina del Director que está integrado principalmente por investigadores y abogados que ayudan al Secretario de Salud y Servicios Humanos con su asesoramiento especializado. El Subsecretario de Salud actúa como intermediario y presenta el asesoramiento del comité al secretario para su consideración. Además, el SACHRP también celebra tres reuniones anuales abiertas al público y a las preguntas del público.
Este comité trabaja para mejorar las políticas y los procedimientos éticos que protegen a los sujetos de investigación humana en todo el mundo. Estos esfuerzos globales garantizan que las personas que participan en cualquier investigación financiada o realizada por el DHHS reciban la misma protección que quienes participan en los Estados Unidos.
La División de Supervisión de Cumplimiento se encarga de evaluar los informes de incumplimiento sustanciales según las normas del Departamento de Salud y Servicios Humanos (HHS). Con base en los informes de investigación escritos, la oficina determina si será necesario tomar medidas reglamentarias para proteger a los sujetos de investigación humanos. Se realizan evaluaciones de vigilancia tanto de cumplimiento con causa como sin causa.
El DED es responsable de gran parte de la publicidad de la OHRP. Sus tareas incluyen organizar eventos, asesorar a los investigadores que participan en experimentos afiliados y difundir materiales educativos sobre la protección de los sujetos de investigación humana. Los materiales educativos también se presentan en línea a través del sitio web oficial de la OHRP.
La División de Políticas y Garantías prepara las políticas, directrices y requisitos para la protección de los sujetos humanos y proporciona la información a la comunidad de investigación. También está a cargo de la administración de las Garantías de Cumplimiento a nivel federal y del registro de las juntas de revisión institucional.
La Oficina para la Protección de la Investigación Humana se adhiere a los principios del Informe Belmont para llevar a cabo sus responsabilidades. El Informe Belmont es un conjunto de directrices creadas por la Comisión Nacional para la Protección de los Sujetos Humanos de la Investigación Biomédica y Conductual . [17] El Informe Belmont, cuyo objetivo es servir como parámetros éticos para quienes realizan investigaciones que involucran a sujetos humanos, tiene tres aspectos principales: límites entre la práctica y la investigación, principios éticos básicos y aplicación de estos principios. [17]
Existe una diferencia importante entre las normas que regulan la práctica de procedimientos aprobados y la investigación. Por ello, el Informe Belmont define cada término para ayudar a determinar qué constituye qué. La práctica se define como una metodología establecida diseñada para mejorar la condición de un individuo con la confianza de que tendrá éxito. [17] La investigación se define como un procedimiento diseñado para probar una hipótesis y extraer conclusiones de un modo experimental. [17] La OHRP solo analiza las actividades categorizadas como investigación.
Los tres principios éticos básicos que se describen en el Informe Belmont son el respeto a las personas, la beneficencia y la justicia. [17] El respeto a las personas pone énfasis en los sujetos y su autonomía, es decir, en su capacidad de tomar decisiones en la investigación. Para tener autonomía, los sujetos deben dar su consentimiento informado. Esto significa que deben ser lo suficientemente maduros y mentalmente capaces de autodeterminarse, deben comprender plenamente su papel en los procedimientos y deben ser completamente voluntarios para participar. [17] La beneficencia requiere que la investigación tenga la intención de producir beneficios, o potencial de beneficios, para el individuo u otras personas con condiciones similares que superen cualquier riesgo que pueda implicar. La justicia delinea la necesidad de una distribución justa en la selección de sujetos, lo que significa que se minimiza el sesgo en los participantes. Los participantes no pueden ser todos de una población vulnerable o de fácil acceso sin violar el principio de justicia. [18]
La Subparte A, más comúnmente conocida como la " Regla Común ", de 45 CFR 46 son las pautas fundamentales para la ética de toda investigación en seres humanos. Cualquier establecimiento que desee realizar una investigación que involucre a seres humanos debe presentar un documento que declare que cumplirá con esta política y todas las políticas pertinentes al departamento o agencia federal con autoridad. La junta de revisión institucional (IRB) debe revisar y aprobar inicialmente la investigación y, en caso de que se apruebe el estudio, la IRB continuará monitoreando la investigación. Si en algún momento la investigación no sigue las pautas aprobadas por la IRB, entonces la IRB tiene la autoridad de suspender o terminar la investigación. El departamento o agencia a cargo también tiene el poder de suspender la investigación. Durante el curso del estudio, la IRB debe documentar todas las reuniones y actividades.
Las pautas que debe seguir un estudio de investigación antes de ser aprobado incluyen el consentimiento informado de los sujetos, el riesgo mínimo para los sujetos y la no utilización de "sujetos vulnerables" por parte de éstos. [19] El consentimiento informado debe incluir todos los aspectos de la investigación, que incluyen la premisa general, los riesgos, los beneficios, los procedimientos alternativos, la confidencialidad y cualquier compensación que pueda estar disponible. El sujeto debe declarar oficialmente que elige voluntariamente participar en el experimento bajo todas las circunstancias proporcionadas por el establecimiento. Este consentimiento informado es documentado por el IRB y firmado por el sujeto de prueba.
El Departamento de Salud y Servicios Humanos de Estados Unidos establece las condiciones requeridas para cualquier investigación que se realice en mujeres embarazadas o fetos. [20]
Para la investigación en mujeres embarazadas y fetos, los temas de condición incluyen estudios de riesgo preclínico, minimización del riesgo, no otorgar dinero (u otros beneficios) para interrumpir el embarazo, beneficio potencial directo para las mujeres embarazadas y los fetos (de lo contrario, se requieren disposiciones de consentimiento especial), niños embarazadas (requiere disposiciones de consentimiento especial) y la incapacidad de los participantes de la investigación de elegir ni cómo se interrumpe un embarazo ni si un neonato (un bebé menor de 4 semanas) es viable.
En el caso de las investigaciones sobre neonatos, las normas difieren en función de si el niño tiene viabilidad cierta, inviabilidad cierta o viabilidad incierta. En el caso de viabilidad incierta, la investigación debe maximizar la probabilidad de viabilidad y respetar las disposiciones sobre el consentimiento de los padres. En el caso de los neonatos no viables, la investigación no puede interrumpir el latido cardíaco ni la respiración, ni tampoco puede mantener artificialmente las funciones vitales; no se puede añadir ningún riesgo al neonato y se requiere el consentimiento de los padres. En el caso de los neonatos viables, existe un procedimiento de consentimiento.
También existen condiciones específicas para la investigación que involucra placenta posparto, fetos muertos o material fetal. Estas exigen que los estudios cumplan con las leyes federales, estatales y locales. Además, si las personas que participan en la investigación pueden ser identificadas de alguna manera, esas personas son sujetos de investigación y deben ser tratadas con todos los requisitos legales necesarios.
Si un estudio no puede ser aprobado bajo estas condiciones pero ofrece un gran potencial para la salud de mujeres embarazadas, fetos o neonatos, existe un proceso especial mediante el cual el Secretario puede o no aprobar el estudio; este proceso implica consulta con un panel de expertos, así como códigos éticos y de consentimiento.
La Guía sobre la participación de prisioneros en investigaciones brinda protección a los prisioneros. Es importante señalar que los prisioneros pueden participar en investigaciones biomédicas o conductuales si y solo si la investigación está específicamente autorizada. "Prisionero" se define en las regulaciones del HHS en 45 CFR parte 46.303(c) como "cualquier individuo confinado o detenido involuntariamente en una institución penal. El término pretende abarcar a las personas condenadas a una institución de ese tipo en virtud de un estatuto penal o civil, las personas detenidas en otras instalaciones en virtud de estatutos o procedimientos de internamiento que brindan alternativas al procesamiento penal o encarcelamiento en una institución penal, y las personas detenidas en espera de comparecencia, juicio o sentencia". También se aplica a la situación en la que una persona se convierte en prisionero después de que la investigación haya comenzado.
La subparte B señala que si la capacidad de un preso para dar su consentimiento se ve afectada, es decir, si la decisión de este preso no es verdaderamente voluntaria y no coaccionada, entonces se deben proporcionar salvaguardas adicionales con el propósito de garantizar la seguridad. Además, los miembros del IRB (1) no deben tener, en general, ninguna relación con la(s) prisión(es) en cuestión, y (2) al menos uno de ellos debe ser preso. En general, la protección para los presos es similar a la de otros grupos minoritarios, y la investigación en sí debe recibir autorización de la OHRP. [21]
En el caso de la investigación con seres humanos, "los 'niños' son personas que no han alcanzado la edad legal para dar su consentimiento a los tratamientos o procedimientos implicados en la investigación, según la ley aplicable de la jurisdicción en la que se realizará la investigación". En su mayor parte, las protecciones para los menores son en su mayoría las mismas que para cualquier otro sujeto humano. Sin embargo, la Subparte D de 45 CFR 46 marca varias distinciones sobre la obtención del consentimiento/asentimiento y la naturaleza de la investigación que involucra a niños. De acuerdo con las reglas reales de consentimiento informado dadas por el IRB para la investigación en cuestión, es posible que se requiera tanto el asentimiento del niño como el consentimiento de los padres para realizar investigaciones con menores. Dependiendo de las regulaciones del IRB, si alguna de las partes no da su asentimiento, entonces la investigación no puede realizarse con el niño.
En general, la investigación sólo puede realizarse en niños si no implica ningún riesgo significativo para ellos. Esta regla puede eludirse si el niño puede obtener un beneficio directo para su salud, incluso si el procedimiento puede tener un riesgo mayor que el mínimo. Incluso si no hay un beneficio directo para el menor y puede haber un riesgo mayor que el mínimo, el IRB puede aprobar la investigación si el conocimiento generalizado sobre la condición del sujeto o si el conocimiento relacionado con la salud de los niños puede surgir de la investigación en el niño. [22]
Una junta de revisión institucional (IRB, por sus siglas en inglés) es un tipo de comité que revisa la bioinvestigación basada en seres humanos. De acuerdo con el artículo 45 CFR 46, cada IRB que designe una institución debe estar registrada en la Oficina para la Protección de la Investigación Humana (OHRP, por sus siglas en inglés) del Departamento de Salud y Servicios Humanos (HHS, por sus siglas en inglés). Al registrar una IRB, se debe proporcionar la siguiente información a la OHRP: la información de la institución, incluido su nombre y dirección postal, la información personal de la persona a cargo de la IRB, el número estimado de protocolos activos que la IRB ha revisado inicialmente o que revisará y el número de puestos de tiempo completo de la IRB. Todo el proceso de registro debe realizarse electrónicamente a través del sitio web oficial de la OHRP. Después del registro, toda la información proporcionada será revisada por la OHRP. La IRB permanecerá vigente durante tres años después de ser aprobada y aceptada oficialmente. La información debe renovarse cada tres años. Además, si hubiera algún cambio en la información del presidente, se debe enviar una actualización a la OHRP dentro de los 90 días. Si la institución u organización decide disolver un IRB que actualmente está en funcionamiento, deberá enviar un informe a la OHRP dentro de los 30 días. [23]