La oleandomicina es un antibiótico macrólido . Se sintetiza a partir de cepas de Streptomyces antibioticus . Es más débil que la eritromicina .
Solía venderse bajo la marca Sigmamycine , combinado con tetraciclina , y fabricado por la empresa Rosa-Phytopharma en Francia .
La oleandomicina inhibe las bacterias responsables de las infecciones de las vías respiratorias superiores. Su espectro de actividad incluye bacterias de los géneros Staphylococcus y Enterococcus . [ cita requerida ]
La CMI para la oleandomicina es de 0,3-3 μg/mL para Staphylococcus aureus . [1]
La oleandomicina está aprobada como antibiótico veterinario en algunos países. En los Estados Unidos se la ha aprobado como antibiótico para cerdos y aves de corral. Sin embargo, actualmente solo está aprobada en los Estados Unidos para usos de producción. [2] [3]
La oleandomicina fue descubierta por primera vez como un producto de la bacteria Streptomyces antibioticus en 1954 por el Dr. Sobin, English y Celmer. En 1960, Hochstein logró determinar con éxito la estructura de la oleandomicina. [5] Este macrólido fue descubierto aproximadamente al mismo tiempo que sus parientes, la eritromicina y la espiramicina. [6]
El interés público por la oleandomicina alcanzó su punto máximo cuando Pfizer introdujo en el mercado en 1956 el fármaco combinado Sigmamycine. Sigmamycine era un fármaco combinado de oleandomicina y tetraciclina que contó con el apoyo de una importante campaña de marketing. De hecho, se afirmaba que una mezcla 2:1 de tetraciclina y oleandomicina tenía un efecto sinérgico sobre los estafilococos. También se afirmaba que la mezcla sería eficaz contra organismos que en su mayoría son resistentes a la tetraciclina o la oleandomicina solas. Ambas afirmaciones fueron refutadas por hallazgos como los de Lawrence P. Garrod, que no pudo encontrar evidencia de que tales afirmaciones estuvieran debidamente fundamentadas. [6] A principios de la década de 1970, los fármacos combinados de Pfizer fueron retirados del mercado. [7] [8] [9]
La oleandomicina es un agente bacteriostático. Al igual que la eritromicina, la oleandomicina se une a la subunidad 50s de los ribosomas bacterianos, inhibiendo la finalización de la síntesis de proteínas vitales para la supervivencia y la replicación. Interfiere en la actividad de traducción, pero también en la formación de la subunidad 50s. [ cita requerida ]
Sin embargo, a diferencia de la eritromicina y sus derivados sintéticos eficaces, carece de un grupo 12-hidroxilo y un grupo 3-metoxi. Este cambio en la estructura puede afectar negativamente sus interacciones con las estructuras 50S y explicar por qué es un antibiótico menos potente. [10]
La oleandomicina es mucho menos eficaz que la eritromicina en pruebas de concentración inhibitoria mínima bacteriana que involucran estafilococos o enterococos. [1] Sin embargo, los antibióticos macrólidos pueden acumularse en órganos o células y este efecto puede prolongar la bioactividad de esta categoría de antibióticos incluso si su concentración en plasma está por debajo de lo que se considera capaz de un efecto terapéutico. [ cita requerida ]
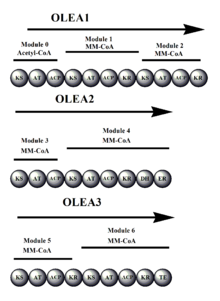
La oleandomicina sintasa (OLES) sigue la estructura modular de una sintasa de tipo I. La cadena de policétidos está unida a través de enlaces tioéster a los grupos SH de los dominios ACP y KS [ cita requerida ]
Las similitudes en la secuencia de aminoácidos entre OLES y la 6-desoxieritronolida B sintasa (sintasa precursora de la eritromicina) muestran solo un 45 % de identidad común. Cabe señalar que, a diferencia de la sintasa precursora de la eritromicina, hay un KS en el dominio de carga de OLES. [11]
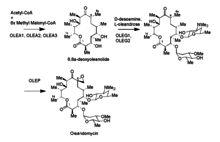
Los genes OleG1 y G2 son responsables de las glicosiltransferasas que unen los azúcares característicos de la oleandomicina al macrólido. Estos azúcares se derivan de la TDP-glucosa . OLEG1 transfiere dTDP-D-desoamina y OleG2 transfiere D-TDP-L- oleandrosa al anillo del macrólido. La epoxidación que ocurre después es de la enzima codificada por OleP, que podría ser homóloga con una enzima P450. Se sospecha que el método por el cual OleP epoxida es una dihidroxilación seguida de la conversión de un grupo hidroxilo en un grupo fosfato que luego sale a través de un cierre nucleofílico del anillo por el otro grupo hidroxilo. [11]