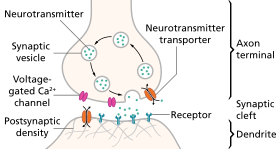
La neurotransmisión (del latín transmissio "paso, cruce" de transmisore "enviar, dejar pasar") es el proceso por el cual las moléculas de señalización llamadas neurotransmisores son liberadas por la terminal axónica de una neurona (la neurona presináptica), y se unen y reaccionan con los receptores en las dendritas de otra neurona (la neurona postsináptica) a poca distancia. Un proceso similar ocurre en la neurotransmisión retrógrada , donde las dendritas de la neurona postsináptica liberan neurotransmisores retrógrados (por ejemplo, endocannabinoides ; sintetizados en respuesta a un aumento en los niveles de calcio intracelular ) que envían señales a través de receptores que se encuentran en la terminal axónica de la neurona presináptica, principalmente en las sinapsis GABAérgicas y glutamatérgicas . [1] [2] [3] [4]
La neurotransmisión está regulada por varios factores diferentes: la disponibilidad y la tasa de síntesis del neurotransmisor, la liberación de ese neurotransmisor, la actividad basal de la célula postsináptica, la cantidad de receptores postsinápticos disponibles a los que se puede unir el neurotransmisor y la posterior eliminación o desactivación del neurotransmisor por enzimas o recaptación presináptica. [5] [6]
En respuesta a un potencial de acción umbral o potencial eléctrico graduado , se libera un neurotransmisor en la terminal presináptica . El neurotransmisor liberado puede entonces moverse a través de la sinapsis para ser detectado y unirse a los receptores en la neurona postsináptica. La unión de neurotransmisores puede influir en la neurona postsináptica de forma inhibitoria o excitatoria . La unión de neurotransmisores a receptores en la neurona postsináptica puede desencadenar cambios a corto plazo, como cambios en el potencial de membrana llamados potenciales postsinápticos , o cambios a más largo plazo mediante la activación de cascadas de señalización .
Las neuronas forman redes neuronales biológicas complejas a través de las cuales viajan los impulsos nerviosos (potenciales de acción). Las neuronas no se tocan entre sí (excepto en el caso de una sinapsis eléctrica a través de una unión en hendidura ); en cambio, las neuronas interactúan en puntos de contacto cercanos llamados sinapsis. Una neurona transporta su información a través de un potencial de acción. Cuando el impulso nervioso llega a la sinapsis, puede provocar la liberación de neurotransmisores, que influyen en otra neurona (postsináptica). La neurona postsináptica puede recibir entradas de muchas neuronas adicionales, tanto excitatorias como inhibidoras. Las influencias excitatorias e inhibidoras se suman, y si el efecto neto es inhibidor, la neurona tendrá menos probabilidades de "activarse" (es decir, generar un potencial de acción), y si el efecto neto es excitatorio, la neurona tendrá más probabilidades de activarse. La probabilidad de que una neurona se active depende de la distancia entre su potencial de membrana y el potencial umbral , el voltaje al que se activa un potencial de acción porque se activan suficientes canales de sodio dependientes del voltaje para que la corriente neta de sodio entrante supere todas las corrientes de salida. [7] Las entradas excitatorias acercan a una neurona al umbral, mientras que las entradas inhibidoras la alejan del umbral. Un potencial de acción es un evento de "todo o nada"; las neuronas cuyas membranas no han alcanzado el umbral no se activarán, mientras que las que lo hacen deben hacerlo. Una vez que se inicia el potencial de acción (tradicionalmente en el cono axónico ), se propagará a lo largo del axón, lo que provocará la liberación de neurotransmisores en el botón sináptico para pasar información a otra neurona adyacente.
Los neurotransmisores se empaquetan espontáneamente en vesículas y se liberan en paquetes cuánticos individuales independientemente de los potenciales de acción presinápticos. Esta liberación lenta es detectable y produce efectos microinhibitorios o microexcitadores en la neurona postsináptica. Un potencial de acción amplifica brevemente este proceso. Los neurotransmisores que contienen vesículas se agrupan alrededor de los sitios activos y, después de que se han liberado, pueden reciclarse mediante uno de los tres mecanismos propuestos. El primer mecanismo propuesto implica la apertura parcial y el posterior cierre de la vesícula. Los dos segundos implican la fusión completa de la vesícula con la membrana, seguida del reciclaje, o reciclaje en el endosoma. La fusión vesicular está impulsada en gran medida por la concentración de calcio en microdominios ubicados cerca de los canales de calcio, lo que permite solo microsegundos de liberación de neurotransmisores, mientras que volver a la concentración normal de calcio toma un par de cientos de microsegundos. Se cree que la exocitosis de la vesícula está impulsada por un complejo proteico llamado SNARE , que es el objetivo de las toxinas botulínicas . Una vez liberado, un neurotransmisor entra en la sinapsis y encuentra receptores. Los receptores de neurotransmisores pueden ser ionotrópicos o acoplados a proteína G. Los receptores ionotrópicos permiten el paso de iones cuando son agonizados por un ligando. El modelo principal implica un receptor compuesto de múltiples subunidades que permiten la coordinación de la preferencia iónica. Los receptores acoplados a proteína G, también llamados receptores metabotrópicos, cuando se unen a un ligando experimentan cambios conformacionales que dan lugar a una respuesta intracelular. La terminación de la actividad del neurotransmisor suele realizarse mediante un transportador, aunque también es plausible la desactivación enzimática. [9]
Cada neurona se conecta con otras muchas neuronas y recibe de ellas numerosos impulsos. La sumatoria es la suma de estos impulsos en el cono axónico. Si la neurona sólo recibe impulsos excitatorios, generará un potencial de acción. Si, en cambio, la neurona recibe tantos impulsos inhibidores como excitatorios, la inhibición anula la excitación y el impulso nervioso se detiene allí. [10] La generación de potenciales de acción es proporcional a la probabilidad y el patrón de liberación de neurotransmisores, y a la sensibilización de los receptores postsinápticos. [11] [12] [13]
La suma espacial significa que los efectos de los impulsos recibidos en diferentes lugares de la neurona se suman, de modo que la neurona puede dispararse cuando dichos impulsos se reciben simultáneamente, incluso si cada impulso por sí solo no fuera suficiente para provocar la activación.
La suma temporal significa que los efectos de los impulsos recibidos en el mismo lugar pueden sumarse si los impulsos se reciben en una sucesión temporal cercana. Por lo tanto, la neurona puede activarse cuando se reciben múltiples impulsos, incluso si cada impulso por sí solo no sería suficiente para provocar la activación. [14]
La neurotransmisión implica tanto una convergencia como una divergencia de información. En primer lugar, una neurona recibe la influencia de muchas otras, lo que da lugar a una convergencia de información de entrada. Cuando la neurona se activa, la señal se envía a muchas otras neuronas, lo que da lugar a una divergencia de información de salida. Muchas otras neuronas reciben la influencia de esta neurona. [ cita requerida ]
La cotransmisión es la liberación de varios tipos de neurotransmisores desde una única terminal nerviosa .
En la terminal nerviosa, los neurotransmisores están presentes dentro de vesículas revestidas de membrana de 35 a 50 nm llamadas vesículas sinápticas . Para liberar neurotransmisores, las vesículas sinápticas se acoplan y fusionan transitoriamente en la base de estructuras lipoproteicas especializadas en forma de copa de 10 a 15 nm en la membrana presináptica llamadas porosomas . [15] Se ha resuelto el proteoma del porosoma neuronal , proporcionando la arquitectura molecular y la composición completa de la maquinaria. [16]
Estudios recientes en una gran variedad de sistemas han demostrado que la mayoría de las neuronas, si no todas, liberan varios mensajeros químicos diferentes. [17] La cotransmisión permite efectos más complejos en los receptores postsinápticos y, por lo tanto, permite que se produzca una comunicación más compleja entre neuronas.
En la neurociencia moderna, las neuronas suelen clasificarse según su cotransmisor. Por ejemplo, las "neuronas GABAérgicas" del cuerpo estriatal utilizan péptidos opioides o sustancia P como su cotransmisor principal.
Algunas neuronas pueden liberar al menos dos neurotransmisores al mismo tiempo, siendo el otro un cotransmisor, para proporcionar la retroalimentación negativa estabilizadora necesaria para una codificación significativa, en ausencia de interneuronas inhibidoras . [18] Los ejemplos incluyen:
La noradrenalina y el ATP son cotransmisores simpáticos . Se ha descubierto que el endocannabinoide anadamida y el cannabinoide WIN 55,212-2 pueden modificar la respuesta global a la estimulación del nervio simpático, e indican que los receptores CB1 presinápticos median la acción simpaticoinhibitoria . Por lo tanto, los cannabinoides pueden inhibir tanto los componentes noradrenérgicos como los purinérgicos de la neurotransmisión simpática. [19]
Un par inusual de cotransmisores es el GABA y el glutamato, que se liberan desde las mismas terminales axónicas de las neuronas que se originan en el área tegmental ventral (ATV), el globo pálido interno y el núcleo supramamilar . [20] Los dos primeros se proyectan a la habénula , mientras que se sabe que las proyecciones del núcleo supramamilar se dirigen al giro dentado del hipocampo. [20]
La neurotransmisión está asociada genéticamente con otras características o rasgos. Por ejemplo, los análisis de enriquecimiento de diferentes vías de señalización llevaron al descubrimiento de una asociación genética con el volumen intracraneal. [21]
Por lo tanto, es concebible que los niveles bajos de receptores CB1 se localicen en terminales glutamatérgicas y GABAérgicas que inciden en las neuronas DA [127, 214], donde pueden ajustar la liberación de neurotransmisores inhibidores y excitadores y regular la activación de las neuronas DA.
De manera consistente, los experimentos electrofisiológicos in vitro de laboratorios independientes han proporcionado evidencia de la localización del receptor CB1 en las terminales axónicas glutamatérgicas y GABAérgicas en el VTA y SNc.
La interacción directa CB1-HcrtR1 se propuso por primera vez en 2003 (Hilairet et al., 2003). De hecho, se observó un aumento de 100 veces en la potencia de la hipocretina-1 para activar la señalización de ERK cuando se coexpresaron CB1 y HcrtR1... En este estudio, se informó una mayor potencia de la hipocretina-1 para regular el heterómero CB1-HcrtR1 en comparación con el homómero HcrtR1-HcrtR1 (Ward et al., 2011b). Estos datos proporcionan una identificación inequívoca de la heteromerización CB1-HcrtR1, que tiene un impacto funcional sustancial. ... La existencia de una comunicación cruzada entre los sistemas hipocretinérgico y endocannabinoide está fuertemente respaldada por su distribución anatómica parcialmente superpuesta y su papel común en varios procesos fisiológicos y patológicos. Sin embargo, se sabe poco sobre los mecanismos subyacentes a esta interacción. ... Actuando como mensajero retrógrado, los endocannabinoides modulan las entradas sinápticas excitatorias glutamatérgicas y las entradas inhibidoras GABAérgicas en las neuronas dopaminérgicas del ATV y la transmisión de glutamato en el NAc. Por lo tanto, la activación de los receptores CB1 presentes en las terminales axónicas de las neuronas GABAérgicas en el ATV inhibe la transmisión de GABA, eliminando esta entrada inhibidora en las neuronas dopaminérgicas (Riegel y Lupica, 2004). La transmisión sináptica de glutamato en el ATV y el NAc, principalmente desde las neuronas del PFC, es modulada de manera similar por la activación de los receptores CB1 (Melis et al., 2004).