El cáncer de ovario es un tumor canceroso de un ovario . [10] Puede originarse en el propio ovario o, más comúnmente, en estructuras cercanas comunicantes, como las trompas de Falopio o el revestimiento interno del abdomen . [3] [11] El ovario está formado por tres tipos diferentes de células, incluidas las células epiteliales, las células germinales y las células del estroma. [12] Cuando estas células se vuelven anormales, tienen la capacidad de dividirse y formar tumores. Estas células también pueden invadir o propagarse a otras partes del cuerpo. [13] Cuando comienza este proceso, es posible que no haya síntomas o que solo haya síntomas vagos. [1] Los síntomas se vuelven más notorios a medida que progresa el cáncer. [1] [14] Estos síntomas pueden incluir hinchazón , sangrado vaginal, dolor pélvico , hinchazón abdominal , estreñimiento y pérdida de apetito , entre otros. [1] Las áreas comunes a las que se puede propagar el cáncer incluyen el revestimiento del abdomen , los ganglios linfáticos , los pulmones y el hígado . [15]
El riesgo de cáncer de ovario aumenta con la edad. La mayoría de los casos de cáncer de ovario se desarrollan después de la menopausia. [16] También es más común en mujeres que han ovulado más a lo largo de su vida. [17] Esto incluye a aquellas que nunca han tenido hijos , aquellas que comenzaron a ovular a una edad más temprana y aquellas que llegan a la menopausia a una edad más avanzada. [5] Otros factores de riesgo incluyen la terapia hormonal después de la menopausia , la medicación para la fertilidad y la obesidad . [4] [6] Los factores que disminuyen el riesgo incluyen el control de la natalidad hormonal , la ligadura de trompas , el embarazo y la lactancia materna . [6] Alrededor del 10% de los casos están relacionados con el riesgo genético heredado; las mujeres con mutaciones en los genes BRCA1 o BRCA2 tienen alrededor de un 50% de probabilidades de desarrollar la enfermedad. [5] Algunos síndromes de cáncer familiar como el cáncer de colon hereditario no polipósico y el síndrome de Peutz-Jeghers también aumentan el riesgo de desarrollar cáncer de ovario. [16] El carcinoma epitelial de ovario es el tipo más común de cáncer de ovario y comprende más del 95 % de los casos. [5] Existen cinco subtipos principales de carcinoma de ovario, de los cuales el carcinoma seroso de alto grado (HGSC) es el más común. [5] Los tipos menos comunes de cáncer de ovario incluyen tumores de células germinales [18] y tumores del estroma del cordón sexual . [5] El diagnóstico de cáncer de ovario se confirma mediante una biopsia de tejido, generalmente extirpado durante una cirugía. [1]
No se recomienda la detección en mujeres con riesgo promedio, ya que la evidencia no respalda una reducción en la mortalidad y la alta tasa de pruebas con resultados falsos positivos puede llevar a una cirugía innecesaria, que viene acompañada de sus propios riesgos. [19] Aquellas con riesgo muy alto pueden extirparse los ovarios como medida preventiva. [4] Si se detecta y se trata en una etapa temprana, el cáncer de ovario a menudo es curable. [1] El tratamiento generalmente incluye una combinación de cirugía, radioterapia y quimioterapia . [1] Los resultados dependen de la extensión de la enfermedad, el subtipo de cáncer presente y otras condiciones médicas. [5] [20] La tasa general de supervivencia a cinco años en los Estados Unidos es del 49%. [7] Los resultados son peores en el mundo en desarrollo. [5]
En 2020, se produjeron nuevos casos en aproximadamente 313.000 mujeres. [21] En 2019, resultó en 13.445 muertes en los Estados Unidos. [22] La muerte por cáncer de ovario aumentó a nivel mundial entre 1990 y 2017 en un 84,2%. [23] El cáncer de ovario es el segundo cáncer ginecológico más común en los Estados Unidos. Causa más muertes que cualquier otro cáncer del sistema reproductor femenino. [24] Entre las mujeres, ocupa el quinto lugar en muertes relacionadas con el cáncer. [25] La edad típica de diagnóstico es de 63 años . [2] La muerte por cáncer de ovario es más común en América del Norte y Europa que en África y Asia. [5] En los Estados Unidos, es más común en mujeres blancas e hispanas que en mujeres negras o indias americanas. [22]

Los primeros signos y síntomas del cáncer de ovario pueden estar ausentes o ser sutiles. En la mayoría de los casos, los síntomas existen durante varios meses antes de ser reconocidos y diagnosticados . [26] [27] Los síntomas a menudo pueden diagnosticarse erróneamente como síndrome del intestino irritable . [28] Las primeras etapas del cáncer de ovario tienden a ser indoloras, lo que dificulta su detección temprana. Los síntomas pueden variar según el subtipo. [26] Los tumores ováricos limítrofes , también conocidos como tumores ováricos de bajo potencial maligno (LMP), no causan un aumento en los niveles de CA125 y no son identificables con una ecografía. Los síntomas típicos de un tumor LMP pueden incluir distensión abdominal o dolor pélvico. Las masas particularmente grandes tienden a ser benignas o limítrofes. [29] [26]
Los síntomas más típicos del cáncer de ovario incluyen hinchazón , dolor o malestar abdominal o pélvico, dolor de espalda, menstruación irregular o sangrado vaginal posmenopáusico, dolor o sangrado después o durante las relaciones sexuales , pérdida de apetito , fatiga , diarrea , indigestión , acidez estomacal , estreñimiento , náuseas , sensación de saciedad y posiblemente síntomas urinarios (incluyendo micción frecuente y micción urgente ). [27]

Los síntomas posteriores del cáncer de ovario se deben a que la masa en crecimiento causa dolor al presionar otros órganos abdominopélvicos o por metástasis. [26] [30] [31] Debido a la ubicación anatómica de los ovarios en la profundidad de la pelvis, la mayoría de las masas son grandes y avanzadas en el momento del diagnóstico. [14] La masa en crecimiento puede causar dolor si se desarrolla torsión ovárica . Si estos síntomas comienzan a ocurrir con más frecuencia o de manera más severa de lo habitual, especialmente después de que no haya antecedentes significativos de tales síntomas, se considera el cáncer de ovario. [26] [29] Las metástasis pueden causar un nódulo de la Hermana María José . [31] En raras ocasiones, los teratomas pueden causar síndrome de teratoma en crecimiento o gliomatosis peritoneal. [31] Algunas experimentan menometrorragia y sangrado vaginal anormal después de la menopausia en la mayoría de los casos. Otros síntomas comunes incluyen hirsutismo , dolor abdominal, virilización y una masa anexial . [32]
En adolescentes o niños con tumores ováricos, los síntomas pueden incluir dolor abdominal intenso, irritación del peritoneo o sangrado . [33] Los tumores del estroma de los cordones sexuales producen hormonas que pueden conducir al desarrollo prematuro de características sexuales secundarias. Los tumores del estroma de los cordones sexuales en niños prepúberes pueden manifestarse por signos de pubertad temprana ; el dolor abdominal y la distensión también son comunes. Los adolescentes con tumores del estroma de los cordones sexuales pueden experimentar amenorrea . A medida que el cáncer se vuelve más avanzado, puede causar una acumulación de líquido en el abdomen y conducir a distensión. Si la malignidad no ha sido diagnosticada en el momento en que causa ascitis, generalmente se diagnostica poco después. [26] Los cánceres avanzados también pueden causar masas abdominales, masas en los ganglios linfáticos o derrame pleural . [31]
Existen muchos factores de riesgo conocidos que pueden aumentar el riesgo de que una mujer desarrolle cáncer de ovario. El riesgo de desarrollar cáncer de ovario está relacionado con la cantidad de tiempo que una mujer pasa ovulando. [34] Los factores que aumentan el número de ciclos ovulatorios que experimenta una mujer pueden aumentar el riesgo de desarrollar cáncer de ovario. [34] Durante la ovulación, las células son estimuladas a dividirse. Si esta división se regula de manera anormal, pueden formarse tumores que pueden ser malignos. La menarquia temprana y la menopausia tardía aumentan el número de ciclos ovulatorios que una mujer experimenta a lo largo de su vida y, por lo tanto, aumentan el riesgo de desarrollar cáncer de ovario. [29] [34] [35] Dado que la ovulación se suprime durante el embarazo, no tener hijos también aumenta el riesgo de cáncer de ovario. [35] Por lo tanto, las mujeres que no han tenido hijos tienen el doble de riesgo de cáncer de ovario que las que sí los han tenido. [26] Tanto la obesidad como la terapia de reemplazo hormonal también aumentan el riesgo. [26]
El riesgo de desarrollar cáncer de ovario es menor para las mujeres que tienen menos ciclos menstruales, no tienen ciclos menstruales, amamantan , toman anticonceptivos orales, tienen embarazos múltiples y tienen un embarazo a una edad temprana. El riesgo de desarrollar cáncer de ovario se reduce en mujeres que se han sometido a una ligadura de trompas (coloquialmente conocida como "ligadura de las trompas"), a la extirpación de ambos ovarios o a una histerectomía (una operación en la que se extirpa el útero). [27] La edad también es un factor de riesgo. [26] [20] Los factores no genéticos como la diabetes mellitus, el índice de masa corporal alto y el consumo de tabaco también son factores de riesgo para el cáncer de ovario. [23]
El uso de medicamentos para la fertilidad puede contribuir a la formación de tumores ováricos limítrofes , pero el vínculo entre ambos es discutido y difícil de estudiar. [28] Los medicamentos para la fertilidad pueden estar asociados con un mayor riesgo de tumores limítrofes. [31] Las mujeres que han recibido tratamiento para la infertilidad pero siguen siendo nulíparas tienen un mayor riesgo de cáncer epitelial de ovario debido a la exposición hormonal que puede conducir a la proliferación de células. Sin embargo, las mujeres que reciben un tratamiento exitoso para la infertilidad y posteriormente dan a luz no tienen un mayor riesgo. Esto puede deberse al desprendimiento de células precancerosas durante el embarazo, pero la causa sigue sin estar clara. [29] El factor de riesgo puede ser, en cambio, la infertilidad en sí, no el tratamiento. [34]
Las afecciones hormonales como el síndrome de ovario poliquístico y la endometriosis se asocian con el cáncer de ovario, pero el vínculo no está completamente confirmado. [28] La terapia de reemplazo hormonal (TRH) posmenopáusica con estrógeno probablemente aumenta el riesgo de cáncer de ovario. La asociación no se ha confirmado en un estudio a gran escala, [29] [36] pero estudios notables, incluido el Million Women Study, han respaldado este vínculo. La TRH posmenopáusica con estrógeno y progesterona combinados puede aumentar el riesgo contemporáneo si se usa durante más de 5 años, pero este riesgo vuelve a la normalidad después del cese de la terapia. [34] La TRH con estrógeno con o sin progestinas aumenta el riesgo de tumores endometrioides y serosos, pero reduce el riesgo de tumores mucinosos. Las dosis más altas de estrógeno aumentan este riesgo. [31] La endometriosis es otro factor de riesgo para el cáncer de ovario, [34] como lo es el dolor con la menstruación. La endometriosis se asocia con subtipos de células claras y endometrioides, tumores serosos de bajo grado, tumores en estadio I y II, tumores de grado 1 y menor mortalidad. [31]
Antes de la menopausia, la obesidad puede aumentar el riesgo de cáncer de ovario, pero este riesgo no está presente después de la menopausia. Este riesgo también es relevante en aquellas que son obesas y nunca han utilizado terapia de reemplazo hormonal. Una asociación similar con el cáncer de ovario aparece en mujeres más altas. [34]
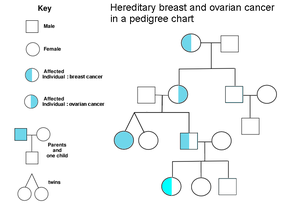
Los antecedentes familiares de cáncer de ovario son un factor de riesgo de cáncer de ovario. Las mujeres con cáncer de colon hereditario no asociado a poliposis (síndrome de Lynch) y aquellas con anomalías genéticas BRCA-1 y BRCA-2 tienen un mayor riesgo.
El principal factor de riesgo genético para el cáncer de ovario es una mutación en los genes BRCA1 o BRCA2 , o en los genes de reparación de desajustes del ADN , que está presente en el 10% de los casos de cáncer de ovario. Solo se necesita mutar un alelo para que una persona tenga alto riesgo. El gen puede heredarse a través de la línea materna o paterna, pero tiene una penetrancia variable . [26] [29] Aunque las mutaciones en estos genes suelen estar asociadas con un mayor riesgo de cáncer de mama, también conllevan un riesgo de por vida sustancial de cáncer de ovario, un riesgo que alcanza su punto máximo en los 40 y 50 años de una persona. El riesgo más bajo citado es del 30% y el más alto del 60%. [28] [26] [29] Las mutaciones en BRCA1 tienen un riesgo de por vida de desarrollar cáncer de ovario del 15 al 45%. [31] Las mutaciones en BRCA2 son menos riesgosas que las de BRCA1 , con un riesgo de por vida del 10% (riesgo más bajo citado) al 40% (riesgo más alto citado). [26] [31] En promedio, los cánceres asociados a BRCA se desarrollan 15 años antes que sus contrapartes esporádicas porque las personas que heredan las mutaciones en una copia de su gen solo necesitan una mutación para iniciar el proceso de carcinogénesis, mientras que las personas con dos genes normales necesitarían adquirir dos mutaciones. [29]
En los Estados Unidos, cinco de cada 100 mujeres con un familiar de primer grado con cáncer de ovario eventualmente desarrollarán cáncer de ovario, lo que coloca a aquellas con familiares afectados en un riesgo tres veces mayor que las mujeres con familiares no afectados. Siete de cada 100 mujeres con dos o más familiares con cáncer de ovario eventualmente desarrollarán cáncer de ovario. [29] [37] En general, entre el 5 y el 10 % de los casos de cáncer de ovario tienen una causa genética. [29] Las mutaciones BRCA están asociadas con cáncer de ovario epitelial seroso no mucinoso de alto grado. [31]

Una fuerte historia familiar de cáncer de endometrio , cáncer de colon u otros cánceres gastrointestinales puede indicar la presencia de un síndrome conocido como cáncer colorrectal hereditario no polipósico (también conocido como síndrome de Lynch), que confiere un mayor riesgo de desarrollar una serie de cánceres, incluido el cáncer de ovario. El síndrome de Lynch es causado por mutaciones en genes de reparación de desajustes, incluidos MSH2 , MLH1 , MLH6, PMS1 y PMS2 . [26] El riesgo de cáncer de ovario para una persona con síndrome de Lynch es de entre el 10 y el 12 por ciento. [26] [29] Las mujeres de ascendencia islandesa , ascendencia judía europea / ascendencia judía asquenazí y ascendencia húngara tienen un mayor riesgo de cáncer de ovario epitelial. [29] El gen del receptor de estrógeno beta ( ESR2 ) parece ser clave para la patogénesis y la respuesta a la terapia. [38] Otros genes que se han asociado con el cáncer de ovario son BRIP1 , MSH6 , RAD51C y RAD51D . [39] CDH1 , CHEK2 , PALB2 y RAD50 también se han asociado con el cáncer de ovario. [40]
Varios trastornos genéticos raros se asocian con subtipos específicos de cáncer de ovario. El síndrome de Peutz-Jeghers , un trastorno genético raro, también predispone a las mujeres a un tumor de los cordones sexuales con túbulos anulares . [28] [26] La enfermedad de Ollier y el síndrome de Maffucci se asocian con tumores de células de la granulosa en niños y también pueden estar asociados con tumores de Sertoli-Leydig. Los fibromas benignos se asocian con el síndrome de carcinoma basocelular nevoide . [26]
El consumo de alcohol no parece estar relacionado con el cáncer de ovario. [31] [41]
La Sociedad Estadounidense del Cáncer recomienda un patrón de alimentación saludable que incluya muchas frutas, verduras, cereales integrales y una dieta que evite o limite las carnes rojas y procesadas y el azúcar procesado. [42] El consumo elevado de grasas totales, saturadas y trans aumenta el riesgo de cáncer de ovario. [43] Una revisión general de 2021 encontró que la ingesta de café, huevos y grasas aumenta significativamente el riesgo de cáncer de ovario. [44] Existe evidencia mixta de estudios sobre el riesgo de cáncer de ovario y el consumo de productos lácteos . [45] [46]
Los países industrializados, con excepción de Japón, tienen tasas elevadas de cáncer epitelial de ovario, lo que puede deberse a la dieta en esos países. Las mujeres blancas tienen un riesgo entre un 30 y un 40 % mayor de padecer cáncer de ovario en comparación con las mujeres negras y las hispanas, probablemente debido a factores socioeconómicos; las mujeres blancas tienden a tener menos hijos y diferentes tasas de cirugías ginecológicas que afectan el riesgo de cáncer de ovario. [29]
La evidencia provisional sugiere que el talco , los pesticidas y los herbicidas aumentan el riesgo de cáncer de ovario. [47] La Sociedad Estadounidense del Cáncer señala que hasta el momento, ningún estudio ha podido vincular con precisión una sola sustancia química en el medio ambiente o en la dieta humana directamente con las mutaciones que causan cáncer de ovario. [48]
Otros factores que se han investigado, como el tabaquismo , los niveles bajos de vitamina D en la sangre, [49] la presencia de quistes ováricos de inclusión y la infección con el virus del papiloma humano (la causa de algunos casos de cáncer de cuello uterino ), han sido refutados como factores de riesgo para el cáncer de ovario. [28] [31] La carcinogenicidad del talco perineal es controvertida, porque puede actuar como irritante si viaja a través del tracto reproductivo hasta los ovarios. [31] [29] [34] Los estudios de casos y controles han demostrado que el uso de talco perineal aumenta el riesgo de cáncer de ovario, pero usar talco con más frecuencia no crea un riesgo mayor. [31] El uso de talco en otras partes del cuerpo no está relacionado con el cáncer de ovario. [34] Sentarse regularmente durante períodos prolongados se asocia con una mayor mortalidad por cáncer de ovario epitelial. El riesgo no se anula con el ejercicio regular, aunque se reduce. [50]
La edad avanzada (hasta los 70 años) es un factor de riesgo para el cáncer epitelial de ovario porque pueden acumularse más mutaciones en las células y, con el tiempo, causar cáncer. Las personas mayores de 80 años tienen un riesgo ligeramente menor. [29]
Fumar tabaco está asociado con un mayor riesgo de cáncer mucinoso de ovario ; después de dejar de fumar , el riesgo eventualmente vuelve a la normalidad. Los niveles más altos de proteína C reactiva están asociados con un mayor riesgo de desarrollar cáncer de ovario. [31]
La supresión de la ovulación, que de otro modo causaría daño al epitelio ovárico y, en consecuencia, inflamación , es generalmente protectora. Este efecto se puede lograr teniendo hijos , tomando anticonceptivos orales combinados y amamantando , todos los cuales son factores protectores. [26] Un período más largo de lactancia materna se correlaciona con una mayor disminución en el riesgo de cáncer de ovario. [34] Cada nacimiento disminuye más el riesgo de cáncer de ovario, y este efecto se ve con hasta cinco nacimientos. Los anticonceptivos orales combinados reducen el riesgo de cáncer de ovario hasta en un 50%, y el efecto protector de los anticonceptivos orales combinados puede durar 25-30 años después de que se suspenden. [29] [34] El uso regular de aspirina ( estudio MALOVA (MALignant OVArian cancer)) [51] [52] o acetaminofeno (paracetamol) puede estar asociado con un menor riesgo de cáncer de ovario; otros AINE no parecen tener un efecto protector similar. [31]
La ligadura de trompas es protectora porque los carcinógenos no pueden llegar al ovario y las fimbrias a través de la vagina, el útero y las trompas de Falopio. [26] La ligadura de trompas también es protectora en mujeres con la mutación BRCA1, pero no con la mutación BRCA2. [31] La histerectomía reduce el riesgo, y la extirpación de las trompas de Falopio y los ovarios ( salpingooforectomía bilateral ) reduce drásticamente el riesgo no solo de cáncer de ovario sino también de cáncer de mama. [28] Este sigue siendo un tema de investigación, ya que el vínculo entre la histerectomía y un menor riesgo de cáncer de ovario es controvertido. Las razones por las que la histerectomía puede ser protectora no se han dilucidado hasta 2015. [34]
Una dieta que incluya grandes cantidades de caroteno , fibra y vitaminas con bajas cantidades de grasa, específicamente, una dieta con verduras sin almidón (por ejemplo, brócoli y cebollas ), puede ser protectora. [29] La fibra dietética se asocia con un riesgo significativamente reducido de cáncer de ovario. [53] Una revisión de 2021 encontró que la ingesta de verduras de hoja verde, verduras allium, fibra, flavonoides y té verde puede reducir significativamente el riesgo de cáncer de ovario. [54]
El cáncer de ovario se forma cuando se producen errores en el crecimiento normal de las células ováricas . Por lo general, cuando las células envejecen o se dañan, mueren y nuevas células ocupan su lugar. El cáncer comienza cuando se forman nuevas células innecesarias y las células viejas o dañadas no mueren como deberían. La acumulación de células adicionales a menudo forma una masa de tejido llamada tumor o crecimiento ovárico. Estas células cancerosas anormales tienen muchas anomalías genéticas que hacen que crezcan excesivamente. [56] Cuando un ovario libera un óvulo , el folículo del óvulo se abre y se convierte en el cuerpo lúteo . Esta estructura necesita ser reparada mediante la división de células en el ovario. [34] La ovulación continua durante mucho tiempo significa una mayor reparación del ovario mediante la división de células, que pueden adquirir mutaciones en cada división. [29]
En general, las mutaciones genéticas más comunes en el cáncer de ovario ocurren en NF1 , BRCA1, BRCA2 y CDK12 . Los cánceres de ovario tipo I, que tienden a ser menos agresivos, tienden a tener inestabilidad de microsatélites en varios genes, incluidos oncogenes (más notablemente BRAF y KRAS ) y supresores tumorales (más notablemente PTEN ). [28] Las mutaciones más comunes en los cánceres de tipo I son KRAS, BRAF, ERBB2, PTEN, PIK3CA y ARID1A. [31] Los cánceres de tipo II, el tipo más agresivo, tienen diferentes genes mutados, incluidos p53 , BRCA1 y BRCA2 . [28] Los cánceres de bajo grado tienden a tener mutaciones en KRAS, mientras que los cánceres de cualquier grado que se desarrollan a partir de tumores de bajo potencial maligno tienden a tener mutaciones en p53. [29] Los cánceres de tipo I tienden a desarrollarse a partir de lesiones precursoras, mientras que los cánceres de tipo II pueden desarrollarse a partir de un carcinoma intraepitelial tubárico seroso. [31] Los cánceres serosos que tienen mutaciones BRCA también tienen inevitablemente mutaciones p53, lo que indica que la eliminación de ambos genes funcionales es importante para que se desarrolle el cáncer. [29]
En el 50% de los cánceres serosos de alto grado, la reparación del ADN por recombinación homóloga es disfuncional, al igual que las vías de señalización de Notch y FOXM1 . También casi siempre tienen mutaciones de p53. Aparte de esto, las mutaciones en el carcinoma seroso de alto grado son difíciles de caracterizar más allá de su alto grado de inestabilidad genómica . BRCA1 y BRCA2 son esenciales para la reparación del ADN por recombinación homóloga, y las mutaciones de la línea germinal en estos genes se encuentran en aproximadamente el 15% de las mujeres con cáncer de ovario. [28] Las mutaciones más comunes en BRCA1 y BRCA2 son las mutaciones de cambio de marco que se originaron en una pequeña población fundadora de judíos asquenazíes. [29]
Casi el 100% de los carcinomas mucinosos raros tienen mutaciones en KRAS y amplificaciones de ERBB2 (también conocido como Her2/neu ). [28] En general, el 20% de los cánceres de ovario tienen mutaciones en Her2/neu . [26]
Los carcinomas serosos pueden desarrollarse a partir de carcinoma intraepitelial tubárico seroso, en lugar de desarrollarse espontáneamente a partir de tejido ovárico. Otros carcinomas se desarrollan a partir de quistes de inclusión corticales, que son grupos de células ováricas epiteliales dentro del estroma . [29]


El diagnóstico de cáncer de ovario comienza con un examen físico (que incluye un examen pélvico ), un análisis de sangre (para CA-125 y, a veces, otros marcadores) y una ecografía transvaginal . [26] [57] A veces, se utiliza un examen rectovaginal para ayudar a planificar una cirugía. [29] El diagnóstico debe confirmarse con cirugía para inspeccionar la cavidad abdominal , tomar biopsias (muestras de tejido para análisis microscópico ) y buscar células cancerosas en el líquido abdominal. Esto ayuda a determinar si una masa ovárica es benigna o maligna. [26]
Las primeras etapas del cáncer de ovario (I/II) son difíciles de diagnosticar porque la mayoría de los síntomas son inespecíficos y, por lo tanto, de poca utilidad en el diagnóstico; como resultado, rara vez se diagnostica hasta que se propaga y avanza a etapas posteriores (III/IV). [58] Además, los síntomas del cáncer de ovario pueden parecer similares al síndrome del intestino irritable . En mujeres en las que existe la posibilidad de embarazo, se puede medir el nivel de BHCG durante el proceso de diagnóstico. La alfa-fetoproteína sérica , la enolasa neuronal específica y la lactato deshidrogenasa se pueden medir en niñas y adolescentes con sospecha de tumores ováricos , ya que las mujeres más jóvenes con cáncer de ovario tienen más probabilidades de tener tumores malignos de células germinales. [26] [31]
Un examen físico, que incluye un examen pélvico, y una ecografía pélvica (transvaginal o de otro tipo) son esenciales para el diagnóstico: el examen físico puede revelar un aumento de la circunferencia abdominal y/o ascitis (líquido dentro de la cavidad abdominal), mientras que el examen pélvico puede revelar una masa ovárica o abdominal. [28] Una masa anexial es un hallazgo significativo que a menudo indica cáncer de ovario, especialmente si es fija, nodular, irregular, sólida y/o bilateral. Entre el 13 y el 21 % de las masas anexiales son causadas por malignidad; Sin embargo, existen otras causas benignas de masas anexiales, incluyendo quiste folicular ovárico , leiomioma , endometriosis , embarazo ectópico , hidrosálpinx , absceso tuboovárico, torsión ovárica , quiste dermoide , cistoadenoma (seroso o mucinoso), absceso diverticular o apendicular, tumor de la vaina nerviosa , riñón pélvico , divertículo ureteral o vesical , mesotelioma quístico benigno del peritoneo, tuberculosis peritoneal o quiste paraovárico . Los ovarios que se pueden palpar también son un signo de cáncer de ovario en mujeres posmenopáusicas. Otras partes de un examen físico para sospecha de cáncer de ovario pueden incluir un examen de mama y un examen rectal digital . La palpación de los ganglios linfáticos supraclaviculares , axilares e inguinales puede revelar linfadenopatía , que puede ser indicativa de metástasis. Otro indicador puede ser la presencia de un derrame pleural , que puede notarse en la auscultación . [31]
Cuando se incluye una neoplasia maligna de ovario en una lista de posibilidades diagnósticas, se indica un número limitado de pruebas de laboratorio. Por lo general, se obtiene un hemograma completo y una prueba de electrolitos séricos; [59] cuando hay un cáncer de ovario, estas pruebas a menudo muestran un número alto de plaquetas (20-25% de las pacientes) y niveles bajos de sodio en sangre debido a señales químicas secretadas por el tumor. [29] Una prueba positiva de inhibina A e inhibina B puede indicar un tumor de células de la granulosa. [31]
Un análisis de sangre para una molécula marcadora llamada CA-125 es útil en el diagnóstico diferencial y en el seguimiento de la enfermedad, pero por sí solo no ha demostrado ser un método eficaz para detectar el cáncer de ovario en etapa temprana debido a su inaceptable baja sensibilidad y especificidad. [59] Los niveles de CA-125 en mujeres premenopáusicas superiores a 200 U/mL pueden indicar cáncer de ovario, al igual que cualquier elevación de CA-125 por encima de 35 U/mL en mujeres posmenopáusicas. Los niveles de CA-125 no son precisos en el cáncer de ovario en etapa temprana, ya que la mitad de los pacientes con cáncer de ovario en etapa I tienen un nivel normal de CA-125. [31] [29] El CA-125 también puede estar elevado en condiciones benignas (no cancerosas), incluyendo endometriosis , embarazo , fibromas uterinos , menstruación , quistes ováricos , lupus eritematoso sistémico , enfermedad hepática , enfermedad inflamatoria intestinal , enfermedad inflamatoria pélvica y leiomioma . [31] [60] El HE4 es otro candidato para las pruebas de cáncer de ovario, aunque no se ha probado ampliamente. Otros marcadores tumorales para el cáncer de ovario incluyen CA19-9 , CA72-4, CA15-3 , proteína ácida inmunosupresora, haptoglobina-alfa, OVX1, mesotelina , ácido lisofosfatídico , osteopontina y factor de crecimiento de fibroblastos 23. [ 31]
El uso de paneles de análisis de sangre puede ayudar en el diagnóstico. [31] [59] El panel OVA1 incluye CA-125, beta-2 microglobulina , transferrina , apolipoproteína A1 y transtiretina . OVA1 por encima de 5,0 en mujeres premenopáusicas y 4,4 en mujeres posmenopáusicas indica un alto riesgo de cáncer. [29] Se utiliza un conjunto diferente de pruebas de laboratorio para detectar tumores del estroma de los cordones sexuales. Los niveles altos de testosterona o sulfato de dehidroepiandrosterona , combinados con otros síntomas y niveles altos de inhibina A e inhibina B pueden ser indicativos de un SCST de cualquier tipo. [32]
La investigación actual está buscando formas de considerar la proteómica de marcadores tumorales en combinación con otros indicadores de la enfermedad (es decir, radiología y/o síntomas) para mejorar la precisión del diagnóstico. El desafío de este enfoque es que la prevalencia dispar del cáncer de ovario significa que incluso las pruebas con una sensibilidad y especificidad muy altas seguirán dando lugar a una serie de resultados falsos positivos, lo que a su vez puede dar lugar a problemas como la realización de procedimientos quirúrgicos en los que no se detecta cáncer intraoperatoriamente. [ cita requerida ] Todavía no se han desarrollado enfoques genómicos para el cáncer de ovario. [31]
La tomografía computarizada se prefiere para evaluar la extensión del tumor en la cavidad abdominopélvica, aunque también se puede utilizar la resonancia magnética . [28] La tomografía computarizada también puede ser útil para encontrar apelmazamiento omental o diferenciar líquido de tumor sólido en el abdomen, especialmente en tumores de bajo potencial maligno. Sin embargo, puede no detectar tumores más pequeños. A veces, se utiliza una radiografía de tórax para detectar metástasis en el tórax o derrame pleural . Otra prueba para la enfermedad metastásica, aunque se utiliza con poca frecuencia, es un enema de bario , que puede mostrar si el colon rectosigmoide está involucrado en la enfermedad. La tomografía por emisión de positrones , las gammagrafías óseas y la paracentesis son de uso limitado; de hecho, la paracentesis puede causar la formación de metástasis en el sitio de inserción de la aguja y puede no proporcionar resultados útiles. [29] Sin embargo, la paracentesis se puede utilizar en casos en los que no hay masa pélvica y todavía hay ascitis. [29] Un médico que sospecha cáncer de ovario también puede realizar una mamografía o una biopsia endometrial (en caso de sangrado anormal) para evaluar la posibilidad de neoplasias malignas de mama y neoplasias malignas de endometrio, respectivamente. La ecografía vaginal es a menudo el estudio de diagnóstico por imágenes de primera línea que se realiza cuando se encuentra una masa anexial. Varias características de una masa anexial indican neoplasia maligna de ovario; por lo general son sólidas, irregulares, multiloculares y/o grandes; y típicamente tienen características papilares, vasos centrales y/o tabiques internos irregulares. [31] Sin embargo, el SCST no tiene características definitivas en el estudio radiográfico. [32]
Para diagnosticar definitivamente el cáncer de ovario, se requiere un procedimiento quirúrgico para inspeccionar el abdomen. Este puede ser un procedimiento abierto ( laparotomía , incisión a través de la pared abdominal ) o una cirugía de ojo de cerradura ( laparoscopia ). Durante este procedimiento, se extrae tejido sospechoso y se envía para análisis microscópico . Por lo general, esto incluye una salpingooforectomía unilateral , la extirpación de un solo ovario y trompa de Falopio afectados. El líquido de la cavidad abdominal también se puede analizar para detectar células cancerosas . Si se encuentra cáncer, este procedimiento también se puede utilizar para determinar el grado de su propagación (que es una forma de estadificación del tumor ). [26]
La pafolacianina está indicada para su uso en adultos con cáncer de ovario para ayudar a identificar lesiones cancerosas durante la cirugía. [61] Es un agente de diagnóstico que se administra en forma de inyección intravenosa antes de la cirugía. [61]
Un método ampliamente reconocido para estimar el riesgo de cáncer maligno de ovario es el índice de riesgo de malignidad (IRM), calculado en base a una evaluación inicial . [28] [62] Una puntuación RMI de más de 200 o 250 generalmente se considera que indica un alto riesgo de cáncer de ovario. [28] [31]
El RMI se calcula como:
Se pueden utilizar dos métodos para determinar la puntuación ecográfica y la puntuación menopáusica; las puntuaciones resultantes se denominan RMI 1 y RMI 2, respectivamente, dependiendo del método utilizado.
Otro método para cuantificar el riesgo de cáncer de ovario es el algoritmo de riesgo de cáncer de ovario (ROCA), que observa los niveles a lo largo del tiempo y determina si aumentan lo suficientemente rápido como para justificar una ecografía transvaginal. [29] El algoritmo de riesgo de malignidad ovárica utiliza los niveles de CA-125 y los niveles de HE4 para calcular el riesgo de cáncer de ovario; puede ser más eficaz que el RMI. Los modelos IOTA se pueden utilizar para estimar la probabilidad de que un tumor anexial sea maligno. [64] Incluyen el modelo de riesgo LR2, el cálculo de riesgo de reglas simples (SRrisk) y el modelo de evaluación de diferentes neoplasias en los anexos (ADNEX) que se puede utilizar para evaluar el riesgo de malignidad en una masa anexial, en función de sus características y factores de riesgo. El algoritmo QCancer (Ovary) se utiliza para predecir la probabilidad de cáncer de ovario a partir de factores de riesgo. [31]
El Sistema de Información y Datos de Ovario-Anejos (ORADS, por sus siglas en inglés) es un sistema estandarizado desarrollado por el Colegio Americano de Radiología para mejorar el manejo y el diagnóstico de masas ováricas y anexiales. Proporciona un marco consistente para interpretar los hallazgos de las imágenes, en particular de la ecografía, y asigna categorías de estratificación de riesgo que guían la toma de decisiones clínicas. Al utilizar un conjunto claro de criterios y terminología, ORADS tiene como objetivo mejorar la comunicación entre los proveedores de atención médica, aumentar la precisión del diagnóstico y, en última instancia, mejorar los resultados de los pacientes en la evaluación de patologías ováricas y anexiales. Además, hay disponible una calculadora ORADS especializada para facilitar la elaboración de informes, lo que ayuda a los radiólogos y médicos a clasificar los hallazgos de manera rápida y precisa de acuerdo con las pautas del sistema. [65]

Los cánceres de ovario se clasifican según la apariencia microscópica de sus estructuras ( histología o histopatología ). La histología dicta muchos aspectos del tratamiento clínico, el manejo y el pronóstico . La patología macroscópica de los cánceres de ovario es muy similar independientemente del tipo histológico: los tumores de ovario tienen masas sólidas y quísticas. [29] Según SEER , los tipos de cánceres de ovario en mujeres de 20 años o más son: [66]
Los cánceres de ovario se dividen histológica y genéticamente en tipo I o tipo II. Los cánceres de tipo I son de grado histológico bajo e incluyen carcinomas endometrioides, mucinosos y de células claras. Los cánceres de tipo II son de grado histológico más alto e incluyen carcinoma seroso y carcinosarcoma. [28]

El cáncer epitelial de ovario generalmente se presenta en una etapa avanzada y se deriva de la transformación maligna del epitelio de la superficie ovárica, el peritoneo o las trompas de Falopio. [67] Es la causa más común de muerte por cáncer ginecológico. [67] Existen varios tipos de cáncer epitelial de ovario, incluidos el tumor seroso, el tumor endometrioide, el tumor de células claras, el tumor mucinoso y los tumores indiferenciados o no clasificados. [68] Anualmente en todo el mundo, 230.000 mujeres serán diagnosticadas y 150.000 morirán. [69] Tiene una tasa de supervivencia a 5 años del 46% después del diagnóstico debido a la etapa avanzada de la enfermedad en el momento del diagnóstico. [69] Por lo general, alrededor del 75% de los pacientes son diagnosticados con una etapa avanzada de la enfermedad debido a la naturaleza asintomática de su presentación. [69] Existe una predisposición genómica al cáncer de ovario epitelial y se ha descubierto que los genes BRCA1 y BRCA2 son los genes causantes del 65-75% del cáncer de ovario epitelial hereditario. [69]
.jpg/440px-Serous_carcinoma_(3061775966).jpg)
El cáncer de ovario seroso es el tipo más común de cáncer de ovario epitelial y representa aproximadamente dos tercios de los casos de cáncer de ovario epitelial. [28] El carcinoma seroso de bajo grado es menos agresivo que los carcinomas serosos de alto grado, aunque normalmente no responde bien a la quimioterapia ni a los tratamientos hormonales. [28] Se cree que los carcinomas serosos comienzan en las trompas de Falopio . [70] [71] El carcinoma seroso de alto grado representa el 75% de todos los cánceres de ovario epiteliales. [69] Alrededor del 15-20% de los carcinomas serosos de alto grado tienen mutaciones de la línea germinal BRCA1 y BRCA2. [69] Histológicamente, el patrón de crecimiento del carcinoma seroso de alto grado es heterogéneo y tiene algunos patrones de crecimiento papilar o sólido. [69] Las células tumorales son atípicas con núcleos grandes e irregulares. [69] Tiene una alta tasa de proliferación. [69] En el 50% de los casos, los carcinomas serosos son bilaterales y en el 85% de los casos, se han diseminado más allá del ovario en el momento del diagnóstico. [72]
Actualmente se reconoce que el carcinoma intraepitelial tubárico seroso (STIC) es la lesión precursora de la mayoría de los llamados carcinomas serosos de ovario de alto grado. [72] El STIC se caracteriza por

El carcinoma de ovario de células pequeñas es raro y agresivo, con dos subtipos principales: hipercalcémico y pulmonar. [73] Esta rara neoplasia maligna afecta más comúnmente a mujeres jóvenes menores de 40 años con un rango entre 14 meses y 58 años. [73] La edad media de diagnóstico de 24 años. [73] Aproximadamente dos tercios de los pacientes presentarán hipercalcemia paraneoplásica, lo que significa que tienen altos niveles de calcio en sangre por una razón desconocida. [73] [74] El tumor secreta una proteína relacionada con la hormona paratiroidea que actúa de manera similar a la PTH y se une a los receptores de PTH en el hueso y el riñón causando hipercalcemia. [73] Investigaciones recientes han encontrado una mutación germinal y somática inactivante del gen SMARCA4 . [73] [75] El subtipo hipercalcémico es muy agresivo y tiene una tasa de supervivencia general del 16% con una tasa de recurrencia del 65% en pacientes que reciben tratamiento. [73] Los pacientes que han propagado la enfermedad a otras partes del cuerpo tienden a morir 2 años después del diagnóstico. [73] La propagación extraovárica está involucrada en el 50% de los casos y la propagación a los ganglios linfáticos está presente en el 55% de los casos. [74] La presentación inicial más común es una masa pélvica unilateral de rápido crecimiento con un tamaño medio de 15 cm. [73] Histológicamente, se caracteriza por muchas láminas de células pequeñas, redondas y muy compactas con racimos, nidos y cordones. [73] [74] La inmunohistoquímica es típicamente positiva para vimentina, citoqueratina, CD10, p53 y WT-1. [73] [75]
El carcinoma de ovario de células pequeñas del subtipo pulmonar se presenta de manera diferente al subtipo hipercalcémico. [73] Por lo general, el cáncer de ovario de células pequeñas pulmonar suele afectar ambos ovarios de mujeres mayores y se parece al carcinoma de células de avena del pulmón . [29] La edad promedio de aparición de la enfermedad es de 59 años y aproximadamente el 45% de los casos son bilaterales para el subtipo pulmonar. [73] Además, varias hormonas pueden estar elevadas en el subtipo pulmonar, incluidas la serotonina, la somatostatina, la insulina, la gastrina y la calcitonina. [73]
Los carcinomas peritoneales primarios se desarrollan a partir del peritoneo , una membrana que cubre la cavidad abdominal que tiene el mismo origen embrionario que el ovario. A menudo se los analiza y clasifica junto con los cánceres de ovario cuando afectan al ovario. [70] [76] Pueden desarrollarse incluso después de que se hayan extirpado los ovarios y pueden parecer similares al mesotelioma . [29]

El carcinoma de células claras de ovario es un subtipo poco común de cáncer epitelial de ovario. Las personas diagnosticadas con carcinoma de células claras de ovario suelen ser más jóvenes a la edad del diagnóstico y se diagnostican en etapas más tempranas que otros subtipos de cáncer epitelial de ovario. [77] [78] La mayor incidencia de carcinoma de células claras de ovario se ha observado entre mujeres asiáticas jóvenes, especialmente las de ascendencia coreana, taiwanesa y japonesa. [77] [78] La endometriosis se ha relacionado con ser el principal factor de riesgo para el desarrollo de carcinoma de células claras de ovario y se ha encontrado que está presente en el 50% de las mujeres diagnosticadas con carcinoma de células claras de ovario. [77] Se informa que el desarrollo de coágulos en las piernas, como tromboembolia venosa profunda o en los pulmones con embolia pulmonar, es un 40% mayor en pacientes con carcinoma de células claras que otros subtipos de cáncer epitelial de ovario. [78] Se ha descubierto que las mutaciones en vías moleculares como ARID1A, PIK3 y PIK3CA están relacionadas con el carcinoma de células claras. [77] [78] Por lo general, se presentan como una masa grande y unilateral, con un tamaño medio de entre 13 y 15 cm. [77] El 90% de los casos son unilaterales. [77] El carcinoma de células claras de ovario no suele responder bien a la quimioterapia debido a la quimiorresistencia intrínseca, por lo que el tratamiento suele consistir en cirugía citorreductora agresiva y quimioterapia basada en platino. [28] [77]

Los adenocarcinomas de células claras son histopatológicamente similares a otros carcinomas de células claras , con células claras y células en uña . Representan aproximadamente el 5-10% de los cánceres epiteliales de ovario y están asociados con endometriosis en la cavidad pélvica. Por lo general, se encuentran en una etapa temprana y, por lo tanto, son curables mediante cirugía, pero los adenocarcinomas de células claras avanzados (aproximadamente el 20%) tienen un pronóstico malo y a menudo son resistentes a la quimioterapia con platino. [29]
Los adenocarcinomas endometrioides representan aproximadamente el 13-15% de todos los cánceres de ovario. [79] Debido a que son típicamente de bajo grado, los adenocarcinomas endometrioides tienen un buen pronóstico. [79] La edad media de diagnóstico es de alrededor de 53 años. [79] Estos tumores frecuentemente coexisten con endometriosis o cáncer de endometrio. [29] [79] Los niveles de antígeno de cáncer 125 son típicamente elevados y una historia familiar de un pariente de primer grado con cáncer de ovario endometrioide se asocia con un mayor riesgo de desarrollar cáncer de ovario endometrioide. [79] El tamaño promedio del tumor es mayor a 10 cm. [79]
Los tumores müllerianos mixtos representan menos del 1% de los cánceres de ovario. Tienen células epiteliales y mesenquimales visibles y tienden a tener un mal pronóstico. [29]
Los tumores mucinosos incluyen el adenocarcinoma mucinoso y el cistadenocarcinoma mucinoso. [29]
Los adenocarcinomas mucinosos representan entre el 5 y el 10 % de los cánceres epiteliales de ovario. Histológicamente, son similares a los adenocarcinomas intestinales o cervicales y, en realidad, suelen ser metástasis de cánceres de apéndice o de colon . Los adenocarcinomas mucinosos avanzados tienen un pronóstico malo, generalmente peor que los tumores serosos, y suelen ser resistentes a la quimioterapia con platino, aunque son poco frecuentes. [29]

El pseudomixoma peritoneal es una acumulación de moco encapsulado o material gelatinoso en la cavidad abdominopélvica, que muy rara vez es causado por un tumor mucinoso ovárico primario. Más comúnmente, se asocia con metástasis ováricas de cáncer intestinal. [29]
Los cánceres indiferenciados (aquellos en los que no se puede determinar el tipo de célula) representan alrededor del 10% de los cánceres epiteliales de ovario y tienen un pronóstico comparativamente malo. [29] [70] Cuando se examinan bajo el microscopio, estos tumores tienen células muy anormales que están dispuestas en grupos o láminas. Por lo general, hay grupos reconocibles de células serosas dentro del tumor. [29]

Los tumores de Brenner malignos son poco frecuentes. Histológicamente, presentan un estroma fibroso denso con áreas de epitelio transicional y cierta diferenciación escamosa. Para clasificarse como tumor de Brenner maligno, debe tener focos tumorales de Brenner y carcinoma de células transicionales. El componente de carcinoma de células transicionales suele estar poco diferenciado y se asemeja al cáncer de las vías urinarias. [29]
Los carcinomas de células transicionales representan menos del 5% de los cánceres de ovario. Histológicamente, parecen similares al carcinoma de vejiga . El pronóstico es intermedio: mejor que la mayoría de los cánceres epiteliales, pero peor que los tumores malignos de Brenner. [29]
Los tumores del estroma de los cordones sexuales , que incluyen el tumor de células de la granulosa productor de estrógenos , el tecoma benigno y el tumor de células de Sertoli-Leydig virilizante o arrenoblastoma , representan el 7 % de los cánceres de ovario. Se presentan con mayor frecuencia en mujeres entre 50 y 69 años de edad, pero pueden presentarse en mujeres de cualquier edad, incluidas las niñas. No suelen ser agresivos y suelen ser unilaterales; [26] por lo tanto, generalmente se tratan solo con cirugía. Los tumores del estroma de los cordones sexuales son los principales tumores ováricos productores de hormonas. [32]
Varias células diferentes del mesénquima pueden dar lugar a tumores de los cordones sexuales o del estroma. Estos incluyen fibroblastos y células endocrinas. Los síntomas de un tumor de los cordones sexuales o del estroma ovárico pueden diferir de otros tipos de cáncer de ovario. Los signos y síntomas comunes incluyen torsión ovárica , hemorragia o ruptura del tumor, una masa abdominal y alteración hormonal. En los niños, la pseudopubertad precoz isosexual puede ocurrir con tumores de células de la granulosa ya que producen estrógeno. Estos tumores causan anomalías en la menstruación ( sangrado excesivo , menstruación infrecuente o ausencia de menstruación ) o sangrado posmenopáusico. Debido a que estos tumores producen estrógeno, pueden causar u ocurrir al mismo tiempo que el cáncer de endometrio o el cáncer de mama . Otros tumores de los cordones sexuales o del estroma presentan síntomas distintos. Los tumores de células de Sertoli-Leydig causan virilización y crecimiento excesivo de vello debido a la producción de testosterona y androstenediona , que también pueden causar síndrome de Cushing en casos raros. También se presentan tumores del estroma de los cordones sexuales que no causan un desequilibrio hormonal, incluidos los fibromas benignos, que causan ascitis e hidrotórax . [26] Dentro de los tumores de células germinales, los tumores del estroma de los cordones sexuales son el cáncer de ovario más común diagnosticado en mujeres menores de 20 años. [32]
Los tumores de células de la granulosa son los tumores del estroma de los cordones sexuales más comunes, representan el 70% de los casos y se dividen en dos subtipos histológicos: tumores de células de la granulosa adultas, que se desarrollan en mujeres mayores de 50 años, y tumores de la granulosa juveniles, que se desarrollan antes de la pubertad o antes de los 30 años. Ambos se desarrollan en el folículo ovárico a partir de una población de células que rodea a las células germinales. [32]
Los tumores de células de la granulosa en adultos se caracterizan por una aparición tardía (más de 30 años, 50 en promedio). Estos tumores producen altos niveles de estrógeno, lo que causa sus síntomas característicos: menometrorragia ; hiperplasia endometrial ; senos sensibles y agrandados ; sangrado posmenopáusico ; y amenorrea secundaria . La masa del tumor puede causar otros síntomas, incluido el dolor y la distensión abdominal, o síntomas similares a un embarazo ectópico si el tumor sangra y se rompe. [32]
Los tumores de Sertoli-Leydig son más comunes en mujeres antes de los 30 años y particularmente comunes antes de la pubertad. [32]
Los tumores estromales esclerosantes suelen aparecer en niñas antes de la pubertad o en mujeres antes de los 30 años. [32]
Los tumores de células germinales del ovario se desarrollan a partir de las células germinales del ovario . [70] Los tumores de células germinales representan alrededor del 30% de los tumores de ovario, pero solo el 5% de los cánceres de ovario, porque la mayoría de los tumores de células germinales son teratomas y la mayoría de los teratomas son benignos. Los teratomas malignos tienden a ocurrir en mujeres mayores, cuando una de las capas germinales del tumor se convierte en un carcinoma de células escamosas . [26] Los tumores de células germinales tienden a ocurrir en mujeres jóvenes (de 20 a 30 años) y niñas, y representan el 70% del cáncer de ovario observado en ese grupo de edad. [33] Los tumores de células germinales pueden incluir disgerminomas, teratomas, tumores del saco vitelino/tumores del seno endodérmico y coriocarcinomas, cuando surgen en el ovario. Algunos tumores de células germinales tienen un isocromosoma 12, en el que se elimina un brazo del cromosoma 12 y se reemplaza por un duplicado del otro. [26] La mayoría de los cánceres de células germinales tienen un mejor pronóstico que otros subtipos y son más sensibles a la quimioterapia. Es más probable que se encuentren en estadio I en el momento del diagnóstico. [32] En general, hacen metástasis con mayor frecuencia que los cánceres epiteliales de ovario. Además, los marcadores de cáncer utilizados varían según el tipo de tumor: los coriocarcinomas se controlan con beta-HCG y los tumores del seno endodérmico con alfa-fetoproteína . [26]
Los tumores de células germinales se descubren típicamente cuando se convierten en masas grandes y palpables. Sin embargo, al igual que los tumores de los cordones sexuales, pueden causar torsión o hemorragia ovárica y, en los niños, pubertad precoz isosexual. Con frecuencia hacen metástasis en los ganglios linfáticos cercanos, especialmente los ganglios linfáticos paraaórticos y pélvicos. [26] El síntoma más común de los tumores de células germinales es el dolor abdominal subagudo causado por el sangrado del tumor, la necrosis o el estiramiento de la cápsula ovárica. Si el tumor se rompe, causa un sangrado significativo o tuerce el ovario, puede causar dolor abdominal agudo , que ocurre en menos del 10% de las personas con tumores de células germinales. También pueden secretar hormonas que cambian el ciclo menstrual . En el 25% de los tumores de células germinales, el cáncer se descubre durante un examen de rutina y no causa síntomas. [32]
El diagnóstico de tumores de células germinales puede ser difícil debido a que el ciclo menstrual normal y la pubertad pueden causar dolor y síntomas pélvicos, y una mujer joven puede incluso creer que estos síntomas son los del embarazo y no buscar tratamiento debido al estigma del embarazo adolescente . Los análisis de sangre para alfa-fetoproteína, cariotipo , gonadotropina coriónica humana y función hepática se utilizan para diagnosticar el tumor de células germinales y la posible disgenesia gonadal coexistente. Un tumor de células germinales puede confundirse inicialmente con un quiste ovárico benigno . [32]

El disgerminoma representa el 35% de los cánceres de ovario en mujeres jóvenes y es el tumor de células germinales con mayor probabilidad de hacer metástasis en los ganglios linfáticos; las metástasis ganglionares ocurren en el 25-30% de los casos. [33] [32] Estos tumores pueden tener mutaciones en el gen KIT , una mutación conocida por su papel en el tumor del estroma gastrointestinal . Las personas con un cariotipo XY y ovarios ( disgenesia gonadal ) o un cariotipo X,0 y ovarios ( síndrome de Turner ) que desarrollan un disgerminoma unilateral corren el riesgo de tener un gonadoblastoma en el otro ovario y, en este caso, generalmente se extirpan ambos ovarios cuando se descubre un disgerminoma unilateral para evitar el riesgo de otro tumor maligno. Los gonadoblastomas en personas con síndrome de Swyer o Turner se vuelven malignos en aproximadamente el 40% de los casos. Sin embargo, en general, los disgerminomas son bilaterales el 10-20% de las veces. [26] [32]

Están compuestos por células que no pueden diferenciarse más y se desarrollan directamente a partir de células germinales o de gonadoblastomas. Los disgerminomas contienen sinciciotrofoblastos en aproximadamente el 5% de los casos y, por lo tanto, pueden causar niveles elevados de hCG. En apariencia macroscópica, los disgerminomas suelen ser de color rosa a tostado, tienen múltiples lóbulos y son sólidos. Microscópicamente, parecen idénticos a los seminomas y muy similares a las células germinales primordiales embrionarias , con células grandes, poliédricas, redondeadas y transparentes . Los núcleos son uniformes y redondos o cuadrados con nucléolos prominentes y el citoplasma tiene altos niveles de glucógeno . La inflamación es otra característica histológica prominente de los disgerminomas. [32]
El coriocarcinoma puede presentarse como un tumor ovárico primario que se desarrolla a partir de una célula germinal, aunque generalmente es una enfermedad gestacional que produce metástasis en el ovario. El coriocarcinoma ovárico primario tiene un pronóstico malo y puede presentarse sin embarazo. Produce niveles altos de hCG y puede causar pubertad temprana en los niños o menometrorragia (menstruación irregular y abundante) después de la menarquia. [32]
.jpg/440px-Mature_Cystic_Teratoma_of_the_Ovary_(5560431170).jpg)
Los teratomas inmaduros o sólidos son el tipo más común de tumor de células germinales de ovario y representan el 40-50% de los casos. Los teratomas se caracterizan por la presencia de tejidos desorganizados que surgen de las tres capas germinales embrionarias : ectodermo , mesodermo y endodermo ; los teratomas inmaduros también tienen células madre indiferenciadas que los hacen más malignos que los teratomas maduros (quistes dermoides). Los diferentes tejidos son visibles en la patología macroscópica y a menudo incluyen hueso, cartílago, cabello, moco o sebo , pero estos tejidos no son visibles desde el exterior, que parece ser una masa sólida con lóbulos y quistes. Histológicamente, tienen grandes cantidades de neuroectodermo organizado en láminas y túbulos junto con glía ; la cantidad de tejido neural determina el grado histológico. Los teratomas inmaduros suelen afectar solo a un ovario (el 10 % coexiste con quistes dermoides) y suelen hacer metástasis en todo el peritoneo. También pueden provocar que los implantes de teratomas maduros crezcan en todo el abdomen en una enfermedad llamada síndrome del teratoma en crecimiento ; estos suelen ser benignos, pero seguirán creciendo durante la quimioterapia y, a menudo, necesitarán más cirugía. A diferencia de los teratomas maduros, los teratomas inmaduros forman muchas adherencias , lo que hace que sea menos probable que provoquen torsión ovárica. No existe un marcador específico para los teratomas inmaduros, pero el antígeno carcinoembrionario (CEA), CA-125, CA19-9 o AFP a veces pueden indicar un teratoma inmaduro. [32]
Los teratomas en estadio I constituyen la mayoría (75%) de los casos y tienen el mejor pronóstico, ya que el 98% de los pacientes sobreviven cinco años; si un tumor en estadio I también es de grado 1, se puede tratar solo con cirugía unilateral. Los tumores en estadio II a IV constituyen el cuarto restante de los casos y tienen un peor pronóstico, ya que entre el 73 y el 88% de los pacientes sobreviven cinco años. [32]
Los teratomas maduros, o quistes dermoides, son tumores raros que consisten principalmente en tejido benigno que se desarrollan después de la menopausia. Los tumores consisten en tejido desorganizado con nódulos de tejido maligno, que pueden ser de varios tipos. La neoplasia maligna más común es el carcinoma de células escamosas , pero el adenocarcinoma , el carcinoma de células basales , el tumor carcinoide , el tumor neuroectodérmico , el melanoma maligno , el sarcoma , el tumor sebáceo y el estruma ovárico también pueden ser parte del quiste dermoide. Se tratan con cirugía y quimioterapia o radiación adyuvante con platino. [32]
Los tumores del saco vitelino , anteriormente llamados tumores del seno endodérmico, representan aproximadamente el 10-20% de las neoplasias malignas de células germinales de ovario y tienen el peor pronóstico de todos los tumores de células germinales de ovario . Se producen tanto antes de la menarquia (en un tercio de los casos) como después de la menarquia (los dos tercios restantes de los casos). La mitad de las personas con tumores del saco vitelino son diagnosticadas en la etapa I. Por lo general, son unilaterales hasta la metástasis, que se produce dentro de la cavidad peritoneal y a través del torrente sanguíneo hasta los pulmones. Los tumores del saco vitelino crecen rápidamente y recurren fácilmente, y no son fácilmente tratables una vez que han recurrido. Los tumores del saco vitelino en etapa I son altamente tratables, con una tasa de supervivencia libre de enfermedad a 5 años del 93%, pero los tumores en etapa II-IV son menos tratables, con tasas de supervivencia del 64-91%. [32]
Su aspecto macroscópico es sólido, friable y amarillento, con áreas necróticas y hemorrágicas. También suelen contener quistes que pueden degenerar o romperse. Histológicamente, los tumores del saco vitelino se caracterizan por la presencia de cuerpos de Schiller-Duval (que son patognomónicos de los tumores del saco vitelino) y un patrón reticular. Los tumores del saco vitelino secretan comúnmente alfa-fetoproteína y pueden teñirse inmunohistoquímicamente para detectar su presencia; el nivel de alfa-fetoproteína en la sangre es un marcador útil de recurrencia. [32]
Los carcinomas embrionarios, un tipo de tumor poco común que se encuentra generalmente en tumores mixtos, se desarrollan directamente a partir de células germinales pero no están diferenciados terminalmente; en casos raros, pueden desarrollarse en gónadas disgenéticas. Pueden evolucionar a una variedad de otras neoplasias, incluyendo coriocarcinoma, tumor del saco vitelino y teratoma. Se presentan en personas más jóvenes, con una edad promedio en el momento del diagnóstico de 14 años, y secretan alfa-fetoproteína (en el 75% de los casos) y hCG. [32]
Histológicamente, el carcinoma embrionario tiene un aspecto similar al disco embrionario , formado por células epiteliales anaplásicas en láminas desorganizadas, con espacios glandulares y estructuras papilares. [32]
Los poliembriomas, la forma más inmadura de teratoma y tumores ováricos muy raros, se caracterizan histológicamente por tener varios cuerpos similares a embriones con estructuras que se asemejan a un disco germinativo, un saco vitelino y un saco amniótico . Las células gigantes del sinciciotrofoblasto también se encuentran en los poliembriomas. [32]
Los carcinomas escamocelulares primarios de ovario son poco frecuentes y tienen un mal pronóstico cuando están avanzados. Más típicamente, los carcinomas escamocelulares de ovario son metástasis cervicales, áreas de diferenciación en un tumor endometrioide o derivados de un teratoma maduro. [29]
Los tumores mixtos contienen elementos de más de una de las clases de histología tumoral mencionadas anteriormente. Para clasificarse como tumor mixto, el tipo menor debe representar más del 10 % del tumor. [31] Aunque los carcinomas mixtos pueden tener cualquier combinación de tipos de células, los cánceres de ovario mixtos suelen ser serosos/endometrioides o de células claras/endometrioides. [29] Los tumores de células germinales mixtos representan aproximadamente el 25-30 % de todos los cánceres de ovario de células germinales, con combinaciones de disgerminoma, tumor del saco vitelino y/o teratoma inmaduro. El pronóstico y el tratamiento varían según los tipos de células componentes. [32]
El cáncer de ovario también puede ser un cáncer secundario, el resultado de la metástasis de un cáncer primario en otra parte del cuerpo. [26] Alrededor del 5-30% de los cánceres de ovario se deben a metástasis, mientras que el resto son cánceres primarios. [80] Los cánceres primarios comunes son el cáncer de mama , el cáncer de colon , el cáncer de apéndice y el cáncer de estómago (los cánceres gástricos primarios que hacen metástasis en el ovario se denominan tumores de Krukenberg ). [26] Los tumores de Krukenberg tienen células en anillo de sello y células mucinosas. [29] El cáncer de endometrio y los linfomas también pueden hacer metástasis en el ovario. [81]
Los tumores ováricos limítrofes , a veces llamados tumores ováricos de bajo potencial maligno (LMP), tienen algunas características benignas y algunas malignas. [29] Los tumores LMP constituyen aproximadamente el 10-15% de todos los tumores ováricos. [31] [70] Se desarrollan antes que el cáncer ovárico epitelial, alrededor de los 40-49 años. Por lo general, no tienen una invasión extensa; el 10% de los tumores LMP tienen áreas de microinvasión estromal (<3 mm, <5% del tumor). Los tumores LMP tienen otras características anormales, que incluyen aumento de la mitosis, cambios en el tamaño de la célula o el tamaño del núcleo , núcleos anormales , estratificación celular y pequeñas proyecciones en las células (proyecciones papilares). Se pueden ver características serosas y/o mucinosas en el examen histológico, y la histología serosa constituye la abrumadora mayoría de los tumores LMP avanzados. Más del 80% de los tumores LMP están en Estadio I; El 15% se encuentran en estadio II y III y menos del 5% en estadio IV. [29] Los implantes de tumores LMP a menudo no son invasivos. [70]
Ovarian cancer is staged using the FIGO staging system and uses information obtained after surgery, which can include a total abdominal hysterectomy via midline laparotomy, removal of (usually) both ovaries and Fallopian tubes, (usually) the omentum, pelvic (peritoneal) washings, assessment of retroperitoneal lymph nodes (including the pelvic and para-aortic lymph nodes), appendectomy in suspected mucinous tumors, and pelvic/peritoneal biopsies for cytopathology.[28][26][31][82] Around 30% of ovarian cancers that appear confined to the ovary have metastasized microscopically, which is why even stage-I cancers must be staged completely.[26] 22% of cancers presumed to be stage I are observed to have lymphatic metastases.[31] The AJCC stage is the same as the FIGO stage. The AJCC staging system describes the extent of the primary tumor (T), the absence or presence of metastasis to nearby lymph nodes (N), and the absence or presence of distant metastasis (M).[83] The most common stage at diagnosis is stage IIIc, with over 70% of diagnoses.[26]

The AJCC/TNM staging system indicates where the tumor has developed, spread to lymph nodes, and metastasis.[31]
The AJCC/TNM stages can be correlated with the FIGO stages:[31]
Grade 1 tumors have well differentiated cells (look very similar to the normal tissue) and are the ones with the best prognosis. Grade 2 tumors are also called moderately well-differentiated and they are made up of cells that resemble the normal tissue. Grade 3 tumors have the worst prognosis and their cells are abnormal, referred to as poorly differentiated.[84]
Metastasis in ovarian cancer is very common in the abdomen and occurs via exfoliation, where cancer cells burst through the ovarian capsule and are able to move freely throughout the peritoneal cavity. Ovarian cancer metastases usually grow on the surface of organs rather than the inside; they are also common on the omentum and the peritoneal lining. Cancer cells can also travel through the lymphatic system and metastasize to lymph nodes connected to the ovaries via blood vessels; i.e. the lymph nodes along the infundibulopelvic ligament, the broad ligament, and the round ligament. The most commonly affected groups include the paraaortic, hypogastric, external iliac, obturator, and inguinal lymph nodes. Usually, ovarian cancer does not metastasize to the liver, lung, brain, or kidneys unless it is a recurrent disease; this differentiates ovarian cancer from many other forms of cancer.[29]
Women with strong genetic risk for ovarian cancer may consider the surgical removal of their ovaries as a preventive measure. This is often done after completion of childbearing years. This reduces the chances of developing both breast cancer (by around 50%) and ovarian cancer (by about 96%) in women at high risk. Women with BRCA gene mutations usually also have their Fallopian tubes removed at the same time (salpingo-oophorectomy), since they also have an increased risk of Fallopian tube cancer. However, these statistics may overestimate the risk reduction because of how they have been studied.[26][85]
Because a large fraction of ovarian cancers originate in the fallopian tubes,[86] the Ovarian Cancer Research Alliance and the Society of Gynecologic Oncology now recommend that women who are not planning on having additional children and who are undergoing surgical procedures such as tubal ligation (having one's "tubes tied") undergo opportunistic salpingo-oophorectomy — i.e. simultaneously having their fallopian tubes removed.[87] OVCARE — BC Cancer's multi-institutional and multidisciplinary ovarian research group — began recommending salpingectomy at the time of hysterectomy and in place of tubal ligation in 2010.[88]
Women with a significant family history for ovarian cancer are often referred to a genetic counselor to see if testing for BRCA mutations would be beneficial.[29] The use of oral contraceptives, the absence of 'periods' during the menstrual cycle, and tubal ligation reduce the risk.[89]There may an association of developing ovarian cancer and ovarian stimulation during infertility treatments. Endometriosis has been linked to ovarian cancers. Human papillomavirus infection, smoking, and talc have not been identified as increasing the risk for developing ovarian cancer.[28]
There is no simple and reliable way to test for ovarian cancer in women who do not have any signs or symptoms. Screening is not recommended in women who are at average risk, as evidence does not support a reduction in death and the high rate of false positive tests may lead to unneeded surgery, which is accompanied by its own risks.[19] Women with high risk of ovarian cancer that are currently identified based on family history and genetic testing may benefit from screening.[90] The Pap test does not screen for ovarian cancer.[27]
Ovarian cancer is usually only palpable in advanced stages.[29] This high risk group has benefited with earlier detection.[28][26][85] Screening is not recommended using CA-125 measurements, HE4 levels, ultrasound, or adnexal palpation in women who are at average risk. Currently there is no national screening programme in the UK for ovarian cancer. CA125 and transvaginal ultrasound can be utilised but there is minimal evidence to suggest this decreases mortality . More recently, the Risk of Ovarian Cancer Algorithm (ROMA) has been shown to detect earlier cancers using CA125 and age but again does not provide a robust measure to decrease mortality at present.[91]
Ovarian cancer has low prevalence, even in the high-risk group of women from the ages of 50 to 60 (about one in 2000), and screening of women with average risk is more likely to give ambiguous results than detect a problem that requires treatment. Because ambiguous results are more likely than detection of a treatable problem, and because the usual response to ambiguous results is invasive interventions, in women of average risk, the potential harms of having screening without an indication outweigh the potential benefits. The purpose of screening is to diagnose ovarian cancer at an early stage when it is more likely to be treated successfully.[26][85]
Screening with transvaginal ultrasound, pelvic examination, and CA-125 levels can be used instead of preventive surgery in women who have BRCA1 or BRCA2 mutations. This strategy has shown some success.[29]
Screening for CA125, a chemical released by ovarian tumours, with follow-up using ultrasound, was shown to be ineffective in reducing mortality in a large-scale UK study.[92]
There have been some screening trials that have used age, family history of ovarian cancer, and mutation status to identify target populations for screening.[90]
Once it is determined that ovarian, fallopian tube or primary peritoneal cancer is present, treatment is scheduled by a gynecologic oncologist (a physician trained to treat cancers of a woman's reproductive system). Gynecologic oncologists can perform surgery on and give chemotherapy to women with ovarian cancer. A treatment plan is developed.[93]
Treatment usually involves surgery and chemotherapy, and sometimes radiotherapy, regardless of the subtype of ovarian cancer.[70][94] Surgical treatment may be sufficient for well-differentiated malignant tumors and confined to the ovary. Addition of chemotherapy may be required for more aggressive tumors confined to the ovary. For patients with advanced disease, a combination of surgical reduction with a combination chemotherapy regimen is standard. Since 1980, platinum-based drugs have had an important role in treating ovarian cancer.[citation needed] Borderline tumors, even following spread outside of the ovary, are managed well with surgery, and chemotherapy is not seen as useful.[95] Second-look surgery and maintenance chemotherapy have not been shown to provide benefit.[29]
Surgery has been the standard of care for decades and may be necessary for obtaining a specimen for diagnosis. The surgery depends upon the extent of nearby invasion of other tissues by the cancer when it is diagnosed. This extent of the cancer is described by assigning it a stage, the presumed type, and the grade of cancer. The gynecological surgeon may remove one (unilateral oophorectomy) or both ovaries (bilateral oophorectomy). The Fallopian tubes (salpingectomy), uterus (hysterectomy), and the omentum (omentectomy) may also be removed. Typically, all of these organs are removed.[96]
For those who test positive for faulty BRCA1 or BRCA2 genes having a risk-reducing surgery is an option. An increasing number of women choose this. At the same time the average waiting time for undergoing the procedure is two-years which is much longer than recommended.[97][98]
For low-grade, unilateral stage-IA cancers, only the involved ovary (which must be unruptured) and Fallopian tube will be removed. This can be done especially in young people who wish to preserve their fertility. However, a risk of microscopic metastases exists and staging must be completed.[28] If any metastases are found, a second surgery to remove the remaining ovary and uterus is needed.[95] Tranexamic acid can be administered prior to surgery to reduce the need for blood transfusions due to blood loss during the surgery.[31]
If a tumor in a premenopausal woman is determined to be a low malignant potential tumor during surgery, and it is clearly stage I cancer, only the affected ovary is removed. For postmenopausal women with low malignant potential tumors, hysterectomy with bilateral salpingo-oophorectomy is still the preferred option. During staging, the appendix can be examined or removed. This is particularly important with mucinous tumors.[29] In children or adolescents with ovarian cancer, surgeons typically attempt to preserve one ovary to allow for the completion of puberty, but if the cancer has spread, this is not always possible. Dysgerminomas, in particular, tend to affect both ovaries: 8–15% of dysgerminomas are present in both ovaries.[33] People with low-grade (well-differentiated) tumors are typically treated only with surgery,[26] which is often curative.[70] In general, germ cell tumors can be treated with unilateral surgery unless the cancer is widespread or fertility is not a factor.[32] In women with surgically staged advanced epithelial ovarian cancer (stages III and IV), studies suggest all attempts should be made to reach complete cytoreduction (surgical efforts to remove the bulk of the tumor).[99]
In advanced cancers, where complete removal is not an option, as much tumor as possible is removed in a procedure called debulking surgery. This surgery is not always successful, and is less likely to be successful in women with extensive metastases in the peritoneum, stage- IV disease, cancer in the transverse fissure of the liver, mesentery, or diaphragm, and large areas of ascites. Debulking surgery has usually only been done once[28] but a recent study has shown a longer overall survival in recurrent ovarian cancer when surgery combined with chemotherapy was performed compared to treatment with chemotherapy alone.[100] Computed tomography (abdominal CT) is often used to assess if primary debulking surgery is possible, but low certainty evidence also suggests fluorodeoxyglucose‐18 (FDG) PET/CT and MRI may be useful as an addition for assessing macroscopic incomplete debulking.[101] More complete debulking is associated with better outcomes: women with no macroscopic evidence of disease after debulking have a median survival of 39 months, as opposed to 17 months with less complete surgery.[26] By removing metastases, many cells that are resistant to chemotherapy are removed, and any clumps of cells that have died are also removed. This allows chemotherapy to better reach the remaining cancer cells, which are more likely to be fast-growing and therefore chemosensitive.[29]
Interval debulking surgery is another protocol used, where neoadjuvant chemotherapy is given, debulking surgery is performed, and chemotherapy is finished after debulking.[95] Though no definitive studies have been completed, it is shown to be approximately equivalent to primary debulking surgery in terms of survival and shows slightly lower morbidity.[29] Previous studies have shown different results from primary debulking versus interval debulking. The ongoing TRUST study may clarify selection criteria for each surgical approach.[102]
There are several different surgical procedures that can be employed to treat ovarian cancer. For stage I and II cancer, laparoscopic (keyhole) surgery can be used, but metastases may not be found. For advanced cancer, laparoscopy is not used, since debulking metastases requires access to the entire peritoneal cavity. Depending on the extent of the cancer, procedures may include a bilateral salpingo-oophorectomy, biopsies throughout the peritoneum and abdominal lymphatic system, omentectomy, splenectomy, bowel resection, diaphragm stripping or resection, appendectomy, or even a posterior pelvic exenteration.[29]
To fully stage ovarian cancer, lymphadenectomy can be included in the surgery, However, it has not offered benefits in terms of survival in either HGSOC[103] or LGSOC.[104] This is particularly important in germ cell tumors because they frequently metastasize to nearby lymph nodes.[26]
If ovarian cancer recurs, secondary surgery is sometimes a treatment option. This depends on how easily the tumor can be removed, how much fluid has accumulated in the abdomen, and overall health.[28] Effectivenes of this surgery depends on surgical technique, completeness of cytoreduction, and extent of disease.[105] It also can be helpful in people who had their first surgery done by a generalist and in epithelial ovarian cancer.[31] Secondary surgery can be effective in dysgerminomas and immature teratomas.[32] Evidence suggests surgery in recurrent epithelial ovarian cancer may be associated with prolonging life in some women with platinum-sensitive disease.[106]
The major side effect of oophorectomy in younger women is early menopause, which can cause osteoporosis. After surgery, hormone replacement therapy can be considered, especially in younger women. This therapy can consist of a combination of estrogen and progesterone, or estrogen alone. Estrogen alone is safe after hysterectomy; when the uterus is still present, unopposed estrogen dramatically raises the risk of endometrial cancer.[28] Estrogen therapy after surgery does not change survival rates.[31] People having ovarian cancer surgery are typically hospitalized afterwards for 3–4 days and spend around a month recovering at home.[107] Surgery outcomes are best at hospitals that do a large number of ovarian cancer surgeries.[29]
It is unclear if laparoscopy or laparotomy is better or worse for FIGO stage I ovarian cancer.[108] There is also no apparent difference between total abdominal hysterectomy and supracervical hysterectomy for advanced cancers. Approximately 2.8% of people having a first surgery for advanced ovarian cancer die within two weeks of the surgery (2.8% perioperative mortality rate).[31] More aggressive surgeries are associated with better outcomes in advanced (stage III or IV) ovarian cancer.[29]
Chemotherapy has been a general standard of care for ovarian cancer for decades, although with variable protocols. Chemotherapy is used after surgery to treat any residual disease, if appropriate. In some cases, there may be reason to perform chemotherapy first, followed by surgery. This is called "neoadjuvant chemotherapy", and is common when a tumor cannot be completely removed or optimally debulked via surgery. Though it has not been shown to increase survival, it can reduce the risk of complications after surgery. If a unilateral salpingo-oophorectomy or other surgery is performed, additional chemotherapy, called "adjuvant chemotherapy", can be given.[28][31] Adjuvant chemotherapy is used in stage 1 cancer typically if the tumor is of a high histologic grade (grade 3) or the highest substage (stage 1c), provided the cancer has been optimally staged during surgery.[31][95] Bevacizumab may be used as an adjuvant chemotherapy if the tumor is not completely removed during surgery or if the cancer is stage IV; it can extend progression-free survival but has not been shown to extend overall survival.[31] Chemotherapy is curative in approximately 20% of advanced ovarian cancers;[29] it is more often curative with malignant germ cell tumors than epithelial tumors.[32] Adjuvant chemotherapy has been found to improve survival and reduce the risk of ovarian cancer recurring compared to no adjuvant therapy in women with early stage epithelial ovarian cancer.[109]
Chemotherapy in ovarian cancer typically consists of platins, a group of platinum-based drugs, combined with non-platins.[110] Platinum-based drugs have been used since 1980. Common therapies can include paclitaxel, cisplatin, topotecan, doxorubicin, epirubicin, and gemcitabine. Carboplatin is typically given in combination with either paclitaxel or docetaxel; the typical combination is carboplatin with paclitaxel.[28][31] Carboplatin is superior to cisplatin in that it is less toxic and has fewer side effects, generally allowing for an improved quality of life in comparison, though both are similarly effective.[31] Three-drug regimens have not been found to be more effective,[28] and platins alone or nonplatins alone are less effective than platins and nonplatins in combination.[31] There is a small benefit in platinum‐based chemotherapy compared with non‐platinum therapy.[111] Platinum combinations can offer improved survival over single platinum. In people with relapsed ovarian cancer, evidence suggests topotecan has a similar effect on overall survival as paclitaxel and topotecan plus thalidomide, whilst it is superior to treosulfan and not as effective as pegylated liposomal doxorubicin in platinum-sensitive people.[112]
Chemotherapy can be given intravenously or in the peritoneal cavity.[26] Though intraperitoneal chemotherapy is associated with longer progression-free survival and overall survival, it also causes more adverse side effects than intravenous chemotherapy.[31] It is mainly used when the cancer has been optimally debulked. Intraperitoneal chemotherapy can be highly effective because ovarian cancer mainly spreads inside the peritoneal cavity, and higher doses of the drugs can reach the tumors this way.[29]
Chemotherapy can cause anemia; intravenous iron has been found to be more effective than oral iron supplements in reducing the need for blood transfusions.[31] Typical cycles of treatment involve one treatment every 3 weeks, repeated for 6 weeks or more.[113] Fewer than 6 weeks (cycles) of treatment is less effective than 6 weeks or more.[31] Germ-cell malignancies are treated differently than other ovarian cancers — a regimen of bleomycin, etoposide, and cisplatin (BEP) is used with 5 days of chemotherapy administered every 3 weeks for 3 to 4 cycles.[26][32] Chemotherapy for germ cell tumors has not been shown to cause amenorrhea, infertility, birth defects, or miscarriage.[32] Maintenance chemotherapy has not been shown to be effective.[31]
In people with BRCA mutations, platinum chemotherapy is more effective.[28] Germ-cell tumors and malignant sex-cord/stromal tumors are treated with chemotherapy, though dysgerminomas and sex-cord tumors are not typically very responsive.[26][33]
If ovarian cancer recurs, it is considered partially platinum-sensitive or platinum-resistant, based on the time since the last recurrence treated with platins: partially platinum-sensitive cancers recurred 6–12 months after last treatment, and platinum-resistant cancers have an interval of less than 6 months. Second-line chemotherapy can be given after the cancer becomes symptomatic because no difference in survival is seen between treating asymptomatic (elevated CA-125) and symptomatic recurrences.[medical citation needed]
For platinum-sensitive tumors, platins are the drugs of choice for second-line chemotherapy, in combination with other cytotoxic agents. Regimens include carboplatin combined with pegylated liposomal doxorubicin, gemcitabine, or paclitaxel.[26] Carboplatin-doublet therapy can be combined with paclitaxel for increased efficacy in some cases. Another potential adjuvant therapy for platinum-sensitive recurrences is olaparib, which may improve progression-free survival but has not been shown to improve overall survival.[31] (Olaparib, a PARP inhibitor, was approved by the US FDA for use in BRCA-associated ovarian cancer that had previously been treated with chemotherapy.[114][115]) For recurrent germ cell tumors, an additional 4 cycles of BEP chemotherapy is the first-line treatment for those who have been treated with surgery or platins.
If the tumor is determined to be platinum-resistant, vincristine, dactinomycin, and cyclophosphamide (VAC) or some combination of paclitaxel, gemcitabine, and oxaliplatin may be used as a second-line therapy.[32]
For platinum-resistant tumors, there are no high-efficacy chemotherapy options. Single-drug regimens (doxorubicin or topotecan) do not have high response rates,[28] but single-drug regimens of topotecan, pegylated liposomal doxorubicin, or gemcitabine are used in some cases.[26][31] Topotecan cannot be used in people with an intestinal blockage. Paclitaxel used alone is another possible regimen, or it may be combined with liposomal doxorubicin, gemcitabine, cisplatin, topotecan, etoposide, or cyclophosphamide.[113] ( See also Palliative care below.)
Novel agents are being developed to inhibit the development of new blood vessels (angiogenesis) for women with ovarian cancer who develop resistance to chemotherapy drugs. As of 2023 there would appear to be a role for these treatments but due to the additional treatment burden and cost of maintenance treatments the risk versus benefits require careful consideration.[116]
Novocure sponsored a phase-2 trial proving efficacy of tumor treating fields in recurrent platinum-resistant ovarian carcinoma, in conjunction with weekly paclitaxel chemotherapy.[45]
Dysgerminomas are most effectively treated with radiation,[33] though this can cause infertility and is being phased out in favor of chemotherapy.[26] Radiation therapy does not improve survival in people with well-differentiated tumors.[26]
In stage 1c and 2 cancers, radiation therapy is used after surgery if there is the possibility of residual disease in the pelvis but the abdomen is cancer-free. Radiotherapy can also be used in palliative care of advanced cancers. A typical course of radiotherapy for ovarian cancer is 5 days a week for 3–4 weeks. Common side effects of radiotherapy include diarrhea, constipation, and frequent urination.[117]
Despite the fact that 60% of ovarian tumors have estrogen receptors, ovarian cancer is only rarely responsive to hormonal treatments. A Cochrane review found a lack of evidence about the effects of tamoxifen in people with relapsed ovarian cancer.[118] Estrogen alone does not have an effect on the cancer, and tamoxifen and letrozole are rarely effective.[28] "Some women with borderline malignancy ovarian cancer and stromal ovarian cancer may receive hormonal therapy."[96]
Immunotherapy is a topic of current research in ovarian cancer. In some cases, the antibody drug bevacizumab, though still a topic of active research, is used to treat advanced cancer along with chemotherapy.[95] It has been approved for this use in the European Union.[119]
Specific follow-up depends on, for example, the type and stage of ovarian cancer, the treatment, and the presence of any symptoms. Usually, a check-up appointment is made about every 2 to 3 months initially, followed by twice per year for up to 5 years.[120] For epithelial ovarian cancers, the most common test upon follow-up is CA-125 level. However, treatment based only on elevated CA-125 levels and not any symptoms can increase side effects without any prolongation of life, so the implication of the outcome of a CA-125 test can be discussed before taking it.[121] The recommendation as of 2014 is recurrent cancer may be present if the CA-125 level is twice normal.[28] Treating a recurrence detected by CA-125 does not improve survival.[31]
For women with germ-cell tumors, follow-up tests generally include alpha-fetoprotein (AFP) and/or human chorionic gonadotropin. For women with stromal cancers, tests for hormones like estrogen, testosterone, and inhibin are sometimes helpful.[121] Inhibin can also be useful for monitoring the progress of sex-cord tumors, along with Müllerian inhibiting substance. AFP can also be used to monitor Sertoli-Leydig tumors.[26] In dysgerminomas, lactate dehydrogenase and its two isozymes (LDH-1 and LDH-2) are used to test for recurrence.[32]
Women with ovarian cancer may not need routine surveillance imaging to monitor the cancer unless new symptoms appear or tumor markers begin rising.[122] Imaging without these indications is discouraged because it is unlikely to detect a recurrence, improve survival, and because it has its own costs and side effects.[122] However, CT imaging can be used if desired, though this is not common.[28] If a tumor is easily imaged, imaging may be used to monitor the progress of treatment.[123]
Palliative care focuses on relieving symptoms and increasing or maintaining quality of life. This type of treatment's purpose is not to cure the cancer but to make the woman more comfortable while living with cancer that can not be cured. It has been recommended as part of the treatment plan for any person with advanced ovarian cancer or patients with significant symptoms.[124] In platinum-refractory and platinum-resistant cases, other palliative chemotherapy is the main treatment.[29][96]
Palliative care can entail treatment of symptoms and complications of the cancer, including pain, nausea, constipation, ascites, bowel obstruction, edema, pleural effusion, and mucositis. Especially if the cancer advances and becomes incurable, treatment of symptoms becomes one of the main goals of therapy. Palliative care can also entail helping with decision-making such as if or when hospice care is appropriate, and the preferred place for the patient at end of life care.[31]
Bowel obstruction can be treated with palliative surgery (colostomy, ileostomy, or internal bypass) or medicine, but surgery has been shown to increase survival time.[28][31] Palliative surgery may result in short bowel syndrome, enterocutaneous fistula, or re-obstruction; or may not be possible due to the extent of obstruction.[29] Other treatments of complications can include total parenteral nutrition, a low-residue diet, palliative gastrostomy, and adequate pain control.[28] Bowel obstruction can also be treated with octreotide when palliative surgery is not an option. Cancer can also block the ureters, which can be relieved by a nephrostomy or a ureteric stent. Ascites can be relieved by repeated paracentesis or placement of a drain to increase comfort.[125] Pleural effusions can be treated in a similar manner, with repeated thoracentesis, pleurodesis, or placement of a drain.[29]
Radiation therapy can be used as part of the palliative care of advanced ovarian cancer, since it can help to shrink tumors that are causing symptoms.[96] Palliative radiotherapy typically lasts for only a few treatments, a much shorter course of therapy than non-palliative radiotherapy.[117] It is also used for palliation of chemotherapy-resistant germ cell tumors.[32]
Ovarian cancer has a significant effect on quality of life, psychological health and well-being. Interventions are available to help with the needs and social support. Many ovarian cancer survivors report a good quality of life and optimism. Others reported a "spiritual change" that helped them find meaning during their experience. Others have described their loss of faith after their diagnosis with ovarian cancer. Those who have gone through treatment sometimes experience social isolation but benefit from having relationships with other survivors. Frustration and guilt have been described by some who have expressed their inability to care for their family.[126]
Self-esteem and body image changes can occur due to hair loss, removal of ovaries and other reproductive structures, and scars. There is some improvement after hair grows in. Sexual issues can develop. The removal of ovaries results in surgically induced menopause that can result in painful intercourse, vaginal dryness, loss of sexual desire and being tired. Though prognosis is better for younger survivors, the impact on sexuality can still be substantial.[126]
Anxiety, depression and distress is present in those surviving ovarian cancer at higher rates than in the general population.[126][127] The same psychosocial problems can develop in family members. Emotional effects can include a fear of death, sadness, memory problems and difficulty in concentrating. When optimism was adopted by those at the beginning of their treatment, they were less likely to develop distress. Those who have fear of the cancer recurring may have difficulty in expressing joy even when disease-free. The more treatments that a woman undergoes, the more likely the loss of hope is expressed. Women often can cope and reduce negative psychosocial effects by a number of strategies. Activities such as traveling, spending additional time with family and friends, ignoring statistics, journaling and increasing involvement in spiritually-based events are adaptive.[126]
Women with ovarian cancer may also experience difficulties with their diet and are at risk of malnutrition.[128]

Ovarian cancer usually has a relatively poor prognosis. It is disproportionately deadly because it lacks any clear early detection or screening test, meaning most cases are not diagnosed until they have reached advanced stages.[122][28]
Ovarian cancer metastasizes early in its development, often before it has been diagnosed. High-grade tumors metastasize more readily than low-grade tumors. Typically, tumor cells begin to metastasize by growing in the peritoneal cavity.[26] More than 60% of women presenting with ovarian cancer have stage-III or stage-IV cancer, when it has already spread beyond the ovaries. Ovarian cancers shed cells into the naturally occurring fluid within the abdominal cavity. These cells can then implant on other abdominal (peritoneal) structures, including the uterus, urinary bladder, bowel, lining of the bowel wall, and omentum, forming new tumor growths before cancer is even suspected.
The five-year survival rate for all stages of ovarian cancer is 46%; the one-year survival rate is 72% and the ten-year survival rate is 35%.[130] For cases where a diagnosis is made early in the disease, when the cancer is still confined to the primary site, the five-year survival rate is 92.7%.[131] About 70% of women with advanced disease respond to initial treatment, most of whom attain complete remission, but half of these women experience a recurrence 1–4 years after treatment.[26] Brain metastasis is more common in stage III/IV cancer but can still occur in cancers staged at I/II. People with brain metastases survive a median of 8.2 months, though surgery, chemotherapy, and whole brain radiation therapy can improve survival.[31]
Ovarian cancer survival varies significantly with subtype. Dysgerminomas have a very favorable prognosis. In early stages, they have a five-year survival rate of 96.9%.[33] Around two-thirds of dysgerminomas are diagnosed at stage I.[32] Stage-III dysgerminomas have a five-year survival of 61%; when treated with BEP chemotherapy after incomplete surgical removal, dysgerminomas have a 95% two-year survival rate. Sex-cord-stromal malignancies also have a favorable prognosis; because they are slow-growing, even those with metastatic disease can survive a decade or more.[26] Low malignant potential tumors usually only have a bad prognosis when there are invasive tumor implants found in the peritoneal cavity.[29]
Complications of ovarian cancer can include spread of the cancer to other organs, progressive function loss of various organs, ascites, and intestinal obstructions, which can be fatal. Intestinal obstructions in multiple sites are the most common proximate cause of death.[28] Intestinal obstruction in ovarian cancer can either be a true obstruction, where tumor blocks the intestinal lumen, or a pseudo-obstruction, when tumor prevents normal peristalsis.[132] Continuous accumulation of ascites can be treated by placing a drain that can be self-drained.[28]
There are a number of prognostic factors in ovarian cancer. Positive prognostic factors – those indicating better chances of survival – include no residual disease after surgery (stage III/IV), complete macroscopic resection (stage IV), BRCA2 mutations, young age (under 45 years), nonserous type, low histologic grade, early stage, co-occurrence with endometrial cancer, and low CA-125 levels. There is conflicting evidence for BRCA1 as a prognostic factor. Conversely, negative prognostic factors – those that indicate a worse chance of survival – include rupture of the ovarian capsule during surgery, older age (over 45 years), mucinous type, stage IV, high histologic grade, clear-cell type, upper abdominal involvement, high CA-125 levels, the presence of tumor cells in the blood, and elevated cyclooxygenase-2.[31]
Expression of various mRNAs can also be prognostic for ovarian cancer. High levels of Drosha and Dicer are associated with improved survival, whereas high levels of let-7b, HIF1A, EphA1, and poly(ADP-ribose) polymerase are associated with worse survival. Cancers that are positive for WT1 carry a worse prognosis; estrogen-receptor positive cancers have a better prognosis.[31]
Overall five-year survival rates for all types of ovarian cancer are presented below by stage and histologic grade:[26]
The survival rates given below are for the different types of ovarian cancer, according to American Cancer Society.[129] They come from the National Cancer Institute, SEER, and are based on patients diagnosed from 2004 to 2010.
Ovarian cancer frequently recurs after treatment. Overall, in a 5-year period, 20% of stage I and II cancers recur. Most recurrences are in the abdomen.[29] If a recurrence occurs in advanced disease, it typically occurs within 18 months of initial treatment (18 months progression-free survival). Recurrences can be treated, but the disease-free interval tends to shorten and chemoresistance increases with each recurrence.[28] When a dysgerminoma recurs, it is most likely to recur within a year of diagnosis, and other malignant germ cell tumors recur within 2 years 90% of the time. Germ cell tumors other than dysgerminomas have a poor prognosis when they relapse, with a 10% long-term survival rate.[32] Low malignant potential tumors rarely relapse, even when fertility-sparing surgery is the treatment of choice. 15% of LMP tumors relapse after unilateral surgery in the previously unaffected ovary, and they are typically easily treated with surgery. More advanced tumors may take up to 20 years to relapse, if they relapse at all, and are only treated with surgery unless the tumor has changed its histological characteristics or grown very quickly. In these cases, and when there is significant ascites, chemotherapy may also be used. Relapse is usually indicated by rising CA-125 levels and then progresses to symptomatic relapse within 2–6 months.[29] Recurrent sex cord-stromal tumors are typically unresponsive to treatment but not aggressive.[32]
It is the most deadly gynecologic cancer.[29]
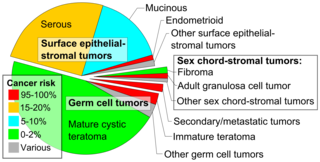
Globally, in 2018, the incidence of ovarian cancer was 6.6 per 100,000 and mortality was 3.9.[135] Globally, about 160,000 people died from ovarian cancer in 2010. This was an increase from 113,000 in 1990.[136] The number of new cases per year in Europe is approximately 5–15 per 100,000 women.[31] In Europe, Lithuania, Latvia, Ireland, Slovakia, and the Czech Republic have the highest incidences of ovarian cancer, whereas Portugal and Cyprus have the lowest incidences.[31] In 2008, the five-year survival rate was 44%. This has increased since 1977 when the survival rate was 36%.[126]


In 2022, in the United States, an estimated 19,880 new cases were diagnosed and 12,810 women died of ovarian cancer.[138] The 5-year relative survival rate is 49.7%.[139] Around 57% cases have metastasized at the time of diagnosis.[139]
In 2014, over 220,000 diagnoses of epithelial ovarian cancer were made yearly.[28] The overall lifetime risk in the US is around 1.6%[26][31] In the US, ovarian cancer affects 1.3–1.4% and is the cause of death of about 1% of women.[29][140] In the United States, it is also the fifth-most common cancer in women but the fourth-most common cause of cancer death.[31] This decrease made it the ninth-most common cancer in women.[29]
The risks from developing specific types of ovarian cancer varies. Germ cell tumors and sex cord-stromal tumors are less common than epithelial tumors. The number of new cases a year in the US is 0.4 per 100,000 women and 0.2 per 100,000 women, respectively. In young people, sex-cord stromal tumors and germ cell tumors total 1% of overall ovarian cancer.[32] Ovarian cancer represents approximately 4% of cancers diagnosed in women.[31]
It is the 5th-most common cancer in UK women (around 7,100 were diagnosed in 2011) and the 5th-most common cause of cancer death in women (around 4,300 died in 2012).[141][31][34] The incidence rate over the whole UK population is 21.6 per 100,000.
As of 2014, the UK saw approximately 7,000–7,100 yearly diagnoses with 4,200 deaths.[28][34] A 2022 article from The Times put the estimate at 7,500 new cases yearly in Britain.[142] Early symptoms are often mistaken for common conditions such as cystitis or irritable bowel syndrome, and about 40 per cent of UK women wrongly believe that cervical screening detects ovarian cancer, an increase from 30 per cent in 2016.[142] Ashkenazi Jewish women carry mutated BRCA alleles five times more often than the rest of the population, giving them a higher risk developing ovarian cancer.[28]
Black women have twice the risk for sex cord-stromal tumors compared to non-Black women.[32] The highest prevalence is in Caucasian and Hispanic women, followed by African-American and Asian women.[135] The highest mortality from ovarian cancer is in African-American women.[135]
In the US, the incidence rate in women over 50 is approximately 33 per 100,000.[143] The rate of ovarian cancer between 1993 and 2008 decreased in women of the 40–49 age cohort and in the 50–64 age cohort.[28] Ovarian cancer is most commonly diagnosed after menopause,[34] between the ages of 60 and 64. Ninety percent of ovarian cancer occurs in women over the age of 45 and 80% in women over 50.[31] Older women are more likely to present with advanced ovarian cancer.[20]
Malignant germ cell tumors are the type of ovarian cancer most likely to occur during pregnancy. They are typically diagnosed when an adnexal mass is found on examination (in 1–2% of all pregnancies), a tumor is seen on ultrasound, or the parent's level of alpha-fetoprotein is elevated. Dermoid cysts and dysgerminomas are the most common germ cell tumors during pregnancy. Germ cell tumors diagnosed during pregnancy are unlikely to have metastasized and can be treated by surgery and, in some cases, chemotherapy, which carries the risk of birth defects. Yolk sac tumors and immature teratomas grow particularly quickly and are usually treated with chemotherapy even during pregnancy; however, dysgerminomas that have been optimally debulked may be treated after childbirth.[32]
Ovarian tumors have been reported in equine mares. Reported tumor types include teratoma,[144][145] cystadenocarcinoma,[146] and particularly granulosa cell tumor.[147][148][149][150][151][excessive citations]
Screening by hysteroscopy to obtain cell samples obtained for histological examination is being developed. This is similar to the current pap smear that is used to detect cervical cancer.[152] The UK Collaborative Trial of Ovarian Cancer Screening is testing a screening technique that combines CA-125 blood tests with transvaginal ultrasound.[28] Other studies suggest that this screening procedure may be effective.[119] Although results published in 2015 were not conclusive, there was some evidence that screening may save lives in the long-term.[153] As a result, the trial has been extended and will publish definitive results at the end of 2019. One major problem with screening is no clear progression of the disease from stage I (noninvasive) to stage III (invasive) is seen, and it may not be possible to find cancers before they reach stage III. Another problem is that screening methods tend to find too many suspicious lesions, most of which are not cancer, but malignancy can only be assessed with surgery.[28] The ROCA method combined with transvaginal ultrasonography is being researched in high-risk women to determine if it is a viable screening method. It is also being investigated in normal-risk women as it has shown promise in the wider population.[29] Studies are also in progress to determine if screening helps detect cancer earlier in people with BRCA mutations.[119]
Researchers from BGI Genomics and Fudan University have uncovered significant findings on ovarian cancer (OV) in Chinese patients, revealing a unique RAD51D variant that may serve as a therapeutic target[12]. Published in JCO Global Oncology, the study identified an enriched RAD51D variant associated with tumor growth promotion. Notably, the RAD51D K91fs variant was found to increase sensitivity to PARP inhibitors, such as olaparib and niraparib, offering new treatment avenues.
Research into various prognostic factors for ovarian cancer is also going on. Recent research shows that thrombocytosis predicts lower survival and higher stage cancer.[28] Ongoing research is also investigating the benefits of surgery for recurrent ovarian cancer.[119]
While an active area of research, as of 2018 there is no good evidence that immunotherapy is effective for ovarian cancer.[154] However, trials of the antibody and VEGF inhibitor bevacizumab, which can slow the growth of new blood vessels in the cancer, have shown promising results, especially in combination with pazopanib, which also slows the process of blood vessel growth. Bevacizumab has been particularly effective in preliminary studies on stage-III and -IV cancer[28] and has been cited as having at least a 15% response rate.[26] It is being investigated particularly in mucinous ovarian cancers.[119]
mTOR inhibitors were a highly investigated potential treatment in the 2000s and 2010s, but the side effects of these drugs (particularly hyperglycemia and hyperlipidemia) were not well tolerated and the survival benefit not confirmed. PI3 kinase inhibitors have been of interest, but they tend to be highly toxic and cause diarrhea. Another investigated drug is selumetinib, a MAPK inhibitor. It improved survival, but did not correlate with any mutations found in tumors.[28]
Bevacizumab can also be combined with platinum chemotherapy, a combination that has had positive preliminary results in PFS, but equivocal results regarding overall survival. One disadvantage to these treatments is the side effect profile, which includes high blood pressure and proteinuria. The drug can also exacerbate bowel disease, leading to fistulae or bowel perforation. Vintafolide, which consists of an antifolate conjugated with vinblastine, is also in clinical trials; it may prove beneficial because folate receptors are overexpressed in many ovarian cancers.[28] Another potential immunotherapy is trastuzumab, which is active against tumors positive for Her2/neu mutations.[26] Other angiogenesis inhibitors are also being investigated as potential ovarian cancer treatments. Combretastatin and pazopanib are being researched in combination for recurrent ovarian cancer. Trebananib and tasquinimod are other angiogenesis inhibitors being investigated. The monoclonal antibody farletuzumab is being researched as an adjuvant to traditional chemotherapy. Another type of immunotherapy involves vaccines, including TroVax.[119]
An alternative to BEP chemotherapy, a regimen of 3 cycles of carboplatin and etoposide, is a current topic of research for germ cell malignancies.[32]
Intraperitoneal chemotherapy has also been under investigation during the 2000s and 2010s for its potential to deliver higher doses of cytotoxic agent to tumors. Preliminary trials with cisplatin and paclitaxel have shown it is not well tolerated, but does improve survival, and more tolerable regimens are being researched.[28] Cisplatin and paclitaxel are both being researched as intraperitoneal chemotherapy agents. A specific chemotherapy regimen for rare clear-cell cancers is also under investigation: irinotecan combined with cisplatin.[119]
PARP inhibitors have also shown promise in early trials, particularly in people with BRCA gene mutations, since the BRCA protein interacts with the PARP pathway. It is also being studied in recurrent ovarian cancer in general, where preliminary studies have shown longer PFS. Specifically, olaparib has shown greater survival compared to doxorubicin, though this treatment is still being investigated. It is not clear yet which biomarkers are predictive of responsiveness to PARP inhibitors.[28] Rucaparib is another PARP inhibitor being researched in BRCA-positive and BRCA-negative recurrent advanced ovarian cancer. Niraparib is a PARP inhibitor being tested in BRCA-positive recurrent ovarian cancer.[119]
Tyrosine kinase inhibitors are another investigational drug class that may have applications in ovarian cancer. Angiogenesis inhibitors in the receptor tyrosine kinase inhibitor group, including pazopanib, cediranib, and nintedanib, have also been shown to increase progression free survival (PFS), but their benefit for overall survival has not been investigated as of 2015.[28] Preliminary research showed that cediranib combined with platins in recurrent ovarian cancer increased the time to second recurrence by 3–4 months and increased survival by 3 months.[119] MK-1775 is a tyrosine kinase inhibitor that is being used in combination with paclitaxel and carboplatin in platinum-sensitive cancers with p53 mutations. Nintedanib is being researched as a potential therapy in combination with cyclophosphamide for people with recurrences.[119]
Histone deacetylase inhibitors (HDACi) are another area of research.
Hormone therapies are a topic of current research in ovarian cancer, particularly, the value of certain medications used to treat breast cancer. These include tamoxifen, letrozole, and anastrozole. Preliminary studies have showed a benefit for tamoxifen in a small number of people with advanced ovarian cancer. Letrozole may help to slow or stop growth of estrogen receptor positive ovarian cancer. Anastrozole is being investigated in postmenopausal people with estrogen receptor-positive cancer.[119]
Research into mitigating side effects of ovarian cancer treatment is also ongoing. Radiation fibrosis, the formation of scar tissue in an area treated with radiation, may be relieved with hyperbaric oxygen therapy, but research has not been completed in this area. Treatment of ovarian cancer may also cause people to experience psychiatric difficulties, including depression. Research is ongoing to determine how counseling and psychotherapy can help people who have ovarian cancer during treatment.[119]
There are some indications that pelvic inflammatory disease may be associated with ovarian cancer, especially in non-western countries. It may be due to the inflammatory process present with pelvic inflammatory disease.[155]
Clinical trials are monitored and funded by US governmental organizations to test treatment options to see if they are safe and effective. These include NIH Clinical Research Trials and You (National Institutes of Health),[156] Learn About Clinical Trials (National Cancer Institute),[157] Search for Clinical Trials (National Cancer Institute),[158] ClinicalTrials.gov (National Institutes of Health).[159][93] Clinical trials are also conducted in Canada.[160]
Recent research suggests that the fimbrial distal fallopian tube is the most likely origin of HGSC. This has led to the development of a prevention plan for the general population: opportunistic salpingectomy, the removal of both fallopian tubes. ... Opportunistic salpingectomy holds promise in reducing the risk of OC and can be safely implemented in most OB-GYN practices. Ongoing research and long-term follow-up studies are essential to fully understand its impact on OC incidence and optimize its implementation in clinical practice.