
Un motivo de unión a ATP es una secuencia de 250 residuos dentro de la estructura primaria de una proteína de unión a ATP . El motivo de unión está asociado con la estructura y/o función de una proteína. [1] El ATP es una molécula de energía y puede ser una coenzima, involucrada en varias reacciones biológicas. El ATP es competente para interactuar con otras moléculas a través de un sitio de unión. El sitio de unión del ATP es el entorno en el que el ATP activa catalíticamente la enzima y, como resultado, se hidroliza a ADP. [2] La unión de ATP provoca un cambio conformacional en la enzima con la que interactúa. [3]
La similitud genética y funcional de tal motivo demuestra la microevolución : las proteínas han cooptado la misma secuencia de unión de otras enzimas en lugar de desarrollarlas de forma independiente. [4]
Los sitios de unión de ATP, que pueden ser representativos de un motivo de unión de ATP, están presentes en muchas proteínas que requieren un aporte de energía (del ATP), como sitios como transportadores activos de membrana , subunidades de microtúbulos , proteínas del flagelo y diversas enzimas hidrolíticas y proteolíticas . [5]
Los motivos cortos que implican la unión de ATP son los motivos Walker , Walker A, también conocido como bucle P, y Walker B, así como el motivo C y el motivo interruptor. [6]
El sitio A de Walker tiene una secuencia de aminoácidos primaria de GxxGxGKS o GxxGxGKT . La letra x puede representar cualquier aminoácido. [7]
La secuencia de aminoácidos primaria del sitio Walker B es hhhhD , en la que h representa cualquier aminoácido hidrofóbico . [7]
El motivo C, también conocido como motivo característico, motivo LSGGQ o péptido conector, tiene una secuencia de aminoácidos primaria de LSGGQQ/R/KQR . [8] [9]
Debido a la variedad de diferentes aminoácidos que se pueden utilizar en la secuencia primaria , tanto del sitio A como del B de Walker, los aminoácidos no variantes dentro de la secuencia están altamente conservados . Una mutación de cualquiera de estos aminoácidos afectará la unión del ATP o interferirá con la actividad catalítica de la enzima. [7] La secuencia de aminoácidos primaria determina la estructura tridimensional de cada motivo. [3]
Todos los dominios de unión de ATP están formados por aproximadamente 250 residuos y dos subunidades, lo que crea un dímero . Estos residuos se pliegan en seis hélices α y cinco cadenas β. [7] [9]
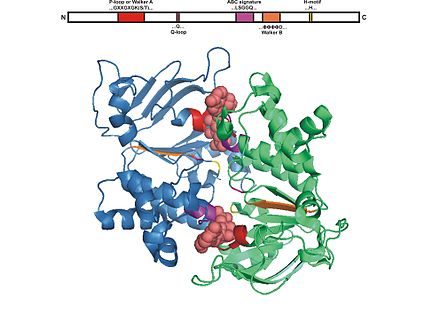
Estructuralmente, el motivo Walker A consta de una hélice α y siempre va seguido de un bucle rico en glicina. [7]
El motivo Walker B es una cadena β . Los motivos de Walker están conectados entre sí mediante una secuencia peptídica de aproximadamente 100 residuos. Estructuralmente, estos residuos de conexión se pliegan en un dominio helicoidal α. [7]
Inmediatamente después del motivo Walker B, se encuentra el motivo característico. [7]
Se ha descubierto que el motivo de cambio está ubicado al final de la cadena β4 en las proteínas de unión a ATP. [7]
Cada motivo de unión de ATP tiene un papel diferente que desempeñar, ya sea que esté directamente involucrado con la unión de ATP o ayude con la construcción del transportador del casete de unión de ATP (ABC) . [6] La molécula de ATP se une al punto de conexión de cada subunidad del dímero, lo que indica que el ATP está muy cerca de ambas subunidades durante la catálisis. Los dos motivos de unión con los que interactúa directamente el ATP son los residuos del motivo Walker A, ubicado en una de las subunidades, y los residuos del motivo de unión C, ubicado en la otra subunidad. El motivo de unión de Walker A tiene una cadena lateral de lisina , que es esencial para la unión de ATP. El residuo de lisina forma enlaces de hidrógeno con los átomos de oxígeno de dos grupos fosfato dentro del ATP, creando así proximidad y orientación del ATP en el sitio de unión. [9] [7]
Para que el motivo Walker A se una al ATP, la molécula de ATP debe estar en el sitio de unión. El motivo característico actúa como una señal para el motivo Walker A, permitiéndole saber cuándo la molécula de ATP se ha unido al sitio de unión. El motivo característico hace esto permitiendo que sus residuos se extiendan desde la subunidad en la que se encuentran hacia la otra subunidad donde está el motivo Walker A. Es necesario que el ATP se una a ambos dominios de unión de nucleótidos para completar la estructura catalíticamente activa. [9]
El motivo Walker B contiene el aminoácido glutamato dentro de la secuencia corta. El glutamato se puede utilizar para realizar un ataque nucleofílico a la molécula de ATP. [6]
En el motivo de unión del interruptor se encuentra un residuo de histidina . La función de la histidina es influir catalíticamente en la reacción poniendo en contacto los residuos a través de la interfaz del dímero, incluido el motivo Walker A y el motivo Walker B. Es el residuo de histidina el que forma el estrecho acoplamiento entre la unión de la molécula de ATP y el dímero. [6] [9]
Después de la hidrólisis del ADP, debe ocurrir un cambio conformacional para separar el casete de unión de ATP. Esta separación es impulsada por una repulsión electrostática por el producto ADP que está unido al motivo Walker A y el producto fosfato inorgánico está unido al motivo C. [10]
{{cite book}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )