Un ion hidrógeno se crea cuando un átomo de hidrógeno pierde un electrón . Un ion hidrógeno (o protón ) cargado positivamente puede combinarse fácilmente con otras partículas y, por lo tanto, solo se ve aislado cuando está en estado gaseoso o en un espacio casi libre de partículas. [1] Debido a su densidad de carga extremadamente alta, aproximadamente 2×10 10 veces mayor que la de un ion sodio, el ion hidrógeno desnudo no puede existir libremente en solución ya que se hidrata fácilmente, es decir, se une rápidamente. [2] La IUPAC recomienda el ion hidrógeno como término general para todos los iones de hidrógeno y sus isótopos . [3] Dependiendo de la carga del ion, se pueden distinguir dos clases diferentes: iones con carga positiva e iones con carga negativa.

Un átomo de hidrógeno está formado por un núcleo con carga +1 y un solo electrón. Por lo tanto, el único ion con carga positiva posible tiene carga +1. Se observa H + .
Dependiendo del isótopo del que se trate, el catión de hidrógeno recibe distintos nombres:
Además, los iones producidos por la reacción de estos cationes con el agua así como sus hidratos se denominan iones de hidrógeno:
Los cationes Zundel y los cationes propios juegan un papel importante en la difusión de protones según el mecanismo de Grotthuss .
En relación con los ácidos, "iones de hidrógeno" normalmente se refiere a hidrones.
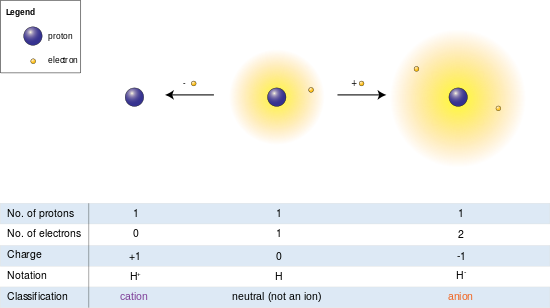
En la imagen de la izquierda, el átomo de hidrógeno (centro) contiene un solo protón y un solo electrón. La eliminación del electrón da un catión (izquierda), mientras que la adición de un electrón da un anión (derecha). El anión de hidrógeno, con su nube de dos electrones suelta, tiene un radio mayor que el átomo neutro, que a su vez es mucho mayor que el protón desnudo del catión. El hidrógeno forma el único catión que no tiene electrones, pero incluso los cationes que (a diferencia del hidrógeno) aún retienen uno o más electrones son aún más pequeños que los átomos o moléculas neutros de los que derivan.
Los aniones de hidrógeno se forman cuando se adquieren electrones adicionales:
Los iones de hidrógeno impulsan la ATP sintasa en la fotosíntesis . Esto sucede cuando los iones de hidrógeno son empujados a través de la membrana creando una alta concentración dentro de la membrana tilacoide y una baja concentración en el citoplasma. Sin embargo, debido a la ósmosis, el H + saldrá de la membrana a través de la ATP sintasa. Usando su energía cinética para escapar, los protones harán girar la ATP sintasa que a su vez creará ATP . Esto también sucede en la respiración celular , aunque la membrana concentrada será la membrana interna de las mitocondrias .
La concentración de iones de hidrógeno, medida como pH, también es responsable de la naturaleza ácida o básica de un compuesto. Las moléculas de agua se dividen para formar aniones H + e hidróxido. Este proceso se conoce como autoionización del agua .
La concentración de iones de hidrógeno y el pH son inversamente proporcionales; en una solución acuosa, una mayor concentración de iones de hidrógeno produce un pH bajo y, posteriormente, un producto ácido. Por definición, un ácido es un ion o molécula que puede donar un protón y, cuando se introduce en una solución, reaccionará con moléculas de agua (H 2 O) para formar un ion hidronio (H 3 O + ), un ácido conjugado del agua. . [4] Para un razonamiento simplista, el ion hidrógeno (H + ) se utiliza a menudo para abreviar el ion hidronio.
La acidificación de los océanos es la consecuencia directa de las elevadas concentraciones de iones de hidrógeno y la saturación de carbonatos debido a la importante absorción de dióxido de carbono (CO 2 ) por los océanos del mundo. [5] El estado preindustrial de la química de carbonatos del océano ha sido notablemente estable, incluido el equilibrio de su pH. [6] Después de la revolución industrial, las emisiones antropogénicas de la quema de combustibles fósiles , la producción de cemento y los cambios en el uso de la tierra han aumentado la absorción de dióxido de carbono de la atmósfera por los océanos en un 30%. [7] En el océano, la capacidad de absorción de este gas de efecto invernadero es 59 veces mayor que en la atmósfera; [8] el océano actúa como el mayor sumidero de carbono del planeta y desempeña un papel importante en la regulación del clima. [9] Además de los flujos de carbono, el proceso natural de secuestro de carbono de la atmósfera a las profundidades del océano se ve facilitado por dos sistemas: la bomba biológica y la bomba de solubilidad. La bomba de solubilidad es un proceso fisicoquímico que transfiere CO 2 en la interfaz aire-mar. [10] Basado en la Ley de Henry, la cantidad de CO 2 disuelto en una solución acuosa es directamente proporcional a la presión parcial de CO 2 en la atmósfera. [11] Para mantener el equilibrio, un estado de alta presión parcial atmosférica de CO 2 conduce a un aumento del intercambio oceánico de este gas por difusión molecular.
En las aguas superficiales, el dióxido de carbono atmosférico disuelto (CO 2 (aq) ) reacciona con las moléculas de agua para formar ácido carbónico (H 2 CO 3 ), un ácido diprótico débil. Los ácidos dipróticos constan de dos átomos de hidrógeno ionizables en cada molécula. [12] En una solución acuosa, la disociación parcial del ácido carbónico libera un protón de hidrógeno (H + ) y un ion bicarbonato (HCO 3 − ), y posteriormente, el ion bicarbonato se disocia en un protón de hidrógeno adicional y un ion carbonato (CO 3 2- ). [13] La disolución y disociación de estas especies de carbono inorgánico generan un aumento en la concentración de iones de hidrógeno e inversamente reduce el pH ambiental de la superficie del océano. El sistema amortiguador de carbonatos gobierna la acidez del agua de mar manteniendo las especies de carbono inorgánico disueltas en equilibrio químico.
La ecuación química consta de reactivos y productos que pueden reaccionar en cualquier dirección. Más reactivos agregados a un sistema producen más producción de producto (la reacción química se desplaza hacia la derecha) y si se agrega más producto, se formarán reactivos adicionales, desplazando la reacción química hacia la izquierda. Por lo tanto, en este modelo, una alta concentración del reactivo inicial, dióxido de carbono, produce una mayor cantidad de producto final (H + y CO 3 2- ), lo que reduce el pH y crea una solución más ácida. El sistema de amortiguación natural del océano resiste el cambio de pH al producir más iones de bicarbonato generados por protones de ácido libre que reaccionan con iones de carbonato para formar un carácter alcalino. [14] Sin embargo, el aumento de las concentraciones de CO 2 atmosférico puede exceder el umbral de capacidad de amortiguación, lo que en consecuencia resulta en tasas más altas de acidificación de los océanos. Los cambios en la química de los carbonatos del océano tienen el potencial de manipular los ciclos biogeoquímicos del océano para muchos elementos y compuestos que causan profundos impactos en los ecosistemas marinos. Además, la solubilidad del CO 2 depende de la temperatura; Las temperaturas elevadas del agua superficial reducen la solubilidad del CO 2 . Un aumento continuo de la presión parcial atmosférica del CO 2 podría potencialmente convertir al océano de actuar como sumidero (el transporte vertical de carbono a las profundidades del océano) a convertirse en una fuente (CO 2 desgasificado del océano), aumentando aún más las temperaturas globales. [15]