
La microscopía de conductancia iónica de barrido ( SICM ) es una técnica de microscopía de sonda de barrido que utiliza un electrodo como punta de la sonda. [1] SICM permite la determinación de la topografía de la superficie de estructuras micrométricas e incluso nanométricas [2] en medios acuosos que conducen electrolitos. Las muestras pueden ser duras o blandas, generalmente no conductoras y la naturaleza no destructiva de la medición permite la observación de tejidos y células vivas, y muestras biológicas en general.
Es capaz de detectar cambios bruscos de perfil en muestras [3] y puede usarse para mapear la rigidez de una célula viva [4] junto con su topografía detallada, o para determinar la movilidad de las células durante sus migraciones. [5]
La microscopía de conductancia iónica de barrido es una técnica que utiliza el aumento de la resistencia de acceso de una micropipeta en un medio acuoso que contiene electrolitos cuando se acerca a una superficie poco conductora. Controla la corriente iónica que entra y sale de la micro/nanopipeta, lo que se ve obstaculizado si la punta está muy cerca de la superficie de la muestra, ya que el espacio a través del cual pueden fluir los iones se reduce de tamaño.
La configuración del SICM es generalmente la siguiente: se aplica un voltaje entre los dos electrodos de Ag/AgCl, uno de los cuales está en la micropipeta de vidrio y el otro en la solución a granel. El voltaje generará una corriente iónica entre los dos electrodos, que entrará y saldrá de la micropipeta. Se mide la conductancia entre los dos electrodos y depende del flujo de iones.
Los movimientos de la pipeta se regulan mediante piezoeléctricos .
La micropipeta se acerca cada vez más a la muestra hasta que el flujo iónico comienza a restringirse. Entonces la conductancia del sistema disminuirá (y la resistencia aumentará). Cuando esta resistencia alcanza un cierto umbral, se detiene la punta y se registra la posición. Luego se mueve la punta (de diferentes maneras según el modo utilizado, ver más abajo) y se realiza otra medición en una ubicación diferente, y así sucesivamente. Al final, comparar las posiciones de todas las mediciones proporciona un perfil de altura detallado de la muestra.
Es importante señalar que la punta se detiene antes de entrar en contacto con la muestra, por lo que no dobla ni daña la superficie observada, lo cual es una de las principales ventajas del SICM.

La resistencia total de la configuración (Rtot) es la suma de las tres resistencias: Rb, Rm y Rt. Rb la resistencia de la solución electrolítica entre la punta de la micropipeta y el electrodo en la mayor parte de la solución. Rm es la resistencia de la solución electrolítica entre el electrodo de la micropipeta y la punta. Rt es la resistencia de la corriente que fluye a través de la punta.
Rb y Rm dependen de la conductividad del electrolito y de la posición y forma de los electrodos de Ag/AgCl. Rt depende del tamaño y la forma de la apertura y de la distancia entre la punta y la muestra.
Todos los parámetros, excepto la distancia entre la punta y la muestra, son constantes dentro de una configuración SICM determinada, por lo que es la variación de Rt con la distancia a la muestra la que se utilizará para determinar la topografía de la muestra.
Las aproximaciones habituales son: 1) se desprecia la caída de voltaje en las superficies de los electrodos de Ag/AgCl, se supone que es insignificante en comparación con la caída de voltaje en la punta, y constante, 2) el hecho de que la resistencia en masa es una La función de d se desprecia ya que depende de la distancia entre la punta y el electrodo en masa.
SICM tiene una resolución peor que AFM o STM , que habitualmente pueden alcanzar resoluciones de aproximadamente 0,1 nm. La resolución de la medición SICM está limitada a 1,5 veces el diámetro de la abertura de la punta [7] en teoría, pero las mediciones tomadas con un diámetro de abertura de 13 nm lograron una resolución de alrededor de 3 a 6 nm. [2]
SICM se puede utilizar para obtener imágenes de superficies deficientes o no conductoras, [6] lo cual es imposible con STM.
En las mediciones SICM, la punta de la micropipeta no toca la superficie de la muestra; que permite la obtención de imágenes de muestras blandas (células, muestras biológicas, vellosidades celulares) [8] [9] [10] sin deformación.
SICM se usa en una solución que contiene electrolitos, por lo que se puede usar en medios fisiológicos y obtener imágenes de células y tejidos vivos, y monitorear procesos biológicos mientras tienen lugar. [10]
En modo de salto es capaz de determinar correctamente perfiles con pendientes pronunciadas y ranuras.
Hay cuatro modos de imagen principales en SICM: modo z constante, modo de corriente continua (distancia constante), modo de corriente alterna y modo de aproximación de salto/retroceso/de pie.
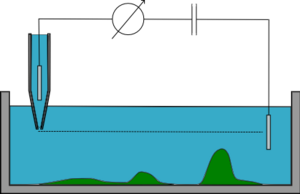
En modo z constante, la micropipeta se mantiene a z (altura) constante mientras se mueve lateralmente y se monitorea la resistencia, cuyas variaciones permiten la reconstitución de la topografía de la muestra. Este modo es rápido pero apenas se utiliza ya que sólo funciona en muestras muy planas. Si la muestra tiene superficies rugosas, la pipeta chocará contra ella o estará demasiado lejos para obtener imágenes de la mayor parte de la muestra.
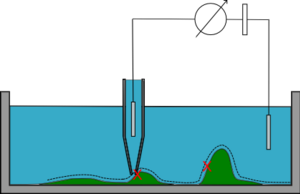
En el modo de corriente continua (CC) (modo de distancia constante), la micropipeta desciende hacia la muestra hasta que se alcanza una resistencia predefinida. Luego, la pipeta se mueve lateralmente y un circuito de retroalimentación mantiene la distancia a la muestra (a través del valor de resistencia). La posición z de la pipeta determina la topografía de la muestra. Este modo no detecta pendientes pronunciadas en la muestra, puede entrar en contacto con la muestra en tales casos y es propenso a la deriva del electrodo.

En modo de corriente alterna (CA), la micropipeta oscila verticalmente además de su movimiento habitual. Mientras la pipeta todavía está lejos de la superficie, la corriente iónica y la resistencia son constantes, por lo que se baja la pipeta. Una vez que la resistencia comienza a oscilar, la amplitud sirve como retroalimentación para modular la posición hasta alcanzar una amplitud predefinida. [8] [9]
La respuesta del componente de CA aumenta mucho más que la de CC y permite la grabación de muestras más complejas.

En el modo de salto (/paso atrás/aproximación de pie), la micropipeta se baja hasta la muestra hasta que se alcanza una resistencia determinada y se registra la altura. Luego se arrastra la pipeta hacia atrás, se mueve lateralmente y se realiza otra medición y se repite el proceso. A continuación se puede reconstituir la topografía de la muestra.
El modo de salto es más lento que los demás, pero puede generar imágenes de topografía compleja e incluso células enteras, sin distorsionar la superficie de la muestra. [11] [12]
Se utilizó SICM para obtener imágenes de una célula neural viva del cerebro de rata, [5] determinar el ciclo de vida de las microvellosidades y [8] observar el movimiento de complejos proteicos en los espermatozoides. [2]
SICM se ha combinado con microscopía de fluorescencia [2] y transferencia de energía por resonancia de Förster. [13]
SICM se ha utilizado en una técnica de "pinza de parche inteligente", sujetando la pipeta por succión a la superficie de una célula y luego monitoreando la actividad de los canales de sodio en la membrana celular. [14]
Una combinación de AFM y SICM logró obtener imágenes de alta resolución de membranas sintéticas en soluciones iónicas. [15]
Con SICM se ha utilizado microscopía óptica de barrido de campo cercano ; la medición SICM permitió colocar la punta de la pipeta muy cerca de la superficie de la muestra. Las partículas fluorescentes, provenientes del interior de la micropipeta, proporcionan una fuente de luz para el SNOM que se renueva continuamente y evitan el fotoblanqueo. [16] [17]
Recientemente se ha desarrollado FSICM [18] (Fast SICM), mejorando notablemente la velocidad del modo de salto.