
La malla quirúrgica es un implante médico hecho de malla tejida holgada , que se utiliza en cirugía como soporte estructural permanente o temporal para órganos y otros tejidos . La malla quirúrgica puede estar hecha de materiales tanto inorgánicos como biológicos y se usa en una variedad de cirugías, aunque la reparación de hernias es la aplicación más común. También se puede utilizar para trabajos reconstructivos , como en el prolapso de órganos pélvicos [1] o para reparar defectos físicos (principalmente de las paredes de las cavidades corporales ) creados por resecciones extensas o pérdida traumática de tejido.
Las mallas permanentes permanecen en el cuerpo, mientras que las temporales se disuelven con el tiempo. En 2012 se demostró que una malla temporal se disolvía completamente después de tres años en un ensayo científico en ovejas. [2] Algunos tipos de malla combinan mallas permanentes y temporales que incluyen tanto vicryl reabsorbible , hecho de ácido poliglicólico , como proleno , un polipropileno no reabsorbible. [3]
Es posible que los datos sobre el comportamiento mecánico y biológico de la malla in vivo no siempre reflejen las condiciones dentro del cuerpo humano debido a las pruebas en organismos no humanos . La mayoría de los informes publicados experimentan con ratones, lo que crea la probabilidad de posibles diferencias cuando se insertan en el cuerpo humano. Además, la mayoría de los informes de investigación publicados hacen referencia a mallas que actualmente no están permitidas en el mercado de dispositivos médicos debido a complicaciones posquirúrgicas. Además, la ausencia de protocolos regulatorios aprobados por la FDA y procedimientos operativos estándar universales conduce a una variedad de métodos de prueba diferentes de un investigador a otro. La experimentación puede encontrar resultados diferentes para algunas mallas. [ cita necesaria ] [ ¿ investigación original? ]
La función principal de la malla quirúrgica es dar soporte a los órganos prolapsados, ya sea de forma temporal o permanente. Se usa más comúnmente en la cirugía de hernia dentro del abdomen, que se requiere cuando un órgano sobresale a través de los músculos abdominales. La malla quirúrgica también se puede utilizar para reconstrucciones de la pared pélvica o vaginal en mujeres y se implementa para servir como guía de crecimiento del tejido dañado. Idealmente, estos implantes deberían ser lo suficientemente fuertes como para resistir cargas mecánicas y acciones de cualquier área del cuerpo de la que formen parte.
La cirugía de hernia es una de las aplicaciones actuales más comunes de las mallas quirúrgicas. Las hernias ocurren cuando órganos o tejido graso sobresalen a través de aberturas o áreas debilitadas de músculos, generalmente en la pared abdominal. Se implanta una malla quirúrgica para fortalecer la reparación del tejido y minimizar la tasa de recurrencia. La cirugía se puede realizar laparoscópica (internamente) o abierta con una variedad de materiales disponibles para prótesis. [4] El polipropileno (PP) es el tipo de malla más utilizado, aunque puede resultar incómodo para el paciente después de la implantación. Otro tipo menos utilizado en la cirugía de hernia es el tereftalato de polietileno (PET), que enfrenta complicaciones porque se degrada fácilmente después de algunos años de implantación, borrando los efectos de la cirugía. También se utiliza politetrafluoretileno ( PTFE ), pero se fabrica en forma de lámina y tiene dificultades para integrarse en el tejido circundante, por lo que pierde estabilidad. [5]
De manera similar a la cirugía de hernia, también se pueden usar mallas sintéticas para el prolapso de órganos en la región pélvica. El prolapso de órganos pélvicos ocurre en el 50% de las mujeres mayores de 50 años con antecedentes de uno o más partos vaginales a lo largo de su vida. [6] La cirugía con malla se puede realizar en diversas áreas de la región pélvica, como cistocele, rectocele y cúpula vaginal o útero. El material más utilizado, al igual que en la cirugía de hernia, es el PP, que se considera que tiene una biocompatibilidad aceptable dentro de la región. Induce una respuesta inflamatoria leve pero tiene tendencia a adherirse a las vísceras. [6]
La pared vaginal tiene tres capas: túnica mucosa, muscular y adventicia. Cuando se produce un prolapso, las fibras lisas de la muscular se ven comprometidas. También se ha observado que el prolapso en las mujeres aumenta la rigidez de la pelvis, especialmente en las mujeres posmenopáusicas. [6] La malla quirúrgica que se utiliza en la reconstrucción pélvica debe contrarrestar esta rigidez, pero si el módulo de elasticidad es demasiado alto, no soportará suficientemente los órganos. Por el contrario, si la malla es demasiado rígida, el tejido se erosionará y las respuestas inflamatorias provocarán complicaciones posquirúrgicas. Después de la implantación, la malla de polipropileno a veces presenta microfisuras, descamación de fibras y fibrosis. [7]
Además, la malla tiene suficiente resistencia para soportar acciones básicas y el comportamiento del tejido en condiciones fisiológicas, particularmente durante la regeneración del tejido a través de la propia malla. [6] El área está sujeta a una variedad de cargas que provienen del contenido abdominal, presión de los músculos abdominales/diafragmáticos y órganos genitales, así como acciones respiratorias. Para una mujer promedio en edad reproductiva, la pelvis debe soportar cargas de 20 N en posición supina, de 25 a 35 N en posición de pie y de 90 a 130 N mientras tose. [6] Cualquier malla que se implante en la zona pélvica debe ser lo suficientemente fuerte para soportar estas cargas.
En 2018, el Reino Unido suspendió temporalmente los implantes de malla vaginal para el tratamiento de la incontinencia urinaria en espera de una mayor investigación sobre los riesgos y las salvaguardias disponibles. [8]
En los Estados Unidos, la FDA reclasificó la malla quirúrgica transvaginal como "clase III" (alto riesgo) en 2016, [9] y, a finales de 2018, exigió solicitudes de aprobación previa a la marca para malla destinada a la reparación transvaginal del prolapso de órganos pélvicos, y se planea realizar más investigaciones en 2019. [10] Luego, el 16 de abril de 2019, la FDA ordenó a todos los fabricantes de mallas quirúrgicas transvaginales que suspendieran inmediatamente su venta y distribución. [9]

La implantación de malla generará naturalmente una respuesta inflamatoria a la malla insertada, pero la biocompatibilidad varía desde la facilidad con la que se integra hasta la gravedad de la reacción al cuerpo extraño. Una respuesta mínima incluye la formación de fibrosis alrededor de la prótesis (muy parecida a la formación de tejido cicatricial); esta respuesta se genera con la mejor forma de biocompatibilidad. Una respuesta física desencadena una reacción inflamatoria aguda, que implica la formación de células gigantes y posteriormente granulomas, lo que significa que el tejido "tolera" bastante bien la malla. Por último, una respuesta química permite una reacción inflamatoria grave durante el intento de integración tejido-malla, incluida la proliferación de células fibroblásticas. [6] En última instancia, el objetivo de la creación de mallas quirúrgicas es formular una que tenga una reacción mínima in vivo para maximizar la comodidad del paciente, evitar infecciones y garantizar una integración limpia en el cuerpo para la reparación de tejidos.
Varios factores influyen en la biocompatibilidad de la malla. La porosidad de la malla es la relación entre el poro y el área total y desempeña un papel en el desarrollo de una infección bacteriana o en la regeneración del tejido liso, según el tamaño de los poros. Los tamaños de poro inferiores a 10 micrómetros son susceptibles a la infección porque las bacterias pueden entrar y proliferar, mientras que los macrófagos y neutrófilos son demasiado grandes para pasar a través de ellos y no pueden ayudar a eliminarlos. Con tamaños de poro superiores a 75 micrómetros, se permite el paso de fibroblastos, vasos sanguíneos y fibras de colágeno como parte de la regeneración del tejido. Aunque no existe un consenso general sobre el mejor tamaño de poro, se puede deducir que los poros más grandes son mejores para el desarrollo del tejido y la integración in vivo . [6]
Sabiendo esto, el problema actual con una variedad de mallas utilizadas en todo tipo de cirugías es que no son suficientemente biocompatibles. El PP demuestra ser una malla eficaz para ajustar los órganos prolapsados, pero puede causar graves molestias al paciente debido a su alto módulo de elasticidad. Esto endurece la prótesis y da como resultado una respuesta inflamatoria más pronunciada, lo que complica la integración en el cuerpo con el crecimiento interno de tejido. Como se mencionó anteriormente, el PET se degrada con demasiada facilidad in vivo y el tejido tiene dificultades para integrarse con el PTFE. Por estas razones, los investigadores están comenzando a buscar diferentes tipos de mallas quirúrgicas que puedan ser adecuadas para el entorno biológico y brindar mayor comodidad al mismo tiempo que sostienen los órganos prolapsados. [5]
Un tipo particular de malla que está en estudio es el fluoruro de polivinilideno (PVDF), o malla nanofibrosa, que se ha descubierto que es más resistente a la hidrólisis y a la desintegración, a diferencia del PET, y no aumenta su rigidez a medida que envejece, a diferencia del PP. Se está probando para cirugía de hernia y de la pared pélvica/vaginal y se produce mediante la colocación de fibras capa por capa, mientras que el PP se construye mediante un proceso similar a un tejido. Esto le da a la malla nanofibrosa una estructura pesada pero de baja porosidad, y también agrega mayor rigidez y umbral de tensión en comparación con el PP. Esto está respaldado por la presencia de HSP70, un indicador del estrés celular y protector de la formación de células contra el daño, lo cual es beneficioso para la prótesis y la formación de tejido, que ha sido monitoreado y observado en mayor presencia en los implantes de PVDF. [11] Las observaciones in vitro de mallas nanofibrosas han arrojado evidencia de migración y proliferación celular en el conjunto [ se necesita aclaración ] de la malla. Se ha observado un crecimiento celular exitoso con formas fusiformes largas y límites claros. [11]
Una ventaja significativa del uso de malla nanofibrosa es que puede transportar muchas más células madre que la malla de PP tradicional, lo que podría mejorar la terapia celular para el prolapso de órganos pélvicos y los métodos de regeneración. Otra ventaja importante del PVDF es la formación de capilares después de 12 semanas, lo cual es fundamental para la cicatrización de heridas . Cuanto más rápida sea la neovascularización, más rápido se podrá reparar y regenerar el tejido, lo que disminuye la probabilidad de exposición o extrusión de la malla. [11]
También se deben realizar algunas mejoras al PVDF antes de que pueda usarse para cirugía humana. Aunque el módulo de elasticidad es mayor que el del PP, el estiramiento resultante bajo tensión idéntica es mucho menor, lo que podría causar complicaciones como degeneración del tejido y pérdida de solidez mecánica. Actualmente, las mallas nanofibrosas también promueven una mayor reacción a cuerpo extraño y respuesta inflamatoria, lo que compromete la biocompatibilidad de la malla. [11] Por estas razones, el PVDF todavía está bajo consideración y experimentación para implantes corporales.
Las respuestas inflamatorias a la inserción de la malla promueven la formación de tejido alrededor de las fibras de la malla y la proliferación de fibroblastos, polimorfonucleocitos y macrófagos, que ayudan en la integración de la malla. Si no se resuelven las respuestas inflamatorias, se pueden producir reacciones de cuerpo extraño y la encapsulación final del implante, lo que niega cualquier propósito funcional que se suponía que debía cumplir el implante. Se sabe que las células madre mesenquimales (MSC) reducen las respuestas inflamatorias que, cuando se combinan con mallas quirúrgicas, podrían evitar que se vuelvan incontrolables y demasiado difíciles de controlar. Las MSC combinadas con mallas quirúrgicas se pueden utilizar como productos “listos para usar” y mejorar la polarización de los macrófagos tanto en entornos in vivo como in vitro. Esto puede fomentar una respuesta antiinflamatoria y regular la reacción inflamatoria asociada con la implantación de la malla. [12]
Además de la erosión de la malla, la migración de la malla y la fístula enterocutenea, las infecciones del sitio quirúrgico (ISQ) relacionadas con la malla siguen siendo un problema sanitario importante. [13] Aproximadamente 60.000 reparaciones de hernias inguinales y ventrales se infectan anualmente, con cifras similares en Europa. [13] El CDC distingue entre SSI superficial; que involucran solo la piel y el tejido subcutáneo, y la ISQ profunda cuando la infección puede asentarse en el implante y, por lo tanto, requiere protocolos de tratamiento más elaborados. [14]
La patogénesis detrás de las contaminaciones relacionadas con las mallas se debe principalmente a la piel o mucosa del paciente durante la incisión primaria y las prácticas clínicas. Se ha descubierto que la inserción de dispositivos médicos aumenta la susceptibilidad a la absorción de bacterias adherentes en un factor de 10.000 a 100.000. [15] En el caso de operaciones de hernia, entre un tercio y dos tercios de la malla implantada quedaría contaminada en el punto de inserción, aunque sólo un pequeño número de ellas provocará una infección. Muchos factores afectan las posibilidades de que se produzca una infección en un material de malla, entre los cuales el tipo de procedimiento quirúrgico y la ubicación son de suma importancia. [16] Por ejemplo, las posibilidades de que se produzca una infección son del 2% al 4% para una reparación inguinal abierta, pero hasta del 10% para la reparación de una hernia incisional. [17] La laparoscopia conlleva la tasa de infección más baja, que generalmente oscila entre menos del 1% y tan solo el 0,1%. [17] Otros factores que afectan las posibilidades de una infección son la curva de aprendizaje del cirujano, ya que un cirujano con menos experiencia puede necesitar más tiempo para realizar la operación y, por lo tanto, aumentar el tiempo que la incisión está expuesta. Además, el tipo de malla, con una amplia variedad de prótesis disponibles en la actualidad, podría distinguirse en función del material y la composición, la arquitectura del filamento, la absorbibilidad y el peso. Los datos demográficos del paciente también influyen en las posibilidades de que se produzca una infección; entre ellos se incluyen el tabaquismo, la diabetes, las personas inmunocomprometidas y la obesidad.
Los factores predictivos de infecciones del sitio quirúrgico de aparición temprana y tardía serán inflamación, fiebre, sensibilidad focal, eritema, hinchazón con secreción de pus, enrojecimiento, calor o dolor. [18] Esto luego se evaluará mediante tomografía computarizada o resonancia magnética, seguida de aspiración de líquido y cultivo. Las especies de estafilococos, y más específicamente S. aureus y S. epidermidis, representan aproximadamente el 90 % de las infecciones que se presentan, con una presencia predominante de Staphylococcus aureus resistente a la meticilina (MRSA). [19] También se encuentran comúnmente especies gramnegativas como Pseudomonas sp., Enterobacteriaceae . También es común encontrar biopelículas de múltiples especies. Si una infección se asienta en una malla, la administración de antibióticos suele ser ineficaz debido a la barrera sanguínea de la malla, y será necesario retirar la malla en más del 40% de las infecciones profundas del sitio quirúrgico. [20]
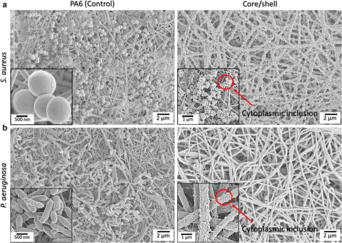
Desde la perspectiva de la ciencia de los materiales, una malla puede desempeñar un papel pasivo hacia la protección antibacteriana a través de su arquitectura, o un papel activo combinando terapias en la composición de la malla. Por ejemplo, se ha descubierto que las mallas de monofilamento tienen el doble de probabilidades de adherirse bacterias que las mallas de multifilamento. [22] Como sistema de administración de medicamentos, se puede utilizar una malla para hernias para administrar antibióticos, [23] antisépticos, [24] antimicrobianos, [21] péptidos antimicrobianos [25] o nanopartículas. [26] Se pueden utilizar diferentes técnicas para implementar la integración de dichas sustancias, incluida la inmersión/remojo, el recubrimiento físico, la funcionalización química de la superficie y el electrohilado.
Mallas antimicrobianas para hernias aprobadas por la FDA
Después de 36 meses, la malla de prueba se reabsorbió por completo.