Las macroglobulinas son proteínas globulares grandes y se encuentran en la sangre y otros fluidos corporales. Varios procesos fisiológicos, incluida la inmunidad , la coagulación y el transporte químico , dependen de estas proteínas. Una macroglobulina es una globulina plasmática de alto peso molecular . [1] Los niveles elevados de macroglobulinas ( macroglobulinemia ) pueden causar manifestaciones de exceso de viscosidad sanguínea (como es el caso de los anticuerpos IgM en la macroglobulinemia de Waldenström ) y/o precipitarse dentro de los vasos sanguíneos cuando baja la temperatura (como en la crioglobulinemia ). Otras macroglobulinas incluyen α 2 -macroglobulina , que está elevada en el síndrome nefrótico , diabetes , quemaduras graves y otras afecciones, mientras que una deficiencia se asocia con la enfermedad pulmonar obstructiva crónica .
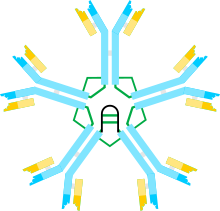
Las macroglobulinas tienen un peso molecular que va desde los 400.000 a los 720.000 daltons. Están formadas por cuatro subunidades distintivas [2] , cada una de las cuales posee múltiples dominios. Los enlaces disulfuro y las interacciones no covalentes permiten que las subunidades permanezcan juntas. Un átomo de zinc también ocupa una posición en cada subunidad, lo que ayuda a mantener la estabilidad de los tetrámeros . Los tetrámeros de macroglobulina pueden disociarse irreversiblemente en dímeros mediante iones metálicos, así como sustancias caotrópicas como la urea y el clorhidrato de guanidina . A pesar de ser similares en estructura a las inmunoglobulinas (Ig), las macroglobulinas tienen una conformación distintiva en forma de Y. Una secuencia de 16 aminoácidos en el extremo C de cada subunidad proporciona un sitio de unión altamente polar e hidrófobo que puede unir cualquier molécula estéricamente accesible.
Hay cuatro tipos principales de macroglobulinas: alfa-2 macroglobulina , beta-2 macroglobulina , proteína plasmática A asociada al embarazo y proteína de unión al componente C4 del complemento . La alfa-2 macroglobulina es la más estudiada. La alfa-2 macroglobulina es un componente plasmático notable con una masa molecular de 820 kDa, aproximadamente 300 mg/100 ml y alrededor del 10 % de carbohidratos en 31 glicanos. La alfa-2 macroglobulina es una proteína tetramérica, lo que significa, en esencia, que está compuesta predominantemente por cuatro subunidades idénticas. Las subunidades idénticas de la alfa-2 macroglobulina contienen 1451 residuos de aminoácidos. [3] Cada subunidad tiene varios dominios, que incluyen una región de cebo que puede interactuar con diferentes receptores de superficie en las células y proteasas, y un dominio de unión al receptor. La alfa-2 macroglobulina es importante para regular la actividad de las proteasas en la sangre. No se conocen estructuras de oligosacáridos completas . La alfa-2 macroglobulina es también la molécula no inmunoglobulina más grande que se encuentra entre las diversas proteínas altamente abundantes en la circulación sanguínea periférica. [4]
Las células endoteliales y los hepatocitos interactúan entre sí para producir alfa-2 macroglobulina, que se encuentra principalmente en el hígado. La alfa-2 macroglobulina puede inhibir una amplia gama de serina, treonina, citocinas proinflamatorias y metaloproteasas. Además, puede activar una serie de genes necesarios para la oncogénesis celular , la aterosclerosis y la proliferación / hipertrofia .
En el plasma y los tejidos de los vertebrados , la alfa 2-macroglobulina y proteínas similares actúan como barreras defensivas humorales contra los patógenos al unirse a péptidos y partículas extraños o del huésped. La alfa 2-macroglobulina humana puede facilitar la captura inversa o irreversible de proteínas con una multitud de actividades biológicas a través de sitios reactivos generados por moléculas activadas, como sitios de reticulación de la transglutaminasa , sitios de tioéster y sitios de zinc de alta afinidad . El hecho de que la alfa 2-macroglobulina interactúe con y engulla casi cualquier proteinasa con la que se tope, ya sea nativa o extraña, sugiere que se le ha asignado un papel especial como "inhibidor de panproteinasa". Luego, se crean sitios de unión de novo mediante la activación de la alfa 2-macroglobulina y se utilizan para facilitar y organizar el establecimiento de complejos con citocinas y otros péptidos. La interrelación física directa de las citocinas con la alfa 2-macroglobulina activada en cultivos celulares sugirió que tiene una función como modulador de la respuesta biológica.
Los primeros miembros conocidos de la familia de proteínas de las macroglobulinas surgieron inicialmente hace aproximadamente 500–700 millones de años. En la actualidad, se han identificado miembros de la familia de las macroglobulinas en crustáceos , moluscos , peces , anfibios , reptiles , garrapatas , insectos , aves y mamíferos . La sangre de algunas especies muestra que varios miembros de la familia de las macroglobulinas tienen diferentes pesos moleculares y funciones parcialmente redundantes. Hoy en día, la macroglobulina se puede encontrar como monómeros , dímeros o tetrámeros en una gran variedad de especies diferentes. Todos y cada uno de los componentes proteicos se pueden caracterizar por tener una "trampa" que se compone de un tioéter cíclico en la parte inferior y una región hidrófoba considerable . Cada representación puede administrar una variedad de tareas reguladoras ya que se pueden construir complejos con varios químicos reguladores a través de interacciones covalentes o hidrófobas. La familia de proteínas de las macroglobulinas puede considerarse como las macromoléculas reguladoras primarias de los medios fluidos de los organismos debido a su larga historia evolutiva, amplia distribución, conservación inherente y variedad de funciones reguladoras. Los mamíferos son los que presentan el mayor crecimiento de la familia de las alfa-2 macroglobulinas. Existe un estudio en ratas que resulta particularmente interesante porque la alfa-2 macroglobulina que predomina en ellas se diferencia de la alfa-2 macroglobulina humana por tener un enlace sulfuro adicional dentro de la subunidad; como resultado, en realidad está formada por ocho subunidades. Dos macroglobulinas con cualidades idénticas aparecen por primera vez en peces cuyas alfa-2 macroglobulinas están representadas por formas tetrámeras, una de las cuales se encuentra exclusivamente en la sangre y la otra sólo en los huevos. Esto se puede explicar por la divergencia del ancestro del gen y la vinculación directa del gen de la alfa-2 macroglobulina del huevo con el proceso reproductivo, que necesita la movilización de componentes proliferativos. Cabe destacar que las proteínas del sistema del complemento aparecieron por primera vez en peces y son estructural y funcionalmente idénticas a las proteínas humanas relacionadas. [5]
La macroglobulinemia de Waldenström es una enfermedad lenta y silenciosa que generalmente se desarrolla cuando una persona tiene alrededor de 65 años o más, es hombre, tiene antecedentes familiares de linfoma y es caucásica. [6] La afección se llama macroglobulinemia de Waldenström porque las células anormales generan niveles excesivos de IgM , que es la proteína inmunoglobulina más grande y también es una de las causas de la afección. Curiosamente, algunas personas afectadas exhibirán estos niveles elevados de IgM y células linfoplasmocíticas , pero no mostrarán síntomas de la enfermedad; en estas personas, la enfermedad generalmente se descubre por casualidad después de un análisis de sangre que se realizó por una razón médica completamente diferente. La macroglobulinemia de Waldenström latente es el diagnóstico para estas personas que se presentan asintomáticas . Antes de que una persona con la enfermedad muestre signos y síntomas observables, pueden pasar muchos años. La macroglobulinemia de Waldenström es un cáncer poco común de las células sanguíneas que se distingue por la proliferación de glóbulos blancos anormales dentro de la médula ósea . Estas células aberrantes se parecen tanto a las células B, que son glóbulos blancos, también conocidos como linfocitos , como a las células plasmáticas , que son células B que pasaron por un tipo secundario de desarrollo. El término "células linfoplasmocíticas" se refiere a estas células irregulares que muestran características tanto linfocíticas como plasmáticas. La macroglobulinemia de Waldenström se clasifica como un linfoma linfoplasmocítico como resultado de estas células. [7]
{{cite journal}}: Requiere citar revista |journal=( ayuda )