
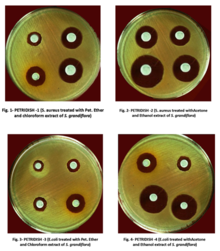
La prueba de difusión en disco (también conocida como prueba de difusión en agar , prueba de Kirby-Bauer , prueba de susceptibilidad a antibióticos por difusión en disco , prueba de sensibilidad a antibióticos por difusión en disco y prueba KB ) es un ensayo de microbiología basado en cultivos que se utiliza en laboratorios de diagnóstico y descubrimiento de fármacos . En los laboratorios de diagnóstico, el ensayo se utiliza para determinar la susceptibilidad de las bacterias aisladas de la infección de un paciente a los antibióticos aprobados clínicamente. Esto permite a los médicos prescribir el tratamiento antibiótico más adecuado. [1] [2] [4] [5] En los laboratorios de descubrimiento de fármacos, especialmente los laboratorios de bioprospección , el ensayo se utiliza para examinar el material biológico (por ejemplo, extractos de plantas, caldos de fermentación bacteriana) y los candidatos a fármacos para la actividad antibacteriana. Cuando se realiza la bioprospección, el ensayo se puede realizar con cepas de bacterias emparejadas para lograr la desreplicación e identificar provisionalmente el mecanismo de acción antibacteriano . [6] [7]
En los laboratorios de diagnóstico, la prueba se realiza inoculando la superficie de una placa de agar con bacterias aisladas de la infección de un paciente. Luego se aplican discos de papel que contienen antibióticos al agar y se incuba la placa. Si un antibiótico detiene el crecimiento de las bacterias o las mata , habrá un área alrededor del disco donde las bacterias no han crecido lo suficiente como para ser visibles. Esto se llama zona de inhibición. La susceptibilidad del aislado bacteriano a cada antibiótico se puede semicuantificar comparando el tamaño de estas zonas de inhibición con bases de datos de información sobre bacterias conocidas como susceptibles a los antibióticos, moderadamente susceptibles y resistentes. De esta manera, es posible identificar el antibiótico más apropiado para tratar la infección de un paciente. [1] [2] Aunque la prueba de difusión en disco no se puede utilizar para diferenciar la actividad bacteriostática y bactericida, es menos engorrosa que otros métodos de prueba de susceptibilidad, como la dilución en caldo . [4]
En los laboratorios de descubrimiento de fármacos, la prueba de difusión en disco se realiza de forma ligeramente diferente a la de los laboratorios de diagnóstico. En este contexto, no es la cepa bacteriana la que debe caracterizarse, sino un extracto de prueba (por ejemplo, un extracto vegetal o microbiano). Por lo tanto, la placa de agar se inocula con una cepa bacteriana de fenotipo conocido (a menudo una cepa ATCC o NCTC ) y se aplican discos que contienen el extracto de prueba a la superficie. [6] Los tamaños de zona de inhibición no se pueden utilizar como una medida semicuantitativa de la potencia antibacteriana porque los diferentes extractos contienen moléculas con diferentes características de difusión (diferentes tamaños moleculares , hidrofilicidades , etc.). Sin embargo, los tamaños de zona de inhibición se pueden utilizar con el propósito de desreplicación. Esto se logra probando cada extracto contra cepas pareadas de bacterias (por ejemplo, cepas sensibles y resistentes a la estreptomicina para identificar extractos que contienen estreptomicina). Las cepas pareadas (por ejemplo, cepas de tipo salvaje y cepas que sobreexpresan el objetivo ) también se pueden utilizar para identificar el mecanismo de acción antibacteriano. [6] [7]
La difusión en agar fue utilizada por primera vez por Martinus Beijerinck en 1889 para estudiar el efecto de las auxinas en el crecimiento bacteriano. Sin embargo, el método ha sido desarrollado, refinado y estandarizado por muchos científicos y organizaciones científicas a lo largo de los años, incluidos George F. Reddish, Norman Heatley , James G. Vincent, [8] Alfred W. Bauer, William MM Kirby, John C. Sherris , [4] [5] Hans Martin Ericsson, la Organización Mundial de la Salud , el Clinical and Laboratory Standards Institute , el Swedish Reference Group for Antibiotics, el Deutsches Institut für Normung , la British Society for Antimicrobial Chemotherapy y otros. [8]
Se suspende un cultivo bacteriano puro en solución salina, se estandariza su turbidez y se frota uniformemente sobre una placa de agar. Luego se coloca un disco de papel de filtro impregnado con antibiótico o extracto sobre la superficie del agar. Los componentes del disco se difunden desde el papel de filtro hacia el agar. La concentración de estos componentes será más alta junto al disco y disminuirá a medida que aumenta la distancia desde el disco. Si el antibiótico o extracto es eficaz contra las bacterias a una determinada concentración, no crecerán colonias donde la concentración en el agar sea mayor o igual a la concentración efectiva. Esta es la zona de inhibición. En general, las zonas de inhibición más grandes se correlacionan con concentraciones inhibitorias mínimas (CIM) más bajas de antibiótico o extracto para esa cepa bacteriana. [1] Una excepción a esto es cuando las moléculas del antibiótico o extracto son grandes o hidrófobas porque se difunden a través del agar lentamente. [6]

Todos los aspectos del procedimiento Kirby-Bauer están estandarizados para garantizar resultados consistentes y precisos. Por este motivo, un laboratorio debe cumplir con estos estándares. El medio utilizado en las pruebas Kirby-Bauer debe ser agar Mueller-Hinton a solo 4 mm de profundidad, vertido en placas de Petri de 100 mm o 150 mm. El nivel de pH del agar debe estar entre 7,2 y 7,4. El inóculo bacteriano se prepara diluyendo un caldo de cultivo para que coincida con un estándar de turbidez de 0,5 McFarland , que equivale aproximadamente a 150 millones de células por ml. [1]
Utilizando una técnica aséptica , se recoge el caldo de cultivo de un organismo específico con un hisopo estéril . En el caso de las bacterias Gram negativas , se elimina el exceso de líquido del hisopo presionándolo suavemente o girándolo contra el interior del tubo. Luego, el hisopo se extiende sobre una placa de agar Mueller-Hinton para formar un césped bacteriano. Para obtener un crecimiento uniforme, la placa de agar se extiende con el hisopo en una dirección, se gira 120° y se extiende nuevamente, se gira otros 120° y se extiende nuevamente. Luego, utilizando un dispensador de discos de antibióticos, se aplican a la placa discos que contienen antibióticos específicos. Esto debe hacerse dentro de los 15 minutos posteriores a la inoculación. Se utilizan pinzas esterilizadas a la llama para presionar suavemente cada disco sobre el agar y asegurarse de que esté adherido. Luego, las placas se incuban durante la noche, generalmente a una temperatura de 35 °C. Las placas deben incubarse dentro de los 15 minutos posteriores a la aplicación de los discos de antibióticos. [1]
Se han desarrollado varias variaciones del método de difusión en disco, incluidos los métodos de copa de penicilina Oxford y Etest utilizados en laboratorios de diagnóstico de hospitales, [9] [10] y los métodos de difusión en pozo, difusión en cilindro y bioautografía utilizados en laboratorios de descubrimiento y desarrollo de fármacos. [6] [11]
Los discos que contienen concentraciones crecientes de antibióticos se colocan sobre un césped bacteriano sembrado en la superficie del agar y las placas se incuban. Los tamaños de las zonas se miden desde el borde del disco hasta el final de la zona transparente. La interpretación es más complicada en poblaciones de susceptibilidad mixta. Estos se representan como dimensiones lineales o cuadrados de distancias en función del logaritmo natural de la concentración de antibióticos en los discos. La CMI se determina a partir de la intersección en cero de un ajuste de regresión lineal a través de los datos. [12] La intersección en sí es el logaritmo de la CMI. La pendiente de la línea de regresión está relacionada con el coeficiente de difusión de ese antibiótico en particular en el agar. [9]