Los electrones del núcleo son los electrones de un átomo que no son electrones de valencia y no participan en la formación de enlaces químicos . [1] El núcleo y los electrones del núcleo de un átomo forman el núcleo atómico. Los electrones del núcleo están fuertemente unidos al núcleo. Por lo tanto, a diferencia de los electrones de valencia, los electrones del núcleo desempeñan un papel secundario en la formación de enlaces y reacciones químicas al proteger la carga positiva del núcleo atómico de los electrones de valencia. [2]
El número de electrones de valencia de un elemento se puede determinar mediante el grupo de la tabla periódica del elemento (ver electrón de valencia ):
Todos los demás electrones que no son de valencia de un átomo de ese elemento se consideran electrones centrales.
Una explicación más compleja de la diferencia entre los electrones del núcleo y de valencia se puede describir mediante la teoría de orbitales atómicos.
En los átomos con un solo electrón, la energía de un orbital está determinada exclusivamente por el número cuántico principal n . El orbital n = 1 tiene la energía más baja posible en el átomo. Para valores grandes de n , la energía aumenta tanto que el electrón puede escapar fácilmente del átomo. En los átomos con un solo electrón, todos los niveles de energía con el mismo número cuántico principal están degenerados y tienen la misma energía.
En los átomos con más de un electrón, la energía de un electrón depende no sólo de las propiedades del orbital en el que reside, sino también de sus interacciones con los demás electrones en otros orbitales. Esto requiere la consideración del número cuántico ℓ . Los valores más altos de ℓ se asocian con valores más altos de energía; por ejemplo, el estado 2p es más alto que el estado 2s. Cuando ℓ = 2, el aumento de energía del orbital se vuelve lo suficientemente grande como para empujar la energía del orbital por encima de la energía del orbital s en la siguiente capa superior; cuando ℓ = 3, la energía es empujada hacia la capa dos pasos más arriba. El llenado de los orbitales 3d no ocurre hasta que se hayan llenado los orbitales 4s.
El aumento de energía para subcapas de momento angular creciente en átomos más grandes se debe a efectos de interacción electrón-electrón, y está específicamente relacionado con la capacidad de los electrones de bajo momento angular para penetrar más efectivamente hacia el núcleo, donde están sujetos a menos protección por parte de la carga de los electrones intermedios. Por lo tanto, en átomos de mayor número atómico , el ℓ de los electrones se vuelve cada vez más un factor determinante en su energía, y los números cuánticos principales n de los electrones se vuelven cada vez menos importantes en su ubicación energética. La secuencia de energía de las primeras 35 subcapas (por ejemplo, 1s, 2s, 2p, 3s, etc.) se da en la siguiente tabla [¿no se muestra?]. Cada celda representa una subcapa con n y ℓ dados por sus índices de fila y columna, respectivamente. El número en la celda es la posición de la subcapa en la secuencia. Vea la tabla periódica a continuación, organizada por subcapas.

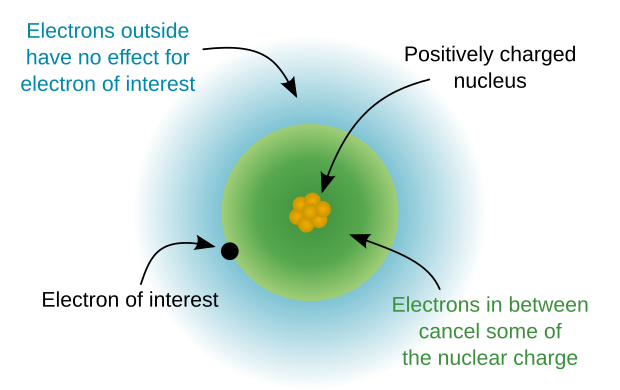
El núcleo atómico se refiere a la parte central del átomo excluyendo los electrones de valencia . [3] El núcleo atómico tiene una carga eléctrica positiva llamada carga del núcleo y es la carga nuclear efectiva experimentada por un electrón de la capa externa . En otras palabras, la carga del núcleo es una expresión de la fuerza de atracción experimentada por los electrones de valencia hacia el núcleo de un átomo que tiene en cuenta el efecto de protección de los electrones del núcleo. La carga del núcleo se puede calcular tomando el número de protones en el núcleo menos el número de electrones del núcleo, también llamados electrones de la capa interna, y siempre es un valor positivo en átomos neutros.
La masa del núcleo es casi igual a la masa del átomo. El núcleo atómico puede considerarse esféricamente simétrico con bastante precisión. El radio del núcleo es al menos tres veces menor que el radio del átomo correspondiente (si calculamos los radios con los mismos métodos). En el caso de los átomos pesados, el radio del núcleo aumenta ligeramente con el aumento del número de electrones. El radio del núcleo del elemento más pesado que existe en la naturaleza, el uranio , es comparable al radio de un átomo de litio, aunque este último tiene solo tres electrones.
Los métodos químicos no permiten separar los electrones del núcleo del átomo. Cuando se ionizan con llama o con radiación ultravioleta , los núcleos atómicos, por regla general, también permanecen intactos.
La carga del núcleo es una forma conveniente de explicar las tendencias en la tabla periódica. [4] Dado que la carga del núcleo aumenta a medida que se avanza por una fila de la tabla periódica , los electrones de la capa externa son atraídos cada vez con más fuerza hacia el núcleo y el radio atómico disminuye. Esto se puede utilizar para explicar una serie de tendencias periódicas , como el radio atómico, la primera energía de ionización (IE), la electronegatividad y la oxidación .
La carga del núcleo también se puede calcular como el "número atómico" menos "todos los electrones excepto los de la capa exterior". Por ejemplo, el cloro (elemento 17), con configuración electrónica 1s 2 2s 2 2p 6 3s 2 3p 5 , tiene 17 protones y 10 electrones de la capa interior (2 en la primera capa y 8 en la segunda), por lo que:
La carga del núcleo es la carga neta de un núcleo, considerando que las capas completas de electrones actúan como un "escudo". A medida que aumenta la carga del núcleo, los electrones de valencia se sienten más fuertemente atraídos hacia el núcleo y el radio atómico disminuye a lo largo del período.
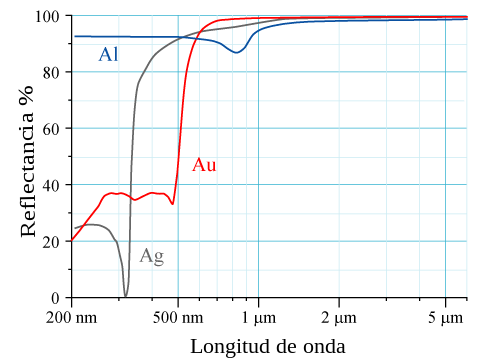
En el caso de los elementos con un número atómico Z elevado , se pueden observar efectos relativistas en los electrones del núcleo. Las velocidades de los electrones del núcleo s alcanzan un momento relativista que conduce a la contracción de los orbitales 6s en relación con los orbitales 5d. Las propiedades físicas afectadas por estos efectos relativistas incluyen la reducción de la temperatura de fusión del mercurio y el color dorado observado en el oro y el cesio debido al estrechamiento de la brecha energética. [5] El oro parece amarillo porque absorbe más luz azul que otras longitudes de onda de luz visibles y, por lo tanto, refleja la luz de tono amarillo.
Un electrón central puede ser removido de su nivel central al absorber radiación electromagnética. Esto excitará al electrón a una capa de valencia vacía o hará que se emita como un fotoelectrón debido al efecto fotoeléctrico . El átomo resultante tendrá un espacio vacío en la capa de electrones central, a menudo denominado agujero central . Está en un estado metaestable y se desintegrará en 10 −15 s, liberando el exceso de energía a través de fluorescencia de rayos X (como un rayo X característico ) o por el efecto Auger . [6] La detección de la energía emitida por un electrón de valencia que cae en un orbital de menor energía proporciona información útil sobre las estructuras reticulares electrónicas y locales de un material. Aunque la mayoría de las veces esta energía se libera en forma de fotón , la energía también puede transferirse a otro electrón, que es expulsado del átomo. Este segundo electrón expulsado se llama electrón Auger y este proceso de transición electrónica con emisión de radiación indirecta se conoce como efecto Auger . [7]
Todos los átomos, excepto el hidrógeno, tienen electrones a nivel del núcleo con energías de enlace bien definidas. Por lo tanto, es posible seleccionar un elemento para investigar ajustando la energía de rayos X al borde de absorción apropiado. Los espectros de la radiación emitida se pueden utilizar para determinar la composición elemental de un material.