
Los lípidos son un amplio grupo de compuestos orgánicos que incluyen grasas , ceras , esteroles , vitaminas liposolubles (como las vitaminas A , D , E y K ), monoglicéridos , diglicéridos , fosfolípidos y otros. Las funciones de los lípidos incluyen almacenar energía, realizar señales y actuar como componentes estructurales de las membranas celulares . [3] [4] Los lípidos tienen aplicaciones en las industrias cosmética y alimentaria , y en la nanotecnología . [5]
Los lípidos pueden definirse ampliamente como moléculas pequeñas hidrofóbicas o anfifílicas ; la naturaleza anfifílica de algunos lípidos les permite formar estructuras como vesículas , liposomas multilamelares/unilamelares o membranas en un entorno acuoso. Los lípidos biológicos se originan total o parcialmente a partir de dos tipos distintos de subunidades bioquímicas o "bloques constructores": grupos cetoacilo e isopreno . [3] Usando este enfoque, los lípidos pueden dividirse en ocho categorías: acilos grasos , glicerolípidos , glicerofosfolípidos , esfingolípidos , sacarolípidos y policétidos (derivados de la condensación de subunidades cetoacilo); y lípidos de esterol y lípidos de prenol (derivados de la condensación de subunidades de isopreno). [3]
Aunque el término "lípido" se utiliza a veces como sinónimo de grasas, las grasas son un subgrupo de lípidos llamados triglicéridos . Los lípidos también abarcan moléculas como los ácidos grasos y sus derivados (incluidos los tri-, di-, monoglicéridos y fosfolípidos), así como otros metabolitos que contienen esteroles como el colesterol . [6] Aunque los humanos y otros mamíferos utilizan varias vías biosintéticas tanto para descomponer como para sintetizar lípidos, algunos lípidos esenciales no se pueden producir de esta manera y deben obtenerse de la dieta.
En 1815, Henri Braconnot clasificó los lípidos ( graisses ) en dos categorías, suifs (grasas sólidas o sebo) y huiles (aceites fluidos). [7] En 1823, Michel Eugène Chevreul desarrolló una clasificación más detallada, que incluía aceites, grasas, sebo, ceras, resinas, bálsamos y aceites volátiles (o aceites esenciales). [8] [9] [10]
El primer triglicérido sintético fue reportado por Théophile-Jules Pelouze en 1844, cuando produjo tributirina tratando ácido butírico con glicerina en presencia de ácido sulfúrico concentrado . [11] Varios años después, Marcellin Berthelot , uno de los estudiantes de Pelouze, sintetizó triestearina y tripalmitina por reacción de los ácidos grasos análogos con glicerina en presencia de cloruro de hidrógeno gaseoso a alta temperatura. [12]
En 1827, William Prout reconoció la grasa (materia alimenticia "oleosa"), junto con la proteína ("albúmina") y los carbohidratos ("sacarina"), como un nutriente importante para los humanos y los animales. [13] [14]
Durante un siglo, los químicos consideraron que las "grasas" eran simplemente lípidos compuestos de ácidos grasos y glicerol (glicéridos), pero más tarde se describieron nuevas formas. Theodore Gobley (1847) descubrió fosfolípidos en el cerebro de los mamíferos y en el huevo de gallina, a los que llamó " lecitinas ". Thudichum descubrió en el cerebro humano algunos fosfolípidos ( cefalina ), glicolípidos ( cerebrósido ) y esfingolípidos ( esfingomielina ). [9]
Los términos lipoide, lipina, lípido y lípido se han utilizado con significados variados de autor a autor. [15] En 1912, Rosenbloom y Gies propusieron la sustitución de "lipoide" por "lipina". [16] En 1920, Bloor introdujo una nueva clasificación para los "lipoides": lipoides simples (grasas y ceras), lipoides compuestos (fosfolipoides y glicolipoides) y los lipoides derivados (ácidos grasos, alcoholes , esteroles). [17] [18]
La palabra lípido , que proviene etimológicamente del griego λίπος, lipos 'grasa', fue introducida en 1923 por el farmacólogo francés Gabriel Bertrand . [19] Bertrand incluyó en el concepto no solo las grasas tradicionales (glicéridos), sino también los "lipoides", con una constitución compleja. [9] La palabra lípido fue aprobada por unanimidad por la comisión internacional de la Société de Chimie Biologique durante la sesión plenaria del 3 de julio de 1923. La palabra lípido fue posteriormente anglicanizada como lípido debido a su pronunciación ('lɪpɪd). En francés, el sufijo -ide , del griego antiguo -ίδης (que significa 'hijo de' o 'descendiente de'), siempre se pronuncia (ɪd).
En 1947, TP Hilditch definió los "lípidos simples" como grasas y ceras (ceras verdaderas, esteroles, alcoholes). [20] [ página necesaria ]
El consorcio Lipid MAPS ha clasificado los lípidos en ocho categorías [3] de la siguiente manera:


Los acilos grasos, un término genérico para describir los ácidos grasos, sus conjugados y derivados, son un grupo diverso de moléculas sintetizadas por elongación de la cadena de un cebador de acetil-CoA con grupos malonil-CoA o metilmalonil-CoA en un proceso llamado síntesis de ácidos grasos . [21] [22] Están hechos de una cadena de hidrocarburo que termina con un grupo de ácido carboxílico ; esta disposición confiere a la molécula un extremo polar , hidrófilo , y un extremo no polar, hidrófobo que es insoluble en agua. La estructura de los ácidos grasos es una de las categorías más fundamentales de los lípidos biológicos y se utiliza comúnmente como un bloque de construcción de lípidos estructuralmente más complejos. La cadena de carbono, típicamente de entre cuatro y 24 carbonos de longitud, [23] puede estar saturada o insaturada , y puede estar unida a grupos funcionales que contienen oxígeno , halógenos , nitrógeno y azufre . Si un ácido graso contiene un doble enlace, existe la posibilidad de un isomería geométrica cis o trans , que afecta significativamente la configuración de la molécula . Los enlaces dobles cis hacen que la cadena de ácidos grasos se doble, un efecto que se agrava con más enlaces dobles en la cadena. Tres enlaces dobles en el ácido linolénico de 18 carbonos , las cadenas de acilo graso más abundantes en las membranas tilacoides de las plantas , hacen que estas membranas sean muy fluidas a pesar de las bajas temperaturas ambientales, [24] y también hacen que el ácido linolénico dé picos agudos dominantes en los espectros de RMN de 13-C de alta resolución de los cloroplastos. Esto a su vez juega un papel importante en la estructura y función de las membranas celulares. [25] : 193–5 La mayoría de los ácidos grasos naturales son de configuración cis , aunque la forma trans existe en algunas grasas y aceites naturales y parcialmente hidrogenados. [26]
Los ejemplos de ácidos grasos biológicamente importantes incluyen los eicosanoides , derivados principalmente del ácido araquidónico y el ácido eicosapentaenoico , que incluyen prostaglandinas , leucotrienos y tromboxanos . El ácido docosahexaenoico también es importante en los sistemas biológicos, particularmente con respecto a la vista. [27] [28] Otras clases importantes de lípidos en la categoría de ácidos grasos son los ésteres grasos y las amidas grasas. Los ésteres grasos incluyen intermediarios bioquímicos importantes como ésteres de cera , derivados de coenzima A de tioéster de ácido graso , derivados de ACP de tioéster de ácido graso y carnitinas de ácido graso. Las amidas grasas incluyen N-aciletanolaminas , como el neurotransmisor cannabinoide anandamida . [29]
Los glicerolípidos están compuestos de gliceroles mono-, di- y tri-sustituidos , [30] siendo los más conocidos los triésteres de ácidos grasos del glicerol, llamados triglicéridos . La palabra "triacilglicerol" a veces se usa como sinónimo de "triglicérido". En estos compuestos, los tres grupos hidroxilo del glicerol están esterificados, típicamente por diferentes ácidos grasos. Debido a que funcionan como un depósito de energía, estos lípidos comprenden la mayor parte de la grasa almacenada en los tejidos animales. La hidrólisis de los enlaces éster de los triglicéridos y la liberación de glicerol y ácidos grasos del tejido adiposo son los pasos iniciales en la metabolización de la grasa. [31] : 630–1
Otras subclases de glicerolípidos son los glicosilgliceroles, que se caracterizan por la presencia de uno o más residuos de azúcar unidos al glicerol a través de un enlace glucosídico . Ejemplos de estructuras de esta categoría son los digalactosildiacilgliceroles que se encuentran en las membranas de las plantas [32] y los seminolípidos de los espermatozoides de los mamíferos [33] .
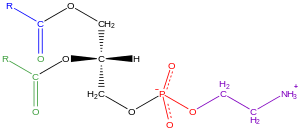
Los glicerofosfolípidos, generalmente denominados fosfolípidos (aunque las esfingomielinas también se clasifican como fosfolípidos), son ubicuos en la naturaleza y son componentes clave de la bicapa lipídica de las células, [34] además de estar involucrados en el metabolismo y la señalización celular . [35] El tejido neural (incluido el cerebro) contiene cantidades relativamente altas de glicerofosfolípidos, y las alteraciones en su composición se han implicado en varios trastornos neurológicos. [36] Los glicerofosfolípidos se pueden subdividir en clases distintas, según la naturaleza del grupo de cabeza polar en la posición sn -3 de la cadena principal de glicerol en eucariotas y eubacterias, o la posición sn -1 en el caso de las arqueobacterias . [37]
Ejemplos de glicerofosfolípidos encontrados en membranas biológicas son la fosfatidilcolina (también conocida como PC, GPCho o lecitina ), la fosfatidiletanolamina (PE o GPEtn) y la fosfatidilserina (PS o GPSer). Además de servir como un componente primario de las membranas celulares y sitios de unión para proteínas intra e intercelulares, algunos glicerofosfolípidos en células eucariotas, como los fosfatidilinositoles y los ácidos fosfatídicos son precursores o, en sí mismos, segundos mensajeros derivados de la membrana . [31] : 844 Por lo general, uno o ambos de estos grupos hidroxilo están acilados con ácidos grasos de cadena larga, pero también hay glicerofosfolípidos unidos a alquilo y unidos a 1Z-alquenilo ( plasmalógeno ), así como variantes de dialquiléter en arqueobacterias. [38]
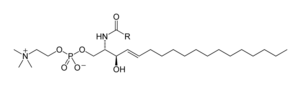
Los esfingolípidos son una familia compleja de compuestos [39] que comparten una característica estructural común, una estructura básica esfingoide que se sintetiza de novo a partir del aminoácido serina y un acil-CoA graso de cadena larga, y luego se convierte en ceramidas , fosfoesfingolípidos, glicoesfingolípidos y otros compuestos. La principal base esfingoide de los mamíferos se conoce comúnmente como esfingosina . Las ceramidas (bases N-acilo-esfingoideas) son una subclase importante de derivados de bases esfingoides con un ácido graso unido a amida . Los ácidos grasos son típicamente saturados o monoinsaturados con longitudes de cadena de 16 a 26 átomos de carbono. [25] : 421–2
Los principales fosfoesfingolípidos de los mamíferos son las esfingomielinas (fosfocolinas de ceramida), [40] mientras que los insectos contienen principalmente fosfoetanolaminas de ceramida [41] y los hongos tienen fosfoinositoles de fitoceramida y grupos de cabeza que contienen manosa . [42] Los glicoesfingolípidos son una familia diversa de moléculas compuestas de uno o más residuos de azúcar unidos a través de un enlace glucosídico a la base esfingoide. Ejemplos de estos son los glicoesfingolípidos simples y complejos como los cerebrósidos y los gangliósidos .

Los esteroles, como el colesterol y sus derivados, son un componente importante de los lípidos de membrana, [43] junto con los glicerofosfolípidos y las esfingomielinas. Otros ejemplos de esteroles son los ácidos biliares y sus conjugados, [44] que en los mamíferos son derivados oxidados del colesterol y se sintetizan en el hígado. Los equivalentes vegetales son los fitoesteroles , como el β-sitosterol , el estigmasterol y el brasicasterol ; este último compuesto también se utiliza como biomarcador del crecimiento de las algas . [45] El esterol predominante en las membranas celulares de los hongos es el ergosterol . [46]
Los esteroles son esteroides en los que uno de los átomos de hidrógeno está sustituido por un grupo hidroxilo , en la posición 3 de la cadena carbonada. Tienen en común con los esteroides la misma estructura central de cuatro anillos fusionados. Los esteroides tienen diferentes funciones biológicas como hormonas y moléculas de señalización . Los esteroides de dieciocho carbonos (C18) incluyen la familia de los estrógenos, mientras que los esteroides C19 comprenden los andrógenos, como la testosterona y la androsterona . La subclase C21 incluye los progestágenos , así como los glucocorticoides y mineralocorticoides . [2] : 749 Los secosteroides , que comprenden varias formas de vitamina D , se caracterizan por la escisión del anillo B de la estructura central. [47]

Los lípidos prenol se sintetizan a partir de los precursores de cinco unidades de carbono, el difosfato de isopentenilo y el difosfato de dimetilalilo , que se producen principalmente a través de la vía del ácido mevalónico (MVA). [48] Los isoprenoides simples (alcoholes lineales, difosfatos, etc.) se forman por la adición sucesiva de unidades C5 y se clasifican según el número de estas unidades de terpeno . Las estructuras que contienen más de 40 carbonos se conocen como politerpenos. Los carotenoides son isoprenoides simples importantes que funcionan como antioxidantes y como precursores de la vitamina A. [49] Otra clase biológicamente importante de moléculas está ejemplificada por las quinonas e hidroquinonas , que contienen una cola isoprenoide unida a un núcleo quinonoide de origen no isoprenoide. [50] La vitamina E y la vitamina K , así como las ubiquinonas , son ejemplos de esta clase. Los procariotas sintetizan poliprenoles (llamados bactoprenoles ) en los que la unidad isoprenoide terminal unida al oxígeno permanece insaturada, mientras que en los poliprenoles animales ( dolicoles ) el isoprenoide terminal se reduce. [51]

Los sacarolípidos describen compuestos en los que los ácidos grasos están unidos a una cadena principal de azúcar, formando estructuras que son compatibles con las bicapas de membrana. En los sacarolípidos, un monosacárido sustituye a la cadena principal de glicerol presente en los glicerolípidos y glicerofosfolípidos. Los sacarolípidos más conocidos son los precursores de glucosamina acilada del componente Lípido A de los lipopolisacáridos en bacterias Gram-negativas . Las moléculas típicas de lípido A son disacáridos de glucosamina, que se derivatizan con hasta siete cadenas de acilo graso. El lipopolisacárido mínimo requerido para el crecimiento en E. coli es Kdo 2 -Lípido A, un disacárido hexaacilado de glucosamina que está glicosilado con dos residuos de ácido 3-desoxi-D-mano-octulosónico (Kdo). [52]
Los policétidos se sintetizan por polimerización de subunidades de acetilo y propionilo por enzimas clásicas, así como por enzimas iterativas y multimodulares que comparten características mecanísticas con las sintasas de ácidos grasos . Comprenden muchos metabolitos secundarios y productos naturales de fuentes animales, vegetales, bacterianas, fúngicas y marinas, y tienen una gran diversidad estructural. [53] [54] Muchos policétidos son moléculas cíclicas cuyas cadenas principales a menudo se modifican aún más por glicosilación , metilación , hidroxilación , oxidación u otros procesos. Muchos agentes antimicrobianos , antiparasitarios y anticancerígenos de uso común son policétidos o derivados de policétidos, como eritromicinas , tetraciclinas , avermectinas y epotilonas antitumorales . [55]
Las células eucariotas presentan orgánulos compartimentados unidos a membranas que llevan a cabo diferentes funciones biológicas. Los glicerofosfolípidos son el principal componente estructural de las membranas biológicas , como la membrana plasmática celular y las membranas intracelulares de los orgánulos; en las células animales, la membrana plasmática separa físicamente los componentes intracelulares del entorno extracelular . [ cita requerida ] Los glicerofosfolípidos son moléculas anfipáticas (que contienen regiones hidrófobas e hidrófilas) que contienen un núcleo de glicerol unido a dos "colas" derivadas de ácidos grasos por enlaces éster y a un grupo de "cabeza" por un enlace éster fosfato . [ cita requerida ] Si bien los glicerofosfolípidos son el componente principal de las membranas biológicas, otros componentes lipídicos no glicéridos como la esfingomielina y los esteroles (principalmente el colesterol en las membranas celulares animales) también se encuentran en las membranas biológicas. [56] [2] : 329–331 En plantas y algas, los galactosildiacilgliceroles, [57] y el sulfoquinovosildiacilglicerol, [32] que carecen de un grupo fosfato, son componentes importantes de las membranas de los cloroplastos y orgánulos relacionados y se encuentran entre los lípidos más abundantes en los tejidos fotosintéticos, incluidos los de plantas superiores, algas y ciertas bacterias. [58]
Las membranas tilacoides de las plantas tienen el componente lipídico más grande de un monogalactosil diglicérido no formador de bicapa (MGDG) y pocos fosfolípidos; a pesar de esta composición lipídica única, se ha demostrado que las membranas tilacoides del cloroplasto contienen una matriz lipídica bicapa dinámica, como lo revelan los estudios de resonancia magnética y microscopio electrónico. [59]

Una membrana biológica es una forma de bicapa lipídica de fase laminar . La formación de bicapas lipídicas es un proceso energéticamente preferido cuando los glicerofosfolípidos descritos anteriormente están en un entorno acuoso. [2] : 333–4 Esto se conoce como efecto hidrofóbico . En un sistema acuoso, las cabezas polares de los lípidos se alinean hacia el entorno polar acuoso, mientras que las colas hidrofóbicas minimizan su contacto con el agua y tienden a agruparse, formando una vesícula ; dependiendo de la concentración del lípido, esta interacción biofísica puede resultar en la formación de micelas , liposomas o bicapas lipídicas . También se observan otras agregaciones que forman parte del polimorfismo del comportamiento anfifílico (lípido). El comportamiento de fase es un área de estudio dentro de la biofísica . [60] [61] Las micelas y las bicapas se forman en el medio polar mediante un proceso conocido como efecto hidrofóbico. [62] Al disolver una sustancia lipofílica o anfifílica en un entorno polar, las moléculas polares (es decir, el agua en una solución acuosa) se vuelven más ordenadas alrededor de la sustancia lipofílica disuelta, ya que las moléculas polares no pueden formar enlaces de hidrógeno con las áreas lipofílicas del anfifílico. Por lo tanto, en un entorno acuoso, las moléculas de agua forman una jaula de " clatrato " ordenada alrededor de la molécula lipofílica disuelta. [63]
La formación de lípidos en las membranas de las protocélulas representa un paso clave en los modelos de abiogénesis , el origen de la vida. [64]
Los triglicéridos, almacenados en el tejido adiposo, son una forma importante de almacenamiento de energía tanto en animales como en plantas. Son una fuente importante de energía en la respiración aeróbica. La oxidación completa de los ácidos grasos libera alrededor de 38 kJ/g (9 kcal/g ), en comparación con solo 17 kJ/g (4 kcal/g) para la descomposición oxidativa de carbohidratos y proteínas . El adipocito , o célula grasa, está diseñado para la síntesis y descomposición continua de triglicéridos en animales, con una descomposición controlada principalmente por la activación de la enzima sensible a las hormonas, la lipasa . [65] Las aves migratorias que deben volar largas distancias sin comer usan triglicéridos para alimentar sus vuelos. [2] : 619
Han surgido evidencias que muestran que la señalización lipídica es una parte vital de la señalización celular . [66] [67] [68] [69] La señalización lipídica puede ocurrir a través de la activación de receptores nucleares o acoplados a proteína G , y se han identificado miembros de varias categorías lipídicas diferentes como moléculas de señalización y mensajeros celulares . [70] Estos incluyen esfingosina-1-fosfato , un esfingolípido derivado de la ceramida que es una potente molécula mensajera involucrada en la regulación de la movilización de calcio, [71] el crecimiento celular y la apoptosis; [72] diacilglicerol y los fosfatos de fosfatidilinositol (PIP), involucrados en la activación mediada por calcio de la proteína quinasa C ; [73] las prostaglandinas , que son un tipo de eicosanoide derivado de ácidos grasos involucrado en la inflamación y la inmunidad ; [74] las hormonas esteroides como el estrógeno , la testosterona y el cortisol , que modulan una serie de funciones como la reproducción, el metabolismo y la presión arterial; y los oxiesteroles como el 25-hidroxi-colesterol que son agonistas del receptor X del hígado . [75] Se sabe que los lípidos de fosfatidilserina están involucrados en la señalización para la fagocitosis de células apoptóticas o fragmentos de células. Logran esto al estar expuestos a la cara extracelular de la membrana celular después de la inactivación de las flipasas que las colocan exclusivamente en el lado citosólico y la activación de las escramblasas, que alteran la orientación de los fosfolípidos. Después de que esto ocurre, otras células reconocen las fosfatidilserinas y fagocitan las células o fragmentos de células exponiéndolas. [76]
Las vitaminas "liposolubles" ( A , D , E y K ), que son lípidos basados en isopreno , son nutrientes esenciales almacenados en el hígado y los tejidos grasos, con una amplia gama de funciones. Las acil-carnitinas están involucradas en el transporte y metabolismo de los ácidos grasos dentro y fuera de las mitocondrias, donde sufren oxidación beta . [77] Los poliprenoles y sus derivados fosforilados también juegan papeles importantes en el transporte, en este caso el transporte de oligosacáridos a través de las membranas. Los azúcares de fosfato de poliprenol y los azúcares de difosfato de poliprenol funcionan en reacciones de glicosilación extracitoplasmática, en la biosíntesis de polisacáridos extracelulares (por ejemplo, polimerización de peptidoglicano en bacterias) y en la N- glicosilación de proteínas eucariotas . [78] [79] Las cardiolipinas son una subclase de glicerofosfolípidos que contienen cuatro cadenas de acilo y tres grupos de glicerol que son particularmente abundantes en la membrana mitocondrial interna. [80] [81] Se cree que activan las enzimas involucradas en la fosforilación oxidativa . [82] Los lípidos también forman la base de las hormonas esteroides. [83]
Los principales lípidos de la dieta de los seres humanos y otros animales son los triglicéridos animales y vegetales, los esteroles y los fosfolípidos de membrana. El proceso del metabolismo lipídico sintetiza y degrada los depósitos lipídicos y produce los lípidos estructurales y funcionales característicos de los tejidos individuales.
En los animales, cuando hay un exceso de carbohidratos en la dieta, el exceso de carbohidratos se convierte en triglicéridos. Esto implica la síntesis de ácidos grasos a partir de acetil-CoA y la esterificación de ácidos grasos en la producción de triglicéridos, un proceso llamado lipogénesis . [2] : 634 Los ácidos grasos son producidos por sintasas de ácidos grasos que polimerizan y luego reducen las unidades de acetil-CoA. Las cadenas de acilo en los ácidos grasos se extienden mediante un ciclo de reacciones que agregan el grupo acetilo, lo reducen a un alcohol, lo deshidratan a un grupo alqueno y luego lo reducen nuevamente a un grupo alcano . Las enzimas de la biosíntesis de ácidos grasos se dividen en dos grupos, en animales y hongos todas estas reacciones de sintasa de ácidos grasos son llevadas a cabo por una sola proteína multifuncional, [84] mientras que en los plástidos vegetales y las bacterias enzimas separadas realizan cada paso en la vía. [85] [86] Los ácidos grasos pueden convertirse posteriormente en triglicéridos que se empaquetan en lipoproteínas y se secretan desde el hígado.
La síntesis de ácidos grasos insaturados implica una reacción de desaturación , mediante la cual se introduce un doble enlace en la cadena de acilo graso. Por ejemplo, en los seres humanos, la desaturación del ácido esteárico por la estearoil-CoA desaturasa-1 produce ácido oleico . El ácido graso doblemente insaturado, el ácido linoleico , así como el ácido α-linolénico triplemente insaturado , no pueden sintetizarse en los tejidos de los mamíferos y, por lo tanto, son ácidos grasos esenciales y deben obtenerse de la dieta. [2] : 643
La síntesis de triglicéridos se lleva a cabo en el retículo endoplásmico mediante vías metabólicas en las que los grupos acilo de los acil-CoA grasos se transfieren a los grupos hidroxilo del glicerol-3-fosfato y el diacilglicerol. [2] : 733–9
Los terpenos e isoprenoides , incluidos los carotenoides , se forman mediante el ensamblaje y la modificación de unidades de isopreno donadas a partir de los precursores reactivos pirofosfato de isopentenilo y pirofosfato de dimetilalilo . [48] Estos precursores se pueden producir de diferentes maneras. En animales y arqueas , la vía del mevalonato produce estos compuestos a partir de acetil-CoA, [87] mientras que en plantas y bacterias la vía no mevalonato utiliza piruvato y gliceraldehído 3-fosfato como sustratos. [48] [88] Una reacción importante que utiliza estos donantes de isopreno activados es la biosíntesis de esteroides . Aquí, las unidades de isopreno se unen para formar escualeno y luego se pliegan y forman un conjunto de anillos para formar lanosterol . [89] El lanosterol luego se puede convertir en otros esteroides como el colesterol y el ergosterol. [89] [90]
La beta oxidación es el proceso metabólico por el cual los ácidos grasos se descomponen en las mitocondrias o en los peroxisomas para generar acetil-CoA . En su mayor parte, los ácidos grasos se oxidan mediante un mecanismo que es similar, pero no idéntico, a una inversión del proceso de síntesis de ácidos grasos. Es decir, los fragmentos de dos carbonos se eliminan secuencialmente del extremo carboxilo del ácido después de los pasos de deshidrogenación , hidratación y oxidación para formar un beta-cetoácido , que se divide por tiolisis . El acetil-CoA se convierte finalmente en trifosfato de adenosina (ATP), CO2 y H2O utilizando el ciclo del ácido cítrico y la cadena de transporte de electrones . Por lo tanto, el ciclo del ácido cítrico puede comenzar en acetil-CoA cuando la grasa se está descomponiendo para obtener energía si hay poca o ninguna glucosa disponible. El rendimiento energético de la oxidación completa del palmitato de ácido graso es de 106 ATP. [2] : 625–6 Los ácidos grasos insaturados y de cadena impar requieren pasos enzimáticos adicionales para su degradación.
La mayor parte de la grasa que se encuentra en los alimentos está en forma de triglicéridos, colesterol y fosfolípidos. Algunas grasas de la dieta son necesarias para facilitar la absorción de vitaminas liposolubles ( A , D , E y K ) y carotenoides . [91] : 903 Los humanos y otros mamíferos tienen un requerimiento dietético de ciertos ácidos grasos esenciales, como el ácido linoleico (un ácido graso omega-6 ) y el ácido alfa-linolénico (un ácido graso omega-3) porque no pueden sintetizarse a partir de precursores simples en la dieta. [2] : 643 Ambos ácidos grasos son ácidos grasos poliinsaturados de 18 carbonos que difieren en el número y la posición de los dobles enlaces. La mayoría de los aceites vegetales son ricos en ácido linoleico ( aceites de cártamo , girasol y maíz ). El ácido alfa-linolénico se encuentra en las hojas verdes de las plantas y en algunas semillas, nueces y legumbres (en particular lino , colza , nuez y soja ). [92] Los aceites de pescado son particularmente ricos en ácidos grasos omega-3 de cadena larga, ácido eicosapentaenoico y ácido docosahexaenoico . [91] : 388 Muchos estudios han demostrado beneficios positivos para la salud asociados con el consumo de ácidos grasos omega-3 en el desarrollo infantil, el cáncer, las enfermedades cardiovasculares y varias enfermedades mentales (como la depresión, el trastorno por déficit de atención con hiperactividad y la demencia). [93] [94]
En cambio, ahora está bien establecido que el consumo de grasas trans , como las presentes en los aceites vegetales parcialmente hidrogenados , es un factor de riesgo de enfermedades cardiovasculares . Las grasas que son buenas para la salud pueden convertirse en grasas trans mediante métodos de cocción inadecuados que dan como resultado una cocción excesiva de los lípidos. [95] [96] [97]
Algunos estudios han sugerido que la ingesta total de grasas en la dieta está relacionada con un mayor riesgo de obesidad. [98] [99] y diabetes; [100] Otros, incluido el Women's Health Initiative Dietary Modification Trial, un estudio de ocho años de 49.000 mujeres, el Nurses' Health Study y el Health Professionals Follow-up Study, no revelaron tales vínculos. [101] [102] Ninguno de estos estudios sugirió ninguna conexión entre el porcentaje de calorías provenientes de grasas y el riesgo de cáncer, enfermedades cardíacas o aumento de peso. The Nutrition Source, [103] un sitio web mantenido por el departamento de nutrición de la TH Chan School of Public Health de la Universidad de Harvard , resume la evidencia actual sobre el efecto de las grasas en la dieta: "Investigaciones detalladas, gran parte de ellas realizadas en Harvard, muestran que la cantidad total de grasas en la dieta no está realmente relacionada con el peso o las enfermedades". [104]
Introductorio
Nomenclatura
Bases de datos
General