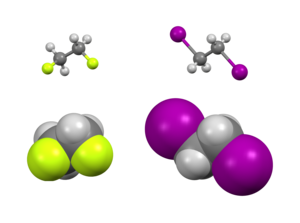
En el estudio de la isomería conformacional , el efecto gauche es una situación atípica donde una conformación gauche (grupos separados por un ángulo de torsión de aproximadamente 60°) es más estable que la anticonformación (180°). [2]

Existen efectos estéricos y electrónicos que afectan la estabilidad relativa de los conformadores. Por lo general, predominan los efectos estéricos que colocan a los sustituyentes grandes lejos unos de otros. Sin embargo, este no es el caso de ciertos sustituyentes, típicamente aquellos que son altamente electronegativos . En cambio, existe una preferencia electrónica por que estos grupos sean torpes. Los ejemplos típicamente estudiados incluyen 1,2-difluoroetano (H 2 FCCFH 2 ), etilenglicol y estructuras de difluoroalquilo vecinales.
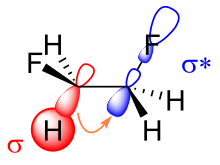
Hay dos explicaciones principales para el efecto torpe: la hiperconjugación y los enlaces doblados . En el modelo de hiperconjugación, la donación de densidad electrónica del orbital enlazante C-H σ al orbital antienlazante C-F σ * se considera la fuente de estabilización en el isómero gauche. Debido a la mayor electronegatividad del flúor, el orbital C-H σ es un mejor donante de electrones que el orbital C-F σ, mientras que el orbital C-F σ * es un mejor aceptor de electrones que el orbital C-H σ * . Sólo la conformación gauche permite una buena superposición entre el mejor donante y el mejor aceptor.
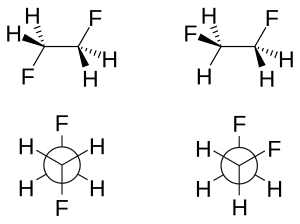
La clave en la explicación del efecto gauche del enlace doblado en el difluoroetano es el carácter orbital p aumentado de ambos enlaces C-F debido a la gran electronegatividad del flúor. Como resultado, la densidad de electrones aumenta arriba y abajo a la izquierda y a la derecha del enlace C-C central. La superposición orbital reducida resultante se puede compensar parcialmente cuando se asume una conformación gauche, formando un enlace doblado. De estos dos modelos, la hiperconjugación generalmente se considera la causa principal detrás del efecto torpe en el difluoroetano. [5] [6]
La geometría molecular de ambos rotámeros se puede obtener experimentalmente mediante espectroscopia infrarroja de alta resolución aumentada con trabajo in silico . [2] De acuerdo con el modelo descrito anteriormente, la longitud del enlace carbono-carbono es mayor para el antirrotámero (151,4 pm frente a 150 pm). La repulsión estérica entre los átomos de flúor en el rotámero gauche provoca un aumento de los ángulos de enlace CCF (en 3,2 °) y un aumento de los ángulos diédricos FCCF (del valor predeterminado de 60 ° a 71 °).
En el compuesto relacionado 1,2-difluoro-1,2-difeniletano, se encuentra que el isómero treo (mediante difracción de rayos X y a partir de constantes de acoplamiento de RMN ) tiene una anticonformación entre los dos grupos fenilo y los dos grupos flúor y una La conformación gauche se encuentra para ambos grupos para el isómero eritro . [7] Según los resultados in silico , esta conformación es más estable en 0,21 kcal/mol (880 J/mol).
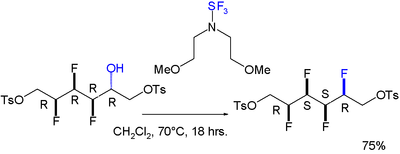
También se ha informado de un efecto torpe para una molécula que presenta una matriz totalmente sintética de cuatro sustituyentes fluoro consecutivos. La reacción al instalar el cuarto es estereoselectiva : [8]
El efecto torpe también se observa en el 1,2-dimetoxietano [ cita necesaria ] y algunos compuestos de dinitroalquilo vecinales.
El efecto alqueno cis es una estabilización atípica análoga de ciertos alquenos.
El efecto gauche es muy sensible a los efectos de los disolventes , debido a la gran diferencia de polaridad entre los dos confórmeros. Por ejemplo, el 2,3-dinitro-2,3-dimetilbutano, que en estado sólido existe sólo en la conformación gauche, prefiere el confórmero gauche en solución de benceno en una proporción de 79:21, pero en tetracloruro de carbono prefiere la conformación gauche. anticonformador en una proporción de 58:42. [9] Otro caso es el trans -1,2 difluorociclohexano, que tiene una mayor preferencia por el confórmero die-ecuatorial, en lugar del confórmero anti-diaxial, en disolventes más polares. [6]