La unión cooperativa ocurre en sistemas de unión molecular que contienen más de un tipo o especie de molécula y en los que uno de los socios no es monovalente y puede unirse a más de una molécula de la otra especie. En general, la unión molecular es una interacción entre moléculas que da como resultado una asociación física estable entre esas moléculas.
La unión cooperativa ocurre en un sistema de unión molecular donde dos o más moléculas de ligando pueden unirse a una molécula receptora . La unión puede considerarse "cooperativa" si la unión real de la primera molécula del ligando al receptor cambia la afinidad de unión de la segunda molécula del ligando. La unión de moléculas de ligando a los diferentes sitios de la molécula receptora no constituyen eventos mutuamente independientes. La cooperatividad puede ser positiva o negativa, lo que significa que es más o menos probable que sucesivas moléculas de ligando se unan a la molécula receptora.
La unión cooperativa se observa en muchos biopolímeros, incluidas proteínas y ácidos nucleicos . Se ha demostrado que la unión cooperativa es el mecanismo subyacente a una amplia gama de procesos bioquímicos y fisiológicos.
En 1904, Christian Bohr estudió la unión de la hemoglobina al oxígeno en diferentes condiciones. [1] [2] Al trazar la saturación de hemoglobina con oxígeno en función de la presión parcial de oxígeno, obtuvo una curva sigmoidea (o "en forma de S"). Esto indica que cuanto más oxígeno esté unido a la hemoglobina, más fácil será que se una más oxígeno, hasta que todos los sitios de unión estén saturados. Además, Bohr observó que el aumento de la presión de CO 2 desplazaba esta curva hacia la derecha, es decir, concentraciones más altas de CO 2 dificultan que la hemoglobina se una al oxígeno. [2] Este último fenómeno, junto con la observación de que la afinidad de la hemoglobina por el oxígeno aumenta al aumentar el pH, se conoce como efecto Bohr .

Se dice que una molécula receptora exhibe unión cooperativa si su unión al ligando escala de manera no lineal con la concentración del ligando. La cooperatividad puede ser positiva (si la unión de una molécula de ligando aumenta la afinidad aparente del receptor y, por lo tanto, aumenta la posibilidad de que se una otra molécula de ligando) o negativa (si la unión de una molécula de ligando disminuye la afinidad y, por lo tanto, hace que la unión de otras moléculas de ligando sea menos probable). . La "ocupación fraccionaria" de un receptor con un ligando determinado se define como la cantidad de sitios de unión unidos al ligando dividida por la cantidad total de sitios de unión al ligando:
Si , entonces la proteína está completamente libre y si , está completamente saturada. Si la gráfica de equilibrio en función de la concentración de ligando tiene forma sigmoidea, como observó Bohr para la hemoglobina, esto indica cooperatividad positiva. Si no es así, no se puede hacer ninguna afirmación sobre la cooperatividad mirando únicamente este gráfico.
El concepto de unión cooperativa sólo se aplica a moléculas o complejos con más de un sitio de unión a ligando. Si existen varios sitios de unión de ligando, pero la unión del ligando a cualquiera de los sitios no afecta a los demás, se dice que el receptor no coopera. La cooperatividad puede ser homotrópica , si un ligando influye en la unión de ligandos del mismo tipo, o heterotrópica , si influye en la unión de otros tipos de ligandos. En el caso de la hemoglobina, Bohr observó cooperatividad positiva homotrópica (la unión de oxígeno facilita la unión de más oxígeno) y cooperatividad negativa heterotrópica (la unión de CO 2 reduce la capacidad de la hemoglobina para unirse al oxígeno).
A lo largo del siglo XX, se han desarrollado varios marcos para describir la unión de un ligando a una proteína con más de un sitio de unión y los efectos cooperativos observados en este contexto. [3]
La primera descripción de la unión cooperativa a una proteína multisitio fue desarrollada por AV Hill . [4] Basándose en las observaciones de la unión del oxígeno a la hemoglobina y la idea de que la cooperatividad surgió de la agregación de moléculas de hemoglobina, cada una de las cuales unía una molécula de oxígeno, Hill sugirió una ecuación fenomenológica que desde entonces lleva su nombre :

donde es el "coeficiente de Hill", denota concentración de ligando, denota una constante de asociación aparente (usada en la forma original de la ecuación), es una constante de disociación empírica y una constante de disociación microscópica (usada en las formas modernas de la ecuación y equivalente a una ). Si , el sistema exhibe cooperatividad negativa, mientras que la cooperatividad es positiva si . El número total de sitios de unión al ligando es un límite superior para . La ecuación de Hill se puede linealizar como:
El "gráfico de colina" se obtiene trazando versus . En el caso de la ecuación de Hill, es una recta con pendiente e intercepto . Esto significa que se supone que la cooperatividad es fija, es decir, no cambia con la saturación. También significa que los sitios de unión siempre exhiben la misma afinidad y la cooperatividad no surge de una afinidad que aumenta con la concentración del ligando.
GS Adair descubrió que el diagrama de Hill para la hemoglobina no era una línea recta y planteó la hipótesis de que la afinidad de unión no era un término fijo, sino que dependía de la saturación del ligando. [5] Habiendo demostrado que la hemoglobina contenía cuatro hemo (y por lo tanto sitios de unión para el oxígeno), trabajó partiendo del supuesto de que la hemoglobina completamente saturada se forma en etapas, con formas intermedias con una, dos o tres moléculas de oxígeno unidas. La formación de cada etapa intermedia a partir de hemoglobina libre se puede describir utilizando una constante de asociación macroscópica aparente . La ocupación fraccionaria resultante se puede expresar como:
O, para cualquier proteína con n sitios de unión a ligando:
donde n denota el número de sitios de unión y cada uno es una constante de asociación combinada, que describe la unión de i moléculas de ligando. Al combinar el tratamiento de Adair con el gráfico de Hill, se llega a la definición experimental moderna de cooperatividad (Hill, 1985, Abeliovich, 2005). Se puede demostrar que el coeficiente de Hill resultante, o más correctamente la pendiente del gráfico de Hill calculado a partir de la ecuación de Adair, es la relación entre la varianza del número de vinculación y la varianza del número de vinculación en un sistema equivalente de elementos que no interactúan. sitios de unión. [6] Por lo tanto, el coeficiente de Hill define la cooperatividad como una dependencia estadística de un sitio de unión del estado de otros sitios.
Al trabajar con proteínas de unión a calcio, Irving Klotz desconvolucionó las constantes de asociación de Adair considerando la formación gradual de las etapas intermedias y trató de expresar la unión cooperativa en términos de procesos elementales regidos por la ley de acción de masas. [7] [8] En su marco, es la constante de asociación que rige la unión de la primera molécula de ligando, la constante de asociación que rige la unión de la segunda molécula de ligando (una vez que la primera ya está unida), etc. Para , esto da:
Vale la pena señalar que las constantes , etc., no se relacionan con sitios de unión individuales. Describen cuántos sitios de unión están ocupados, en lugar de cuáles . Esta forma tiene la ventaja de que la cooperatividad se reconoce fácilmente al considerar las constantes de asociación. Si todos los sitios de unión del ligando son idénticos con una constante de asociación microscópica , se esperaría (es decir ) ausencia de cooperatividad. Tenemos cooperatividad positiva si está por encima de estos valores esperados para .
La ecuación de Klotz (que a veces también se denomina ecuación de Adair-Klotz) todavía se utiliza a menudo en la literatura experimental para describir mediciones de la unión del ligando en términos de constantes de unión aparentes secuenciales. [9]
A mediados del siglo XX, hubo un mayor interés en modelos que no solo describieran fenomenológicamente las curvas de unión, sino que ofrecieran un mecanismo bioquímico subyacente. Linus Pauling reinterpretó la ecuación proporcionada por Adair, asumiendo que sus constantes eran la combinación de la constante de unión del ligando ( en la ecuación a continuación) y la energía proveniente de la interacción entre subunidades de la proteína cooperativa ( a continuación). [10] Pauling en realidad derivó varias ecuaciones, dependiendo del grado de interacción entre las subunidades. Basándose en suposiciones erróneas sobre la localización de los hemos, optó por la equivocada para describir la unión del oxígeno por la hemoglobina, suponiendo que las subunidades estuvieran dispuestas en un cuadrado. La siguiente ecuación proporciona la ecuación para una estructura tetraédrica, que sería más precisa en el caso de la hemoglobina:
Basándose en los resultados que muestran que la estructura de las proteínas cooperativas cambia al unirse a su ligando, Daniel Koshland y sus colegas [11] refinaron la explicación bioquímica del mecanismo descrito por Pauling. [10] El modelo Koshland-Némethy-Filmer (KNF) supone que cada subunidad puede existir en una de dos conformaciones: activa o inactiva. La unión del ligando a una subunidad induciría un cambio conformacional inmediato de esa subunidad de la conformación inactiva a la activa, un mecanismo descrito como "ajuste inducido". [12] La cooperatividad, según el modelo KNF, surgiría de interacciones entre las subunidades, cuya fuerza varía dependiendo de las conformaciones relativas de las subunidades involucradas. Para una estructura tetraédrica (también consideraron estructuras lineales y cuadradas), propusieron la siguiente fórmula:
Donde es la constante de asociación para X, es la proporción de los estados B y A en ausencia de ligando ("transición"), y son las estabilidades relativas de pares de subunidades vecinas en relación con un par donde ambas subunidades están en el estado A. (Tenga en cuenta que el documento de KNF en realidad presenta el número de sitios ocupados, que aquí es 4 veces ).


El modelo Monod-Wyman-Changeux (MWC) para transiciones alostéricas concertadas [13] fue un paso más allá al explorar la cooperatividad basada en la termodinámica y las conformaciones tridimensionales. Fue formulado originalmente para proteínas oligoméricas con subunidades idénticas dispuestas simétricamente, cada una de las cuales tiene un sitio de unión al ligando. Según este marco, dos (o más) estados conformacionales interconvertibles de una proteína alostérica coexisten en un equilibrio térmico. Los estados, a menudo denominados tenso (T) y relajado (R), difieren en su afinidad por la molécula del ligando. La relación entre los dos estados está regulada por la unión de moléculas de ligando que estabiliza el estado de mayor afinidad. Es importante destacar que todas las subunidades de una molécula cambian de estado al mismo tiempo, un fenómeno conocido como "transición concertada".
La constante de isomerización alostérica L describe el equilibrio entre ambos estados cuando no hay ninguna molécula de ligando unida: . Si L es muy grande, la mayor parte de la proteína existe en el estado T en ausencia de ligando. Si L es pequeño (cerca de uno), el estado R está casi tan poblado como el estado T. La relación de constantes de disociación para el ligando de los estados T y R se describe mediante la constante c :. Si , tanto el estado R como el T tienen la misma afinidad por el ligando y el ligando no afecta la isomerización. El valor de c también indica cuánto cambia el equilibrio entre los estados T y R tras la unión del ligando: cuanto menor c , más se desplaza el equilibrio hacia el estado R después de una unión. Con , la ocupación fraccionaria se describe como:
El gráfico de Hill sigmoideo de proteínas alostéricas se puede analizar como una transición progresiva del estado T (baja afinidad) al estado R (alta afinidad) a medida que aumenta la saturación. La pendiente del gráfico de Hill también depende de la saturación, con un valor máximo en el punto de inflexión. Las intersecciones entre las dos asíntotas y el eje y permiten determinar las afinidades de ambos estados por el ligando.

En las proteínas, el cambio conformacional a menudo se asocia con actividad o actividad hacia objetivos específicos. Esta actividad es a menudo lo que es fisiológicamente relevante o lo que se mide experimentalmente. El grado de cambio conformacional se describe mediante la función de estado , que denota la fracción de proteína presente en el estado. Como ilustra el diagrama de energía, aumenta a medida que se unen más moléculas de ligando. La expresión para es:
Un aspecto crucial del modelo MWC es que las curvas para y no coinciden, [14] es decir, la saturación fraccional no es un indicador directo del estado conformacional (y por tanto, de la actividad). Además, los grados de cooperatividad de unión y cooperatividad de activación pueden ser muy diferentes: un caso extremo lo proporciona el motor de flagelos de bacterias con un coeficiente de Hill de 1,7 para la unión y 10,3 para la activación. [15] [16] La supralinealidad de la respuesta a veces se denomina ultrasensibilidad .
Si una proteína alostérica se une a un objetivo que también tiene una mayor afinidad por el estado R, entonces la unión al objetivo estabiliza aún más el estado R, aumentando así la afinidad del ligando. Si, por otro lado, un objetivo se une preferentemente al estado T, entonces la unión al objetivo tendrá un efecto negativo sobre la afinidad del ligando. Estos objetivos se denominan moduladores alostéricos .
Desde sus inicios, el marco del CMM se ha ampliado y generalizado. Se han propuesto variaciones, por ejemplo para atender a proteínas con más de dos estados, [17] proteínas que se unen a varios tipos de ligandos [18] [19] o varios tipos de moduladores alostéricos [19] y proteínas con subunidades no idénticas. o sitios de unión a ligandos. [20]
La lista de conjuntos moleculares que exhiben unión cooperativa de ligandos es muy grande, pero algunos ejemplos son particularmente notables por su interés histórico, sus propiedades inusuales o su importancia fisiológica.
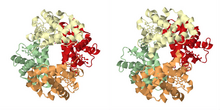
Como se describe en la sección histórica, el ejemplo más famoso de unión cooperativa es la hemoglobina . Su estructura cuaternaria, resuelta por Max Perutz mediante difracción de rayos X, [21] exhibe un tetraedro pseudosimétrico que lleva cuatro sitios de unión (hemes) para el oxígeno. Se han estudiado con gran detalle muchos otros conjuntos moleculares que exhiben unión cooperativa.
La actividad de muchas enzimas está regulada por efectores alostéricos. Algunas de estas enzimas son multiméricas y tienen varios sitios de unión para los reguladores.
La treonina desaminasa fue una de las primeras enzimas que se sugirió que se comportaba como la hemoglobina [22] y se demostró que se une a ligandos de manera cooperativa. [23] Más tarde se demostró que era una proteína tetramérica. [24]
Otra enzima que se ha sugerido tempranamente para unir ligandos de manera cooperativa es la aspartato transcarbamilasa . [25] Aunque los modelos iniciales eran consistentes con cuatro sitios de unión, [26] William Lipscomb y sus colegas demostraron más tarde que su estructura era hexamérica . [27]
La mayoría de los canales iónicos están formados por varios monómeros o dominios idénticos o pseudoidénticos, dispuestos simétricamente en membranas biológicas. Varias clases de tales canales cuya apertura está regulada por ligandos exhiben unión cooperativa de estos ligandos.
Ya en 1967 [28] (cuando aún se desconocía la naturaleza exacta de esos canales) se sugirió que los receptores nicotínicos de acetilcolina se unían a la acetilcolina de manera cooperativa debido a la existencia de varios sitios de unión. La purificación del receptor [29] y su caracterización demostró una estructura pentamérica con sitios de unión ubicados en las interfaces entre subunidades, confirmada por la estructura del dominio de unión al receptor. [30]
Los receptores de trifosfato de inositol (IP3) forman otra clase de canales iónicos activados por ligando que exhiben unión cooperativa. [31] La estructura de esos receptores muestra cuatro sitios de unión de IP3 dispuestos simétricamente. [32]
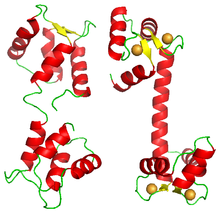
Aunque la mayoría de las proteínas que muestran unión cooperativa son complejos multiméricos de subunidades homólogas, algunas proteínas llevan varios sitios de unión para el mismo ligando en el mismo polipéptido. Un ejemplo de ello es la calmodulina . Una molécula de calmodulina une cuatro iones de calcio de forma cooperativa. [33] Su estructura presenta cuatro dominios EF-hand , [34] cada uno de los cuales se une a un ion calcio. La molécula no muestra una estructura cuadrada o tetraédrica, sino que está formada por dos lóbulos, cada uno de los cuales lleva dos dominios de mano EF.
También se ha demostrado la unión cooperativa de proteínas a ácidos nucleicos. Un ejemplo clásico es la unión del represor del fago lambda a sus operadores, que se produce de forma cooperativa. [35] [36] Otros ejemplos de factores de transcripción exhiben cooperatividad positiva cuando se unen a su objetivo, como el represor de las bombas TtgABC [37] (n=1,6), así como cooperatividad condicional exhibida por los factores de transcripción HOXA11 y FOXO1 . [38]
Por el contrario, también se documentaron ejemplos de cooperatividad negativa para la unión de factores de transcripción, como para el represor homodimérico del operón hidroxilasa del citocromo P450cam de Pseudomonas putida [39] (n=0,56).
Desde el principio, se ha argumentado que algunas proteínas, especialmente aquellas que constan de muchas subunidades, podrían regularse mediante un mecanismo MWC generalizado, en el que la transición entre los estados R y T no está necesariamente sincronizada en toda la proteína. [40] En 1969, Wyman [41] propuso un modelo con "conformaciones mixtas" (es decir, algunos protómeros en el estado R, algunos en el estado T) para las proteínas respiratorias en los invertebrados.
Siguiendo una idea similar, el modelo de dispersión conformacional de Duke y colegas [42] incluye tanto el modelo KNF como el modelo MWC como casos especiales. En este modelo, una subunidad no cambia automáticamente su conformación al unirse al ligando (como en el modelo KNF), ni todas las subunidades en un complejo cambian de conformación juntas (como en el modelo MWC). Los cambios conformacionales son estocásticos y la probabilidad de que una subunidad cambie de estado depende de si está unida o no a un ligando y del estado conformacional de las subunidades vecinas. Por tanto, los estados conformacionales pueden "extenderse" por todo el complejo.
En una célula viva, los módulos ultrasensibles están integrados en una red más grande con componentes ascendentes y descendentes. Estos componentes pueden limitar el rango de entradas que recibirá el módulo, así como el rango de salidas del módulo que la red podrá detectar. [43] La sensibilidad de un sistema modular se ve afectada por estas restricciones. Las limitaciones de rango dinámico impuestas por los componentes posteriores pueden producir sensibilidades efectivas mucho mayores que las del módulo original cuando se consideran de forma aislada.
![]() Este artículo fue adaptado de la siguiente fuente bajo una licencia CC BY 4.0 (2013) (informes de los revisores): Melanie I Stefan; Nicolás Le Novère (2013). "Encuadernación cooperativa". PLOS Biología Computacional . 9 (6): e1003106. doi :10.1371/JOURNAL.PCBI.1003106. ISSN 1553-734X. PMC 3699289 . PMID 23843752. Wikidata Q21045427.
Este artículo fue adaptado de la siguiente fuente bajo una licencia CC BY 4.0 (2013) (informes de los revisores): Melanie I Stefan; Nicolás Le Novère (2013). "Encuadernación cooperativa". PLOS Biología Computacional . 9 (6): e1003106. doi :10.1371/JOURNAL.PCBI.1003106. ISSN 1553-734X. PMC 3699289 . PMID 23843752. Wikidata Q21045427.{{cite journal}}: CS1 maint: unflagged free DOI (link)