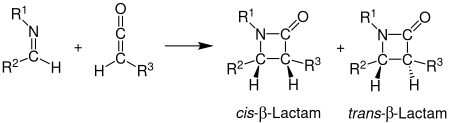
La síntesis de Staudinger , también llamada cicloadición de ceteno-imina de Staudinger, es una síntesis química en la que una imina 1 reacciona con una cetena 2 a través de una cicloadición 2+2 no fotoquímica para producir una β -lactama 3. [1] La reacción tiene particular importancia en la síntesis de antibióticos β-lactámicos . [2] La síntesis de Staudinger no debe confundirse con la reacción de Staudinger , una reacción de fosfina o fosfito utilizada para reducir azidas a aminas.

Se han publicado revisiones sobre el mecanismo, la estereoquímica y las aplicaciones de la reacción. [3] [4] [5]
La reacción fue descubierta en 1907 por el químico alemán Hermann Staudinger . [6] La reacción no atrajo interés hasta la década de 1940, cuando se dilucidó la estructura de la penicilina . La fracción β -lactámica de la primera penicilina sintética se construyó utilizando esta cicloadición, [7] y sigue siendo una herramienta valiosa en la química orgánica sintética.
El primer paso es un ataque nucleofílico por el nitrógeno de la imina sobre el carbono carbonílico para generar un intermedio zwitteriónico . Los grupos donadores de electrones en la imina facilitan este paso, mientras que los grupos atractores de electrones impiden el ataque. [8] El segundo paso es un cierre de anillo nucleofílico intramolecular o un cierre de anillo electrocíclico conrotatorio . [9] El segundo paso es diferente de los cierres de anillo electrocíclicos típicos predichos por las reglas de Woodward-Hoffmann . Bajo condiciones fotoquímicas y de microondas, el sistema de 4π-electrones del intermedio no puede sufrir un cierre de anillo disrotatorio para formar la β-lactama, posiblemente porque los dos dobles enlaces no son coplanares. [10] Algunos productos de la síntesis de Staudinger difieren de los predichos por el modelo torquoelectrónico . [11] Además, la estructura electrónica del estado de transición difiere de la de otros cierres de anillo conrotatorio. [11] Hay evidencia de estudios computacionales sobre sistemas modelo de que en la fase gaseosa el mecanismo está concertado. [5]

La estereoquímica de la síntesis de Staudinger puede ser difícil de predecir porque cualquiera de los pasos puede ser determinante de la velocidad . [12] Si el paso de cierre del anillo es determinante de la velocidad, las predicciones estereoquímicas basadas en la torquoselectividad son confiables. [12] Otros factores que afectan la estereoquímica incluyen la regioquímica inicial de la imina. Generalmente, las (E)-iminas forman β-lactamas cis mientras que las (Z)-iminas forman β-lactamas trans. [5] Otros sustituyentes también afectan la estereoquímica. Las cetenas con sustituyentes fuertes donadores de electrones producen principalmente β-lactamas cis, mientras que las cetenas con sustituyentes fuertes atractores de electrones generalmente producen β-lactamas trans. El sustituyente ceteno afecta el estado de transición al acelerar o ralentizar el progreso hacia la β-lactama. Una reacción más lenta permite la isomerización de la imina, que generalmente da como resultado un producto trans. [11]
Se han publicado revisiones sobre la inducción asimétrica de la síntesis de Staudinger, incluido el uso de catalizadores orgánicos y organometálicos . [1] [5] [13]
La imina se puede reemplazar agregando olefina para producir una ciclobutanona , carbonilo para producir una β -lactona o carbodiimidas para producir β -lactámas de 4-imino . [1] La síntesis de Staudinger y sus variaciones son todas cicloadiciones de cetenas .

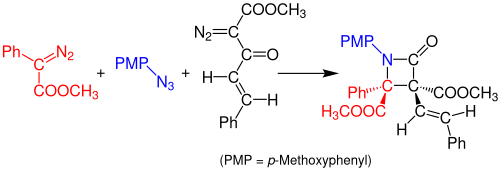
En 2014, Doyle y colaboradores informaron sobre una síntesis de Staudinger multicomponente en un solo recipiente de β-lactamas a partir de azidas y dos compuestos diazo. La reacción ocurre mediante una reacción catalizada por acetato de rodio entre el arildiazoacetato (rojo) y la azida orgánica (azul) para formar una imina. Una transposición de Wolff de la enona diazoacetoacetato (negra) forma una cetena estable, que reacciona con la imina para formar un compuesto β-lactámico estable. El disolvente utilizado para esta reacción es diclorometano (DCM) y la solución necesita reposar durante 3 horas a temperatura ambiente. El rendimiento de la reacción es de alrededor del 99 %. [14]
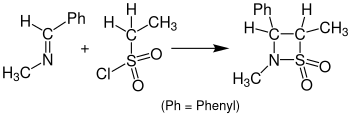
La reacción con sulfenos en lugar de cetenos que da lugar a β - sultamas se denomina cicloadición de sulfas-Staudinger . La siguiente ilustración muestra un ejemplo de cicloadición de sulfas-Staudinger. La bencilidenometilamina reacciona con cloruro de etanosulfonilo para formar una β-sultama. Para esta reacción se utilizó tetrahidrofurano (THF) como disolvente y la solución tuvo que reposar durante 24 horas. [15]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )