
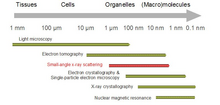
La dispersión biológica de ángulo pequeño es un método de dispersión de ángulo pequeño para el análisis de la estructura de materiales biológicos. La dispersión de ángulo pequeño se utiliza para estudiar la estructura de una variedad de objetos, como soluciones de macromoléculas biológicas, nanocompuestos, aleaciones y polímeros sintéticos. [1] La dispersión de rayos X de ángulo pequeño ( SAXS ) y la dispersión de neutrones de ángulo pequeño ( SANS ) son las dos técnicas complementarias conocidas conjuntamente como dispersión de ángulo pequeño (SAS). [2] SAS es un método análogo a la difracción de rayos X y neutrones , la dispersión de rayos X de ángulo amplio , así como a la dispersión de luz estática . A diferencia de otros métodos de dispersión de rayos X y neutrones, SAS proporciona información sobre los tamaños y formas de partículas cristalinas y no cristalinas. Cuando se utiliza para estudiar materiales biológicos, que muy a menudo están en solución acuosa, el patrón de dispersión se promedia en función de la orientación. [3] [4]
Los patrones SAS se recogen en pequeños ángulos de unos pocos grados. SAS es capaz de proporcionar información estructural en el rango de resolución entre 1 y 25 nm , y de distancias de repetición en sistemas parcialmente ordenados de hasta 150 nm de tamaño. La dispersión de ángulo ultra pequeño (USAS) puede resolver dimensiones incluso mayores. La dispersión de ángulo pequeño de incidencia rasante (GISAS) es una técnica potente para estudiar capas de moléculas biológicas en superficies.
En aplicaciones biológicas, el SAS se utiliza para determinar la estructura de una partícula en términos de tamaño y forma promedio de la partícula. También se puede obtener información sobre la relación superficie - volumen . Normalmente, las macromoléculas biológicas se dispersan en un líquido. El método es preciso, en su mayoría no destructivo y, por lo general, requiere solo un mínimo de preparación de la muestra. Sin embargo, las moléculas biológicas siempre son susceptibles a daños por radiación .
En comparación con otros métodos de determinación de la estructura, como la RMN en solución o la cristalografía de rayos X , la SAS permite superar algunas limitaciones. Por ejemplo, la RMN en solución está limitada al tamaño de las proteínas, mientras que la SAS se puede utilizar para moléculas pequeñas, así como para grandes conjuntos multimoleculares. La RMN de estado sólido sigue siendo una herramienta indispensable para determinar la información a nivel atómico de macromoléculas mayores de 40 kDa o muestras no cristalinas como las fibrillas amiloides. La determinación de la estructura mediante cristalografía de rayos X puede llevar varias semanas o incluso años, mientras que las mediciones SAS tardan días. La SAS también se puede acoplar a otras técnicas analíticas como la cromatografía de exclusión por tamaño para estudiar muestras heterogéneas. [5] Sin embargo, con SAS no es posible medir las posiciones de los átomos dentro de la molécula.

En teoría, los experimentos de dispersión de ángulos pequeños son sencillos: la muestra se expone a rayos X o neutrones y un detector registra la radiación dispersada. Como las mediciones SAS se realizan muy cerca del haz primario ("ángulos pequeños"), la técnica necesita un haz de rayos X o neutrones muy colimado o enfocado . La dispersión biológica de rayos X de ángulo pequeño se realiza a menudo en fuentes de radiación de sincrotrón , porque las moléculas biológicas normalmente se dispersan débilmente y las soluciones medidas están diluidas . El método biológico SAXS se beneficia de la alta intensidad de los haces de fotones de rayos X proporcionados por los anillos de almacenamiento de sincrotrón . La curva de dispersión de rayos X o neutrones (intensidad versus ángulo de dispersión) se utiliza para crear un modelo de baja resolución de una proteína, que se muestra aquí en la imagen de la derecha. Se pueden utilizar además los datos de dispersión de rayos X o neutrones y ajustar dominios separados (estructuras de rayos X o RMN ) en la "envolvente SAXS".
En un experimento de dispersión, una solución de macromoléculas se expone a rayos X (con una longitud de onda λ típicamente alrededor de 0,15 nm) o neutrones térmicos ( λ ≈0,5 nm). La intensidad dispersada I(s) se registra como una función de la transferencia de momento s ( s=4πsinθ/λ , donde 2θ es el ángulo entre la radiación incidente y dispersa). De la intensidad de la solución se resta la dispersión solo del disolvente. Las posiciones y orientaciones aleatorias de las partículas dan como resultado una distribución de intensidad isótropa que, para partículas monodispersas que no interactúan, es proporcional a la dispersión de una sola partícula promediada sobre todas las orientaciones. La dispersión neta de partículas es proporcional a la diferencia al cuadrado en la densidad de longitud de dispersión ( densidad electrónica para rayos X y densidad nuclear/de espín para neutrones) entre la partícula y el disolvente, el llamado contraste. El contraste se puede variar en la dispersión de neutrones utilizando mezclas de H2O / D2O o deuteración selectiva para producir información adicional. [1] El contenido de información de los datos SAS se ilustra aquí en la figura de la derecha, que muestra patrones de dispersión de rayos X de proteínas con diferentes pliegues y masas moleculares . En ángulos bajos (resolución de 2-3 nm) las curvas son funciones de decaimiento rápido de s determinadas esencialmente por la forma de la partícula, que difieren claramente. En una resolución media (2 a 0,5 nm) las diferencias ya son menos pronunciadas y por encima de una resolución de 0,5 nm todas las curvas son muy similares. [6] SAS contiene, por tanto, información sobre las características estructurales generales (forma, estructura cuaternaria y terciaria), pero no es adecuado para el análisis de la estructura atómica.
Las primeras aplicaciones se remontan a finales de la década de 1930, cuando Guinier desarrolló los principios básicos del SAXS a raíz de sus estudios sobre aleaciones metálicas. En la primera monografía sobre SAXS de Guinier y Fournet ya se demostró que el método proporciona información no solo sobre los tamaños y formas de las partículas, sino también sobre la estructura interna de sistemas desordenados y parcialmente ordenados.
En la década de 1960, el método se volvió cada vez más importante en el estudio de macromoléculas biológicas en solución, ya que permitía obtener información estructural de baja resolución sobre la forma general y la estructura interna en ausencia de cristales. Un gran avance en los experimentos SAXS y SANS se produjo en la década de 1970, gracias a la disponibilidad de radiación de sincrotrón y fuentes de neutrones, estas últimas allanaron el camino para la variación del contraste mediante el intercambio de disolventes de H 2 O por D 2 O y métodos de deuteración específicos. Se observó que los estudios de dispersión en solución proporcionan, con una inversión mínima de tiempo y esfuerzo, conocimientos útiles sobre la estructura de los sistemas bioquímicos no cristalinos. Además, SAXS/SANS también hizo posible investigaciones en tiempo real de interacciones intermoleculares, incluido el ensamblaje y los cambios conformacionales a gran escala en ensamblajes macromoleculares .
La principal dificultad del SAS como método estructural es extraer la información estructural tridimensional del objeto a partir de los datos experimentales unidimensionales. En el pasado, sólo los parámetros generales de las partículas (por ejemplo, volumen, radio de giro) de las macromoléculas se determinaban directamente a partir de los datos experimentales, mientras que el análisis en términos de modelos tridimensionales se limitaba a cuerpos geométricos simples (por ejemplo, elipsoides, cilindros, etc.) o se realizaba sobre una base de ensayo y error ad hoc. La microscopía electrónica se utilizaba a menudo como una restricción en la construcción de modelos de consenso. En la década de 1980, el progreso en otros métodos estructurales condujo a una disminución del interés de los bioquímicos en los estudios SAS, que extraían conclusiones estructurales a partir de sólo un par de parámetros generales o se basaban en modelos de ensayo y error.
En la década de 1990 se produjo un gran avance en los métodos de análisis de datos SAXS/SANS, que abrió el camino para la modelización ab initio confiable de complejos macromoleculares, incluida la determinación detallada de la forma y la estructura del dominio y la aplicación de técnicas de refinamiento de cuerpos rígidos. Este progreso estuvo acompañado de nuevos avances en la instrumentación, lo que permitió lograr resoluciones temporales inferiores a ms en fuentes de SR de tercera generación en los estudios de plegamiento de proteínas y ácidos nucleicos. [1]
En 2005 se inició un proyecto de cuatro años de duración, Small - Angular X - Ray scattering Initiative for Europe (SAXIER), cuyo objetivo era combinar los métodos SAXS con otras técnicas analíticas y crear un software automatizado para analizar rápidamente grandes cantidades de datos. El proyecto creó una infraestructura SAXS europea unificada, utilizando los métodos más avanzados disponibles. [7]
En un experimento SAS de buena calidad, se miden varias soluciones con diferentes concentraciones de la macromolécula en investigación. Al extrapolar las curvas de dispersión medidas a concentraciones variables a una concentración cero, se puede obtener una curva de dispersión que representa una dilución infinita. Entonces, los efectos de la concentración no deberían afectar la curva de dispersión. El análisis de datos de la curva de dispersión extrapolada comienza con la inspección del inicio de la curva de dispersión en la región alrededor de s = 0. Si la región sigue la aproximación de Guinier (también conocida como ley de Guinier ), la muestra no está agregada . Entonces, la forma de la partícula en cuestión se puede determinar mediante varios métodos, algunos de los cuales se describen en la siguiente referencia. [1]
El primer paso suele ser calcular una transformada de Fourier de la curva de dispersión. La curva transformada se puede interpretar como una función de distribución de distancias dentro de una partícula. Esta transformación también ofrece la ventaja de regularizar los datos de entrada. [ cita requerida ]
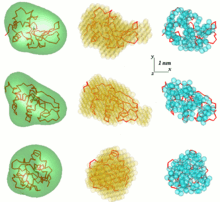
Un problema en el análisis de datos SAS es obtener una estructura tridimensional a partir de un patrón de dispersión unidimensional. Los datos SAS no implican una única solución. Muchas proteínas diferentes, por ejemplo, pueden tener la misma curva de dispersión. La reconstrucción de la estructura 3D puede dar como resultado una gran cantidad de modelos diferentes. Para evitar este problema, es necesario considerar una serie de simplificaciones.
Un enfoque adicional es combinar datos y modelos de dispersión de rayos X y neutrones de ángulo pequeño con el programa MONSA.
En el EMBL se han desarrollado intensamente programas informáticos de análisis SAS de libre acceso . En el primer enfoque general ab initio , una función de envolvente angular de la partícula r=F(ω) , donde ( r,ω ) son coordenadas esféricas, se describe mediante una serie de armónicos esféricos . La forma de baja resolución se define así mediante unos pocos parámetros (los coeficientes de esta serie) que se ajustan a los datos de dispersión. El enfoque se desarrolló e implementó aún más en el programa informático SASHA ( Small Angle Scattering Shape Determination ). [8] [9] Se demostró que, en determinadas circunstancias, se puede extraer una envolvente única de los datos de dispersión. Este método solo es aplicable a partículas globulares con formas relativamente simples y sin cavidades internas significativas. Para superar estas limitaciones, se desarrolló otro enfoque que utiliza diferentes tipos de búsquedas de Montecarlo. DALAI_GA es un programa elegante que toma una esfera con un diámetro igual al tamaño máximo de partícula Dmax, que se determina a partir de los datos de dispersión, y la llena con perlas. Cada perla pertenece a la partícula (índice=1) o al solvente (índice=0). La forma se describe así mediante la cadena binaria de longitud M. A partir de una cadena aleatoria, un algoritmo genético busca un modelo que se ajuste a los datos. En la búsqueda se imponen restricciones de compacidad y conectividad, implementadas en el programa DAMMIN . [10] [11] Si se conoce la simetría de la partícula, SASHA y DAMMIN pueden utilizarla como restricciones útiles. El procedimiento 'give-n-take' SAXS3D y el programa SASMODEL , basados en elipsoides interconectados, son ab initio aproximaciones de Monte Carlo sin limitación en el espacio de búsqueda. [6]
Un enfoque que utiliza un conjunto de residuos ficticios (DR) y recocido simulado para construir un modelo DR "compatible con la cadena" localmente dentro de una esfera de diámetro Dmax permite extraer más detalles de los datos SAXS. Este método se implementa en el programa GASBOR . [12] [13]
Los patrones de dispersión de soluciones de proteínas multidominio y complejos macromoleculares también se pueden ajustar utilizando modelos construidos a partir de estructuras de alta resolución ( RMN o rayos X ) de dominios individuales o subunidades, asumiendo que se conserva su estructura terciaria . Dependiendo de la complejidad del objeto, se emplean diferentes enfoques para la búsqueda global de la configuración óptima de subunidades que se ajuste a los datos experimentales.
Los modelos basados en Montecarlo contienen cientos o miles de parámetros, y se requiere precaución para evitar la sobreinterpretación. Un enfoque común es alinear un conjunto de modelos resultantes de ejecuciones de reconstrucción de forma independientes para obtener un modelo promedio que retenga las características más persistentes y posiblemente también más confiables (por ejemplo, utilizando el programa SUPCOMB ). [6] [14] [15]
Los aminoácidos de superficie desordenados (" bucles ") no se observan con frecuencia en los estudios de RMN y cristalográficos , y pueden faltar en los modelos informados. Dicho elemento desordenado contribuye a la intensidad de dispersión y sus ubicaciones probables se pueden encontrar fijando la parte conocida de la estructura y agregando las partes faltantes para ajustar el patrón SAS de la partícula completa. El enfoque de residuo ficticio se amplió y los algoritmos para agregar bucles o dominios faltantes se implementaron en el paquete de programas CREDO . [6]
Recientemente se han propuesto algunos métodos que utilizan los datos SAXS como restricciones. Los autores se propusieron mejorar los resultados de los métodos de reconocimiento de plegamiento [16] y de predicción de la estructura de proteínas de novo [17] . Los datos SAXS proporcionan la transformada de Fourier del histograma de distancias de pares atómicos (función de distribución de pares) para una proteína dada. Esto puede servir como una restricción estructural en los métodos utilizados para determinar el plegamiento conformacional nativo de la proteína. El enhebrado o reconocimiento de plegamiento supone que la estructura 3D es más conservada que la secuencia. Por lo tanto, secuencias muy divergentes pueden tener una estructura similar. Los métodos ab initio, por otro lado, desafían uno de los mayores problemas de la biología molecular, es decir, predecir el plegamiento de una proteína "desde cero", sin utilizar secuencias o estructuras homólogas. Utilizando el "filtro SAXS", los autores pudieron purificar significativamente el conjunto de modelos de proteínas de novo. [17] Esto se demostró además mediante búsquedas de homología de estructura . También se demostró que la combinación de puntuaciones SAXS con puntuaciones, utilizadas en métodos de enhebrado, mejora significativamente el rendimiento del reconocimiento de plegamiento. [16] En un ejemplo se demostró cómo se puede ensamblar la estructura terciaria aproximada de proteínas modulares a partir de estructuras de dominios de RMN de alta resolución, utilizando datos SAXS, confinando los grados de libertad de la traducción. [18] Otro ejemplo muestra cómo los datos SAXS se pueden combinar junto con RMN, cristalografía de rayos X y microscopía electrónica para reconstruir la estructura cuaternaria de proteínas multidominio. [19]
Recientemente se propuso un método elegante para abordar el problema de las proteínas intrínsecamente desordenadas o multidominio con enlaces flexibles . [20] Permite la coexistencia de diferentes conformaciones de una proteína, que juntas contribuyen al patrón de dispersión experimental promedio. Inicialmente, EOM (método de optimización de conjuntos) genera un grupo de modelos que cubren el espacio de configuración de la proteína. Luego se calcula la curva de dispersión para cada modelo. En el segundo paso, el programa selecciona subconjuntos de modelos de proteína. Se calcula la dispersión experimental promedio para cada subconjunto y se ajusta a los datos experimentales de SAXS. Si no se encuentra el mejor ajuste, los modelos se reorganizan entre diferentes subconjuntos y se realiza un nuevo cálculo de dispersión promedio y ajuste a los datos experimentales. Este método se ha probado en dos proteínas: lisozima desnaturalizada y proteína quinasa de Bruton . Dio algunos resultados interesantes y prometedores. [20]
Los recubrimientos de biomoléculas se pueden estudiar con dispersión de rayos X y neutrones de incidencia rasante. IsGISAXS ( dispersión de rayos X de ángulo pequeño de incidencia rasante ) es un programa de software dedicado a la simulación y análisis de GISAXS a partir de nanoestructuras. IsGISAXS solo abarca la dispersión por partículas de tamaño nanométrico, que están enterradas en una subsuperficie de matriz o soportadas sobre un sustrato o enterradas en una capa delgada sobre un sustrato. También se maneja el caso de los agujeros. La geometría se restringe a un plano de partículas. La sección transversal de dispersión se descompone en términos de función de interferencia y factor de forma de partícula . El énfasis se pone en la geometría de incidencia rasante que induce un "efecto de refracción del haz". El factor de forma de partícula se calcula dentro de la aproximación de onda distorsionada de Born (DWBA), comenzando como un estado no perturbado con interfaces agudas o con el perfil perpendicular real del índice de refracción . Existen varios tipos de formas geométricas simples con una descripción completa de las distribuciones de tamaño y forma en la aproximación de desacoplamiento (DA), en la aproximación monodispersa local (LMA) y también en la aproximación de correlación de tamaño-espaciamiento (SSCA). Se consideran tanto los sistemas desordenados de partículas definidos por su función de correlación de pares partícula-partícula como los cristales o paracristales bidimensionales. [21]