Las damascenonas son una serie de compuestos químicos estrechamente relacionados que son componentes de una variedad de aceites esenciales . Las damascenonas pertenecen a una familia de sustancias químicas conocidas como cetonas de rosa , que también incluye damasconas e iononas . La beta -damascenona contribuye de manera importante al aroma de las rosas, a pesar de su muy baja concentración, y es una importante fragancia química utilizada en perfumería. [1]
Las damascenonas se derivan de la degradación de los carotenoides . [2]
En 2008, se identificó (E)-β-damascenona como un odorante principal en el bourbon de Kentucky . [3]
La biosíntesis de β-damascenona comienza con la reacción del pirofosfato de farnesilo (FPP) y el pirofosfato de isopentenilo (IPP) para producir pirofosfato de geranilgeranilo (GGPP) Figura 1.
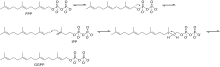
Las siguientes dos moléculas de GGPP se condensan juntas para producir fitoeno mediante la eliminación del difosfato y un desplazamiento de protones catalizado por la enzima fitoeno sintasa (PSY). Luego, el fitoeno pasa por una serie de reacciones de desaturación utilizando la enzima fitoeno desaturasa (PDS) para producir fitoflueno y luego ζ-caroteno . Se ha descubierto que otras enzimas catalizan esta reacción, incluidas CrtI y CrtP. [4] La siguiente serie de reacciones de desaturación es catalizada por la enzima ζ-caroteno desaturasa (ZDS) para producir neurosporeno seguido de licopeno . Otras enzimas que pueden catalizar esta reacción incluyen CtrI y CrtQ. A continuación, el licopeno pasa por dos reacciones de ciclación con el uso de la enzima licopeno β-ciclasa, que produce primero γ-caroteno , seguida de la segunda ciclación que produce β-caroteno , como se muestra en la Figura 2.
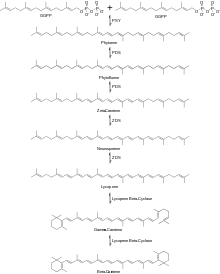
El mecanismo de ciclación del licopeno a β-caroteno se muestra en el Esquema 2.
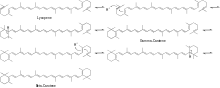
A continuación, el β-caroteno reacciona con el O2 y la enzima hidroxilasa del anillo de β-caroteno produciendo zeaxantina . [5] Luego, la zeaxantina reacciona con O2, NADPH (H+) y un grupo reducido de ferredoxina [hierro-azufre] en presencia de la enzima zeaxantina epoxidasa (ZE) para producir anteraxantina que reacciona de manera similar para producir violaxantina . Luego, la violaxantina reacciona con la enzima neoxantina sintasa para formar neoxantina, el principal precursor de la β-damascenona, como se muestra en la Figura 3.
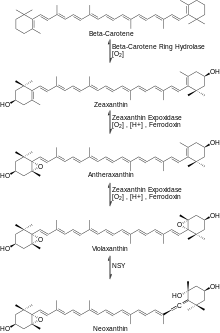
[6] Para generar β-damascenona a partir de neoxantina, se necesitan algunas modificaciones más. Primero, la neoxantina sufre una escisión oxidativa para crear la cetona del saltamontes. Luego, la cetona del saltamontes sufre una reducción para generar el triol alénico. En esta etapa, hay dos vías principales que el triol alénico puede seguir para producir el producto final. El triol alénico puede sufrir una reacción de deshidratación para generar el diol acetilénico o el diol alénico. Finalmente, una última reacción de deshidratación del diol acetilénico o del diol alénico produce el producto final β-damascenona como se muestra en la Figura 4.

[7] [8] El mecanismo propuesto para la conversión del triol alénico en diol acetilénico se muestra en el Esquema 3.
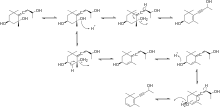
El mecanismo propuesto para la conversión del diol acetilénico en el producto final se muestra en el Esquema 4.

Este mecanismo se conoce como reordenamiento de Meyer-Schuster .