La esquistosomiasis , también conocida como fiebre del caracol , bilharzia y fiebre de Katayama , [1] [2] [9] es una enfermedad causada por gusanos planos parásitos llamados esquistosomas . [5] El tracto urinario o los intestinos pueden infectarse. [5] Los síntomas incluyen dolor abdominal , diarrea , heces con sangre o sangre en la orina . [5] Aquellos que han estado infectados durante mucho tiempo pueden experimentar daño hepático , insuficiencia renal , infertilidad o cáncer de vejiga . [5] En los niños, puede causar un crecimiento deficiente y dificultades de aprendizaje . [5]
La enfermedad se propaga por contacto con agua dulce contaminada con los parásitos. [5] Estos parásitos son liberados por caracoles de agua dulce infectados . [5] La enfermedad es especialmente común entre los niños en países subdesarrollados y en desarrollo, ya que es más probable que jueguen en agua contaminada. [5] La esquistosomiasis también es común entre las mujeres, que pueden tener una mayor exposición a través de las tareas diarias que involucran agua, como lavar la ropa y buscar agua. [10] Otros grupos de alto riesgo incluyen agricultores, pescadores y personas que usan agua sucia durante la vida diaria. [5] Pertenece al grupo de infecciones por helmintos . [11] El diagnóstico se realiza encontrando huevos del parásito en la orina o las heces de una persona. [5] También se puede confirmar encontrando anticuerpos contra la enfermedad en la sangre. [5]
Los métodos para prevenir la enfermedad incluyen mejorar el acceso al agua potable y reducir la cantidad de caracoles. [5] En áreas donde la enfermedad es común, el medicamento praziquantel puede administrarse una vez al año a todo el grupo. [5] Esto se hace para disminuir la cantidad de personas infectadas y, en consecuencia, la propagación de la enfermedad. [5] El praziquantel también es el tratamiento recomendado por la Organización Mundial de la Salud (OMS) para aquellos que se sabe que están infectados. [5]
La esquistosomiasis afectó a alrededor de 236,6 millones de personas en todo el mundo en 2019. [12] Se estima que entre 4.400 y 200.000 personas mueren a causa de ella cada año. [7] [8] La enfermedad se encuentra más comúnmente en África, Asia y América del Sur. [5] Alrededor de 700 millones de personas, en más de 70 países, viven en áreas donde la enfermedad es común. [7] [13] En los países tropicales, la esquistosomiasis ocupa el segundo lugar, después de la malaria, entre las enfermedades parasitarias con mayor impacto económico. [14] La esquistosomiasis está catalogada como una enfermedad tropical desatendida . [15]


Muchas personas no presentan síntomas. Si aparecen, suelen tardar entre 4 y 6 semanas desde el momento de la infección. El primer síntoma de la enfermedad puede ser una sensación general de malestar . En las 12 horas siguientes a la infección, la persona puede quejarse de una sensación de hormigueo o una erupción leve , comúnmente denominada " prurito del nadador ", debido a la irritación en el punto de entrada. La erupción que puede desarrollarse puede imitar la sarna y otros tipos de erupciones.
Las manifestaciones de la infección esquistosómica varían con el tiempo a medida que la forma larvaria del parásito, o cercarias , y más tarde los gusanos adultos y sus huevos, migran a través del cuerpo. [16] Si los huevos migran al cerebro o la médula espinal, es posible que se produzcan convulsiones, parálisis o inflamación de la médula espinal. [17]
Las manifestaciones de la infección aguda por esquistosoma incluyen dermatitis por cercarias (que dura horas o días) y esquistosomiasis sistémica aguda (de 2 a 8 semanas), que puede incluir síntomas de fiebre , mialgia , tos , diarrea sanguinolenta , escalofríos o agrandamiento de los ganglios linfáticos . Algunos pacientes también pueden experimentar disnea e hipoxia asociadas con el desarrollo de infiltrados pulmonares . [18]
La primera reacción potencial es una erupción maculopapular con picazón que resulta de la penetración de las cercarias en la piel dentro de las primeras 12 horas a días de la penetración de la piel por las cercarias. [19] La primera vez que una persona no sensibilizada se expone, las erupciones suelen ser leves con una sensación de hormigueo asociada que desaparece rápidamente por sí sola, ya que se trata de un tipo de reacción de hipersensibilidad. [19] [ aclaración necesaria ] En personas sensibilizadas que han sido infectadas previamente, la erupción puede convertirse en lesiones rojas, elevadas y con picazón ( pápulas ) y algunas se convierten en lesiones llenas de líquido ( vesículas ). [19] Las infecciones previas con cercarias provocan un desarrollo más rápido y una peor presentación de la dermatitis debido a la respuesta inmunitaria más fuerte. [20] Las protuberancias redondas suelen tener de uno a tres centímetros de diámetro. [21] Debido a que las personas que viven en áreas afectadas a menudo han estado expuestas repetidamente, las reacciones agudas son más comunes en turistas y migrantes. [22] La erupción puede aparecer entre las primeras horas y una semana después de la exposición, y normalmente se resuelve por sí sola en alrededor de 7 a 10 días. [21] [19] En el caso de la esquistosomiasis humana, un tipo similar de dermatitis llamada "prurito del nadador" también puede ser causada por cercarias de trematodos animales que a menudo infectan a las aves. [16] [19] [23] La dermatitis cercarial no es contagiosa y no se puede transmitir de persona a persona. [24]
Los síntomas pueden incluir:
Rascarse la erupción puede provocar una infección bacteriana secundaria de la piel, por lo que es importante abstenerse de rascarse. [24] Algunos tratamientos comunes para la picazón incluyen crema con corticosteroides, loción antipicazón, aplicación de compresas frías sobre la erupción, baños en sales de Epsom o bicarbonato de sodio y, en casos de picazón severa, cremas y lociones de venta con receta. [24] Los antihistamínicos orales también pueden ayudar a aliviar la picazón. [19]
La esquistosomiasis aguda (fiebre de Katayama) puede ocurrir semanas o meses (alrededor de 2 a 8 semanas) [25] después de la infección inicial como una reacción sistémica contra las esquistosómulas migratorias a medida que pasan a través del torrente sanguíneo a través de los pulmones hasta el hígado y también contra los antígenos de los huevos. [16] De manera similar a la picazón del nadador, la fiebre de Katayama se observa más comúnmente en personas con su primera infección, como migrantes y turistas, y está asociada con una infección grave. [26] Sin embargo, se observa en residentes nativos de China infectados con S. japonicum . [27] S. japonicum puede causar esquistosomiasis aguda en la población infectada crónicamente, y puede conducir a una forma más grave de esquistosomiasis aguda. [19]
Los síntomas pueden incluir:
La esquistosomiasis aguda generalmente se resuelve por sí sola en 2 a 8 semanas en la mayoría de los casos, [25] pero una pequeña proporción de personas presenta pérdida de peso persistente, diarrea, dolor abdominal difuso y sarpullido. [16]
Las complicaciones pueden incluir:
Los efectos secundarios neurológicos pueden incluir:
Los efectos secundarios cardíacos pueden incluir:
El tratamiento puede incluir:
En las enfermedades de larga data, los gusanos adultos ponen huevos que pueden causar reacciones inflamatorias . Los huevos secretan enzimas proteolíticas que los ayudan a migrar a la vejiga y los intestinos para ser eliminados. Las enzimas también causan una reacción inflamatoria eosinofílica cuando los huevos quedan atrapados en los tejidos o embolizan hacia el hígado, el bazo, los pulmones o el cerebro . [16] Las manifestaciones a largo plazo dependen de la especie de esquistosoma, ya que los gusanos adultos de diferentes especies migran a diferentes áreas. [29] Muchas infecciones son levemente sintomáticas, y la anemia y la desnutrición son comunes en las áreas endémicas. [30]
Los gusanos de S. mansoni y S. japonicum migran a las venas del tracto gastrointestinal y el hígado. [23] Los huevos en la pared intestinal pueden provocar dolor, sangre en las heces y diarrea (especialmente en niños). [23] La enfermedad grave puede provocar un estrechamiento del colon o del recto . [21]
En la esquistosomiasis intestinal, los huevos se alojan en la pared intestinal durante su migración desde las vénulas mesentéricas hasta el lumen intestinal, y los huevos atrapados causan una reacción del sistema inmunológico llamada reacción granulomatosa . [31] Afectan principalmente al intestino grueso y al recto, y la afectación del intestino delgado es más rara. [19] Esta respuesta inmune puede provocar obstrucción del colon y pérdida de sangre. El individuo infectado puede tener lo que parece una barriga abultada. Existe una fuerte correlación entre la morbilidad de la esquistosomiasis intestinal y la intensidad de la infección. [19] En casos de infecciones leves, los síntomas pueden ser leves y pasar desapercibidos. [26] Las especies más comunes que causan esquistosomiasis intestinal son S. mansoni y S. japonicum , sin embargo, S. mekongi y S. intercalatum también pueden causar esta enfermedad. [26]
Los síntomas pueden incluir:
Las complicaciones pueden incluir:
Aproximadamente entre el 10 y el 50% de las personas que viven en regiones endémicas de S. mansoni y S. japonicum desarrollan esquistosomiasis intestinal. [19] La infección por S. mansoni se superpone epidemiológicamente con la alta prevalencia del VIH en el África subsahariana, donde la esquistosomiasis gastrointestinal se ha vinculado con una mayor transmisión del VIH. [32]
Los huevos también migran al hígado, lo que provoca fibrosis en el 4 al 8% de las personas con infección crónica, principalmente aquellas con infección grave a largo plazo. [23]
Los huevos pueden alojarse en el hígado , [31] lo que provoca hipertensión portal , esplenomegalia , acumulación de líquido en el abdomen y dilataciones potencialmente mortales o áreas hinchadas en el esófago o el tracto gastrointestinal que pueden desgarrarse y sangrar profusamente ( varices esofágicas ). Esta afección se puede separar en dos fases distintas: esquistosomiasis hepática inflamatoria (reacción inflamatoria temprana) y esquistosomiasis hepática crónica. Las especies más comunes que causan esta afección son S. mansoni , S. japonicum y S. mekongi . [ cita requerida ]
Esquistosomiasis hepática inflamatoria

Esquistosomiasis hepática crónica (fibrótica)
La hipertensión portal secundaria a la esquistosomiasis hepatoesplénica puede provocar que se desarrollen conexiones vasculares entre la circulación portal (hígado e intestino) y la circulación sistémica, lo que crea una vía para que los huevos y los gusanos viajen a los pulmones. [19] Los huevos pueden depositarse alrededor de los lechos capilares alveolares y causan inflamación granulomatosa de las arteriolas pulmonares seguida de fibrosis. [19] Esto conduce a presión arterial alta en el sistema de circulación pulmonar ( hipertensión pulmonar ), aumento de la presión en el corazón derecho, agrandamiento de la arteria pulmonar y las aurículas derechas y engrosamiento de la pared del ventrículo derecho . [19]
Los síntomas de la hipertensión pulmonar pueden incluir:

Los gusanos de S. haematobium migran a las venas alrededor de la vejiga y los uréteres donde se reproducen. [29] [33] S. haematobium puede producir hasta 3000 huevos por día, estos huevos migran de las venas a la vejiga y los lúmenes del uréter, pero hasta el 50 por ciento de ellos pueden quedar atrapados en los tejidos circundantes causando inflamación granulomatosa, formación de pólipos y ulceración de los tejidos de la vejiga, el uréter y el tracto genital. [19] [33] Esto puede provocar sangre en la orina de 10 a 12 semanas después de la infección. [16] [21] Con el tiempo, la fibrosis puede provocar obstrucción del tracto urinario, hidronefrosis e insuficiencia renal . [16] [21] El diagnóstico y la mortalidad por cáncer de vejiga generalmente son elevados en las áreas afectadas; los esfuerzos para controlar la esquistosomiasis en Egipto han llevado a disminuciones en la tasa de cáncer de vejiga. [21] [34] El riesgo de cáncer de vejiga parece ser especialmente alto en fumadores varones, quizás debido a la irritación crónica del revestimiento de la vejiga que permite que esté expuesta a carcinógenos del tabaquismo. [23] [29]
En las mujeres, la enfermedad genitourinaria también puede incluir lesiones genitales que pueden llevar a mayores tasas de transmisión del VIH . [21] [32] [35] Si las lesiones afectan las trompas de Falopio o los ovarios, pueden llevar a infertilidad. [19] Si los órganos reproductivos en los hombres están afectados, podría haber sangre en el esperma. [19]
Los síntomas urinarios pueden incluir:
Los síntomas genitales pueden incluir:
La función renal no se ve afectada en muchos casos y las lesiones son reversibles con el tratamiento adecuado para eliminar los gusanos. [19]
Las lesiones del sistema nervioso central ocurren ocasionalmente debido a la inflamación y el desarrollo de granulomas alrededor de los huevos o gusanos que encuentran su camino hacia el cerebro o la médula espinal a través del sistema circulatorio, y potencialmente pueden desarrollar cicatrices irreversibles sin el tratamiento adecuado. [19] La enfermedad granulomatosa cerebral puede ser causada por huevos de S. japonicum en el cerebro durante la fase aguda y crónica de la enfermedad. [26] Las comunidades en China afectadas por S. japonicum tienen tasas de convulsiones ocho veces más altas que la línea de base. [23] La infección granulomatosa cerebral también puede ser causada por S. mansoni . Deposición de huevos in situ después de la migración anómala del gusano adulto, que parece ser el único mecanismo por el cual Schistosoma puede llegar al sistema nervioso central en personas con esquistosomiasis. [36] La acción destructora sobre el tejido nervioso y el efecto de masa producido por un gran número de huevos rodeados de múltiples y grandes granulomas en áreas circunscritas del cerebro caracterizan la forma pseudotumoral de la neuroesquistosomiasis y son responsables de la aparición de manifestaciones clínicas: cefalea, hemiparesia, alteración del estado mental, vértigo, anomalías visuales, convulsiones y ataxia. De manera similar, las lesiones granulomatosas de los huevos de S. mansoni y S. haematobium en la médula espinal pueden conducir a mielitis transversa (inflamación de la médula espinal) con paraplejía flácida . [37] En casos con esquistosomiasis hepatoesplénica y urinaria avanzada, la embolización continua de huevos desde el sistema mesentérico portal ( S. mansoni ) o sistema mesentérico-pélvico portal ( S. haematobium ) al cerebro, resulta en una distribución dispersa de huevos asociada con escasa reacción inflamatoria periovular, generalmente con poca o ninguna significación clínica. [36]
Los síntomas de la inflamación de la médula espinal ( mielitis transversa ) pueden incluir:
Los síntomas de la infección granulomatosa cerebral pueden incluir:
Los corticosteroides se utilizan para prevenir el daño neurológico permanente causado por la respuesta inflamatoria a los óvulos y, a veces, se necesitan anticonvulsivos para detener las convulsiones. [19] Los corticosteroides se administran antes de la administración de praziquantel. [19]
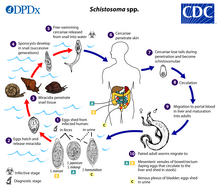
Los individuos infectados con Schistosoma liberan huevos en el agua a través de su materia fecal u orina. Una colección de muestras de heces bajo un microscopio mostrará los huevos de S. intercalatum , S. mansori y S. japonicum . Observar una muestra de orina bajo un microscopio revelaría los huevos de S. haematobium y, raramente, los huevos de S. mansori. [38] Después de que las larvas eclosionan de estos huevos, las larvas infectan un tipo muy específico de caracol de agua dulce. Por ejemplo, en S. haematobium y S. intercalatum son caracoles del género Bulinus , en S. mansoni es Biomphalaria y en S. japonicum es Oncomelania . [39] Las larvas de esquistosoma pasan por la siguiente fase de sus ciclos de vida en estos caracoles, pasando su tiempo reproduciéndose y desarrollándose. Una vez que se ha completado este paso, el parásito abandona el caracol y entra en la columna de agua. El parásito puede vivir en el agua durante sólo 48 horas sin un huésped mamífero. Una vez que ha encontrado un huésped, el gusano entra en sus vasos sanguíneos. Durante varias semanas, el gusano permanece en los vasos, continuando su desarrollo hasta su fase adulta. Cuando alcanza la madurez, se produce el apareamiento y se producen huevos. Los huevos entran en la vejiga/intestino y se excretan a través de la orina y las heces y el proceso se repite. Si los huevos no se excretan, pueden incrustarse en los tejidos corporales y causar una variedad de problemas, como reacciones inmunológicas y daño a los órganos. [12] Si bien la transmisión generalmente ocurre solo en países donde los caracoles de agua dulce son nativos, se informó de un caso en Alemania en el que un hombre contrajo esquistosomiasis a partir de un caracol infectado en su acuario. [40]
Los humanos entran en contacto con larvas del parásito esquistosoma cuando entran en agua contaminada mientras se bañan, juegan, nadan, lavan, pescan o caminan por el agua. [41] [42] [38]

Las etapas del ciclo de vida: [43]
Los esquistosomas pueden vivir un promedio de 3 a 5 años, y los huevos pueden sobrevivir durante más de 30 años después de la infección. [19]
La esquistosomiasis también es una preocupación en la cría de ganado [44] y ratones . [45] La O-metil-treonina es débilmente efectiva en la esquistosomiasis del ratón, pero no se utiliza. [45]
La etapa infecciosa comienza cuando la forma larvaria de natación libre del esquistosoma, las cercarias, penetran la piel humana usando sus ventosas, enzimas proteolíticas y movimientos de la cola; las cercarias se transforman en esquistosómulas al perder su cola y posteriormente viajan al corazón y los pulmones a través del sistema venoso hasta que finalmente llegan al hígado donde madurarán hasta la forma adulta. [43] [19] Las enfermedades causadas por los esquistosomas se caracterizan en esquistosomiasis aguda y esquistosomiasis crónica, y pueden variar dependiendo de la especie de esquistosoma. [26]
Infección aguda
Infección crónica
Las manifestaciones clínicas de la infección crónica son causadas principalmente por la reacción inmune al atrapamiento de los huevos dentro de los tejidos, lo que resulta en la formación de granulomas e inflamación crónica. [26] Los gusanos adultos viven juntos en parejas (un macho y una hembra), se reproducen sexualmente y ponen huevos en las venas alrededor de los intestinos y la vejiga, dependiendo de la especie, y estos huevos pueden romper la pared de las venas para escapar a los tejidos circundantes. [46] Los huevos se abren camino a través de los tejidos hasta el lumen intestinal o de la vejiga con la ayuda de enzimas proteolíticas, sin embargo, una gran cantidad de huevos no pueden terminar su viaje y permanecen atrapados dentro de los tejidos donde pueden provocar una respuesta inmune. [26] Los miracidios en estos huevos pueden liberar antígenos que estimulan una respuesta inmune inflamatoria. [26] Los miracidios dentro de los huevos viven alrededor de 6 a 8 semanas antes de morir y dejar de liberar los antígenos. [26] La respuesta granulomatosa es una respuesta inmune celular mediada por células T CD4 + , neutrófilos, eosinófilos, linfocitos, macrófagos y monocitos, y esta respuesta inflamatoria crónica provocada por los huevos puede causar fibrosis, destrucción de tejido y nódulos de granuloma que alteran las funciones de los órganos involucrados. [26] [33] La respuesta de las células auxiliares Th1 es prominente liberando citocinas como IFN -γ durante las primeras fases de la infección, y pasa a una respuesta Th2 que conduce a un aumento en el nivel de IgE, IL-4 y eosinófilos a medida que progresa la producción de huevos. [19] En las infecciones crónicas, la respuesta Th2 cambia al aumento del nivel de IL-10, IL-13 e IgG4, lo que revierte la progresión de los granulomas y conduce a la deposición de colágeno en los sitios de los granulomas. [19] Los síntomas clínicos específicos y la gravedad de la enfermedad que esto provoca dependen del tipo de infección por esquistosoma, la duración de la infección, el número de huevos y el órgano en el que se depositan los huevos. [26] La cantidad de huevos atrapados en los tejidos seguirá aumentando si no se eliminan los esquistosomas. [26]

_histopathology.JPG/440px-Schistosoma_japonicum_(3)_histopathology.JPG)
El diagnóstico de la infección se confirma mediante la identificación de huevos en las heces. Los huevos de S. mansoni miden aproximadamente 140 por 60 μm y tienen una espina lateral. El diagnóstico se mejora mediante el uso de la técnica de Kato-Katz , una técnica de examen semicuantitativo de heces. Otros métodos que se pueden utilizar son el ensayo inmunoabsorbente ligado a enzimas , la prueba de precipitación circunvalar y el inmunoensayo de fosfatasa alcalina. [47]
La identificación microscópica de huevos en heces u orina es el método más práctico para el diagnóstico. El examen de heces debe realizarse cuando se sospecha una infección por S. mansoni o S. japonicum , y el examen de orina si se sospecha S. haematobium . Los huevos pueden estar presentes en las heces en infecciones por todas las especies de Schistosoma . El examen puede realizarse en un frotis simple (1 a 2 mg de materia fecal). Debido a que los huevos pueden expulsarse de manera intermitente o en pequeñas cantidades, su detección se mejora mediante exámenes repetidos o procedimientos de concentración, o ambos. Además, para estudios de campo y propósitos de investigación, la producción de huevos puede cuantificarse utilizando la técnica de Kato-Katz (20 a 50 mg de materia fecal) o la técnica de Ritchie. Se pueden encontrar huevos en la orina en infecciones por S. haematobium (hora recomendada para la recolección: entre el mediodía y las 3 p.m.) y con S. japonicum . La cuantificación es posible mediante la filtración a través de una membrana filtrante de nucleóporos de un volumen estándar de orina seguida de un recuento de huevos en la membrana. La biopsia de tejido (biopsia rectal para todas las especies y biopsia de la vejiga para S. haematobium ) puede demostrar la presencia de huevos cuando los exámenes de heces u orina son negativos. [48]
La identificación de microhematuria en orina mediante tiras reactivas de orina es más precisa que las pruebas de antígeno circulante en la identificación de esquistosomiasis activa en áreas endémicas. [49]
La detección de anticuerpos puede ser útil para indicar una infección por esquistosoma en personas que han viajado a zonas donde la esquistosomiasis es común y en quienes no se puede demostrar la presencia de huevos en muestras fecales u urinarias. La sensibilidad y especificidad de las pruebas varían ampliamente entre las muchas pruebas reportadas para el diagnóstico serológico de la esquistosomiasis y dependen tanto del tipo de preparación de antígenos utilizados (crudo, purificado, gusano adulto, huevo, cercaria) como del procedimiento de prueba. [48]
En los Centros para el Control y la Prevención de Enfermedades de los Estados Unidos , se utiliza una combinación de pruebas con antígenos purificados de gusanos adultos para la detección de anticuerpos. Todas las muestras de suero se analizan mediante FAST-ELISA utilizando el antígeno microsomal adulto de S. mansoni . Una reacción positiva (superior a 9 unidades/μL de suero) indica infección por especies de Schistosoma . La sensibilidad para la infección por S. mansoni es del 99%, del 95% para la infección por S. haematobium y inferior al 50% para la infección por S. japonicum . La especificidad de este ensayo para detectar la infección por esquistosoma es del 99%. Debido a que la sensibilidad de la prueba con FAST-ELISA se reduce para especies distintas de S. mansoni , también se analizan inmunotransferencias de la especie apropiada para el historial de viajes de la persona para garantizar la detección de infecciones por S. haematobium y S. japonicum . Las inmunotransferencias con antígenos microsomales de gusanos adultos son específicas de la especie, por lo que una reacción positiva indica la especie infectante. La presencia de anticuerpos es indicativa únicamente de una infección por esquistosomas en algún momento y no puede correlacionarse con el estado clínico, la carga de gusanos, la producción de huevos o el pronóstico. El lugar al que haya viajado una persona puede ayudar a determinar qué especie de Schistosoma debe detectarse mediante inmunotransferencia. [48]
En 2005, un equipo dirigido por Russell Stothard del Museo de Historia Natural de Londres, en colaboración con la Iniciativa de Control de la Esquistosomiasis de Londres, llevó a cabo en Uganda una evaluación de campo de un nuevo microscopio portátil para el diagnóstico de la esquistosomiasis intestinal. [50]
Las pruebas basadas en la reacción en cadena de la polimerasa (PCR) son precisas y rápidas. [51] Sin embargo, no se utilizan con frecuencia en países donde la enfermedad es común debido al costo del equipo y la experiencia técnica requerida para realizar las pruebas. [51] El uso de un microscopio para detectar huevos cuesta alrededor de US$0,40 por prueba, mientras que la PCR cuesta alrededor de US$7 por prueba a partir de 2019. [52] Se está estudiando la amplificación isotérmica mediada por bucle, ya que es más económica. [51] La prueba LAMP no está disponible comercialmente a partir de 2019. [52]
La detección de S. haematobium en la comunidad se puede realizar utilizando una tira reactiva de orina para verificar si hay hematuria, y la prueba de guayacol en heces se puede utilizar para detectar sangre en las heces en busca de una posible infección por S. mansoni y S. japonicum . [19] En el caso de viajeros o migrantes en regiones endémicas, se puede utilizar un hemograma completo con fórmula leucocitaria para identificar un nivel alto de eosinófilos en la sangre, que podría ser indicativo de una infección aguda. [19] Se puede solicitar una prueba de función hepática si se sospecha esquistosomiasis hepatoesplénica, y un panel de pruebas de hepatitis posterior si la prueba de función hepática es anormal. [19]
Como la mayoría de las infecciones parasitarias, la esquistosomiasis suele causar una eosinofilia significativa que puede identificarse en un hemograma completo con diagnóstico diferencial. [18]
Si otros métodos de diagnóstico de esquistosomiasis no han logrado detectar la infección, pero todavía hay una alta sospecha de esquistosomiasis, se puede obtener una biopsia de tejido del recto, la vejiga y el hígado para buscar huevos de esquistosoma dentro de las muestras de tejido. [19] [26]
Las modalidades de diagnóstico por imágenes, como rayos X , ultrasonidos , tomografía computarizada (TC) y resonancia magnética (RM) , se pueden utilizar para evaluar la gravedad de la esquistosomiasis y los daños en los órganos infectados. [53] Por ejemplo, los rayos X y las tomografías computarizadas del tórax se pueden utilizar para detectar lesiones en los pulmones por esquistosomiasis pulmonar, y la radiografía pélvica puede revelar calcificación de la vejiga en la esquistosomiasis urinaria crónica. [53] La ecografía se puede utilizar para buscar anomalías en el hígado y el bazo en la esquistosomiasis hepatoesplénica, y la tomografía computarizada del hígado es una buena herramienta para buscar calcificación en el hígado asociada con la infección por S. japonicum . [53] La tomografía computarizada también se puede utilizar para evaluar los daños de la infección por esquistosomiasis en el sistema intestinal, urogenital y nervioso central. [53] La resonancia magnética se utiliza para evaluar la esquistosomiasis del sistema nervioso central, el hígado y los genitales. [53]
En casos raros se han utilizado exploraciones PET/CT que identifican tejidos con mayor actividad metabólica para ayudar a diagnosticar la esquistosomiasis. [53] Esto se debe al alto nivel de inflamación causado por los huevos esquistosómicos, que aumenta la tasa metabólica de los tejidos circundantes. [53]

Muchos países están trabajando para erradicar la enfermedad. La Organización Mundial de la Salud está promoviendo estos esfuerzos. En algunos casos, la urbanización, la contaminación y la consiguiente destrucción del hábitat de los caracoles han reducido la exposición, con una consiguiente disminución de nuevas infecciones. La eliminación de las poblaciones de caracoles mediante molusquicidas se había intentado en el pasado para prevenir la esquistosomiasis, pero era un proceso costoso que a menudo solo reducía, pero no eliminaba, la población de caracoles. [19] El fármaco praziquantel se utiliza para la prevención en poblaciones de alto riesgo que viven en zonas donde la enfermedad es común. [54] Los Centros para el Control y la Prevención de Enfermedades recomiendan evitar beber o entrar en contacto con agua contaminada en zonas donde la esquistosomiasis es común. [55]
Una revisión de 2014 encontró evidencia tentativa de que aumentar el acceso al agua potable y al saneamiento reduce la infección por esquistosoma. [56]
Otras medidas preventivas importantes incluyen la educación sobre higiene que conduzca a cambios de comportamiento y la ingeniería sanitaria para garantizar un suministro de agua segura. [19]
Para el control de la esquistosomiasis, la Organización Mundial de la Salud recomienda la administración preventiva de antihelmínticos, que es el tratamiento de toda la población afectada y el tratamiento periódico de todos los grupos con alto riesgo de adquirir esquistosomiasis mediante el uso de Praziquantel . [12] En 2019, el 44,5% de las personas con esquistosomiasis fueron tratadas a nivel mundial y el 67,2% de los niños en edad escolar que necesitaban quimioterapia preventiva recibieron tratamiento. [12]
Durante muchos años, desde la década de 1950 en adelante, se construyeron grandes represas y sistemas de irrigación, lo que provocó un aumento masivo de las infecciones transmitidas por el agua por esquistosomiasis. Las especificaciones detalladas establecidas en varios documentos de las Naciones Unidas desde la década de 1950 podrían haber minimizado este problema. Los esquemas de irrigación pueden diseñarse para dificultar que los caracoles colonicen el agua y para reducir el contacto con la población local. [57] Aunque las directrices sobre cómo diseñar estos esquemas para minimizar la propagación de la enfermedad se habían publicado años antes, los diseñadores no las conocían. [58] Las represas parecen haber reducido la población del gran camarón migratorio Macrobrachium , que se alimenta de caracoles. Después de la construcción de catorce grandes represas, se produjeron mayores aumentos de esquistosomiasis en los hábitats históricos de los camarones nativos que en otras áreas. Además, en la presa Diama de 1986 en el río Senegal , la restauración de camarones aguas arriba de la presa redujo tanto la densidad de caracoles como la tasa de reinfección por esquistosomiasis humana. [59] [60]
En China, la estrategia nacional para el control de la esquistosomiasis ha cambiado tres veces desde que se inició por primera vez: estrategia de control de la transmisión (desde mediados de la década de 1950 hasta principios de la década de 1980), estrategia de control de la morbilidad (desde mediados de la década de 1980 hasta 2003) y la "nueva estrategia integrada" (2004 hasta la actualidad). La estrategia de control de la morbilidad se centró en la quimioterapia sincrónica para humanos y bovinos y la nueva estrategia desarrollada en 2004 interviene en la vía de transmisión de la esquistosomiasis, incluyendo principalmente el reemplazo de bovinos por máquinas, la prohibición del pastoreo de ganado en los pastizales, la mejora del saneamiento, la instalación de contenedores de materia fecal en los barcos, la terapia farmacológica con praziquantel, el control de caracoles y la educación sanitaria. Una revisión de 2018 encontró que la "nueva estrategia integrada" fue altamente efectiva para reducir la tasa de infección por S. japonicum tanto en humanos como en los caracoles huéspedes intermediarios y redujo el riesgo de infección entre 3 y 4 veces en relación con la estrategia convencional. [61]
.jpg/440px-Medical_Civic_Action_Program_in_Shinile_Woreda,_Ethiopia,_2010_(5119873865).jpg)
Existen dos fármacos, praziquantel y oxamniquina , para el tratamiento de la esquistosomiasis. [62] Se consideran equivalentes en relación con la eficacia contra S. mansoni y la seguridad. [63] Debido al menor coste por tratamiento del praziquantel y la falta de eficacia de la oxaminiquina contra la forma urogenital de la enfermedad causada por S. haematobium , en general el praziquantel se considera la primera opción de tratamiento. [64] El praziquantel se puede utilizar de forma segura en mujeres embarazadas y niños pequeños. [26] El objetivo del tratamiento es curar la enfermedad y prevenir la evolución de la forma aguda a la crónica de la enfermedad. Todos los casos de sospecha de esquistosomiasis deben tratarse independientemente de la presentación porque el parásito adulto puede vivir en el huésped durante años. [65]
La esquistosomiasis se puede tratar tomando por vía oral una dosis única del medicamento praziquantel anualmente. [66]
El praziquantel sólo elimina los esquistosomas adultos, pero no es eficaz para matar los huevos y los gusanos inmaduros. [19] Los huevos vivos pueden ser excretados por los individuos infectados durante semanas después del tratamiento con praziquantel. [19] Los gusanos inmaduros pueden sobrevivir y crecer hasta convertirse en esquistosomas adultos después de la terapia con praziquantel. [19] Por lo tanto, es importante realizar pruebas repetidas de esquistosomiasis en heces y/o orina alrededor de 4 a 6 semanas después de la terapia con praziquantel. [19] El tratamiento con praziquantel puede repetirse para asegurar la eliminación completa del parásito. [19]
La OMS ha elaborado directrices para el tratamiento comunitario basándose en el impacto que tiene la enfermedad en los niños de las aldeas en las que es común: [66]
Otros tratamientos posibles incluyen una combinación de praziquantel con metrifonato , artesunato o mefloquina . [67] Una revisión Cochrane encontró evidencia tentativa de que cuando se usa solo, el metrifonato es tan efectivo como el praziquantel. [67] La mefloquina, que se ha usado previamente para tratar y prevenir la malaria, fue reconocida en 2008-2009 como efectiva contra los esquistosomas. [68]
Históricamente, el tartrato de antimonio y potasio siguió siendo el tratamiento de elección para la esquistosomiasis hasta el desarrollo del praziquantel en la década de 1980. [69]
Monitoreo posterior al tratamiento La osteopontina (OPN) es una herramienta prometedora para monitorear la eficacia del praziquantel y la regresión de la fibrosis posterior al tratamiento, ya que la expresión de (OPN) está modulada por los antígenos de los huevos de S. mansoni y sus niveles se correlacionan con la gravedad de la fibrosis por esquistosomiasis y la hipertensión portal en ratones y humanos. La farmacoterapia con praziquantel reduce los niveles sistémicos de OPN y el contenido de colágeno hepático en ratones. [70]



La enfermedad se encuentra en países tropicales de África, el Caribe , el este de Sudamérica, el sudeste asiático y Oriente Medio . S. mansoni se encuentra en partes de Sudamérica y el Caribe, África y Oriente Medio; S. haematobium en África y Oriente Medio; y S. japonicum en el Lejano Oriente . S. mekongi y S. intercalatum se encuentran localmente en el sudeste asiático y el centro de África occidental , respectivamente. [ cita requerida ]
La enfermedad es endémica en unos 75 países en desarrollo y afecta principalmente a personas que viven en zonas rurales agrícolas y periurbanas. [71] [72] [41]
En 2010, aproximadamente 238 millones de personas se infectaron con esquistosomiasis, el 85 por ciento de las cuales viven en África. [73] Una estimación anterior de 2006 había situado la cifra en 200 millones de personas infectadas. [74] Según el último registro de la OMS, 236,6 millones de personas se infectaron en 2019. [12] En muchas de las zonas afectadas, la esquistosomiasis infecta a una gran proporción de niños menores de 14 años. Se estima que entre 600 y 700 millones de personas en todo el mundo corren el riesgo de contraer la enfermedad porque viven en países donde el organismo es común. [7] [72] En 2012, 249 millones de personas necesitaban tratamiento para prevenir la enfermedad. [75] Esto probablemente la convierte en la infección parasitaria más común, seguida de la malaria, y causó alrededor de 207 millones de casos en 2013. [72] [76]
S. haematobium , el agente infeccioso responsable de la esquistosomiasis urogenital, infecta a más de 112 millones de personas anualmente solo en África subsahariana. [77] Es responsable de 32 millones de casos de disuria , 10 millones de casos de hidronefrosis y 150.000 muertes por insuficiencia renal anualmente, lo que convierte a S. haematobium en el esquistosoma más mortal del mundo. [77]
Las estimaciones sobre el número de muertes varían. A nivel mundial, el Estudio de la Carga Mundial de Enfermedades publicado en 2010 estimó 12.000 muertes directas [78], mientras que la OMS en 2014 estimó más de 200.000 muertes anuales relacionadas con la esquistosomiasis. [5] [7] Otros 20 millones sufren graves consecuencias a causa de la enfermedad. [79] Es la más mortal de las enfermedades tropicales desatendidas. [72]
La evidencia más antigua de esquistosomiasis se remonta a más de 6.000 años atrás. Estudios realizados en restos óseos humanos encontrados en el norte de Siria (5800–4000 a. C.) demostraron evidencia de un esquistosoma espinoso terminal del sedimento pélvico de los restos óseos. Aunque esta evidencia proviene del Medio Oriente, se ha sugerido que la "cuna" de los esquistosomas se encuentra en la región de los Grandes Lagos africanos , un área en la que tanto los parásitos como sus huéspedes intermediarios están en un estado activo de evolución. Posteriormente, se cree que la esquistosomiasis se extendió a Egipto como resultado de la importación de monos y esclavos durante el reinado de la quinta dinastía de los faraones (ca. 2494–2345 a. C.). [80]
La esquistosomiasis se conoce como bilharzia o bilharziosis en muchos países, en honor al médico alemán Theodor Bilharz , quien describió por primera vez la causa de la esquistosomiasis urinaria en 1851. [81] [82]
El primer médico que describió el ciclo completo de la enfermedad fue el parasitólogo brasileño Pirajá da Silva en 1908. [83] [84] El primer caso conocido de infección fue descubierto en 2014, perteneciente a un niño que vivió hace 6.200 años. [85]
La enfermedad era una causa común de muerte para los egipcios en el período grecorromano . [86]
En 2016, más de 200 millones de personas necesitaron tratamiento, pero solo 88 millones de personas recibieron tratamiento para la esquistosomiasis. [87]
La esquistosomiasis recibe su nombre del género de gusanos planos parásitos Schistosoma , un término que significa "cuerpo dividido". El nombre Bilharzia proviene de Theodor Bilharz , un patólogo alemán que trabajó en Egipto en 1851 y fue el primero en descubrir estos gusanos. [ cita requerida ] El nombre de enfermedad de Katayama proviene del distrito de Katayama de la prefectura de Hiroshima en Japón , donde la esquistosomiasis alguna vez fue endémica. [ 88 ]
La esquistosomiasis es endémica en Egipto, y se ha visto agravada por los proyectos de construcción de presas y de irrigación a lo largo del Nilo . Desde finales de los años 1950 hasta principios de los años 1980, los habitantes de las aldeas infectadas fueron tratados con repetidas inyecciones de tártaro emético . La evidencia epidemiológica sugiere que esta campaña contribuyó involuntariamente a la propagación de la hepatitis C a través de agujas sucias. Egipto tiene la tasa de infección por hepatitis C más alta del mundo, y las tasas de infección en varias regiones del país siguen de cerca el momento y la intensidad de la campaña contra la esquistosomiasis. [89]
A principios del siglo XX, el síntoma de la esquistosomiasis, la presencia de sangre en la orina, se consideraba una versión masculina de la menstruación en Egipto y, por lo tanto, un rito de iniciación para los niños. [90] [91]
Entre las enfermedades parasitarias humanas, la esquistosomiasis ocupa el segundo lugar, detrás de la malaria, en términos de importancia socioeconómica y de salud pública en las zonas tropicales y subtropicales. [92]
Una vacuna propuesta contra la infección por S. haematobium llamada "Bilhvax" se sometió a un ensayo clínico de fase 3 entre niños en Senegal. Los resultados, informados en 2018, mostraron que no era eficaz a pesar de provocar cierta respuesta inmunitaria. [93] Mediante la tecnología de edición genética CRISPR , los investigadores redujeron los síntomas debidos a la esquistosomiasis en un modelo animal. [94]
Utilizando tromboelastografía, investigadores de la Universidad de Tufts observaron que la sangre murina incubada por gusanos adultos durante 1 hora tiene un perfil de coagulación similar al de los pacientes con hemofilia o que toman medicamentos anticoagulantes, lo que sugiere que los esquistosomas podrían poseer propiedades anticoagulantes. [95] [96] La inhibición de la actividad de los esquistosomas en la coagulación sanguínea podría servir potencialmente como una opción terapéutica para la esquistosomiasis.
Bilharziasis causada por un diseño de ingeniería civil deficiente debido a la ignorancia de la causa y la prevención
citando texto de dominio público, publicado por los CDC.
Bilhharz (quien descubrió la esquistosomiasis en Egipto) y Pirajá da Silva (quien estableció su ciclo de vida)
A principios del siglo XX, la población egipcia era muy consciente de la amplia incidencia de la hematuria hasta el punto de que el sangrado de los niños se consideraba una parte normal e incluso necesaria del crecimiento, una forma de menstruación masculina vinculada con la fertilidad masculina (Girges 1934, 103).
Los antiguos egipcios también escribieron sobre niños que se convertían en hombres cuando se veía sangre en su orina, ya que esto se comparaba con la primera menstruación de la joven (Despommier et al. 1995). Además, la evidencia arqueológica como los relieves de las paredes, los jeroglíficos y los papiros confirman que su estilo de vida abarcaba actividades como bañarse, pescar y jugar en el Nilo, y esto combinado con malos hábitos de saneamiento, haría que casi todos fueran susceptibles a esta infección.