En química orgánica , la regla de Markovnikov o regla de Markownikoff describe el resultado de algunas reacciones de adición . La regla fue formulada por el químico ruso Vladimir Markovnikov en 1870. [1] [2] [3]
La regla establece que con la adición de un ácido prótico HX u otro reactivo polar a un alqueno asimétrico , el hidrógeno ácido (H) o parte electropositiva se une al carbono con más sustituyentes de hidrógeno, y el grupo haluro (X) o parte electronegativa se une al carbono con más sustituyentes de alquilo. Esto contrasta con la definición original de Markovnikov, en la que se establece la regla de que el componente X se agrega al carbono con menos átomos de hidrógeno, mientras que el átomo de hidrógeno se agrega al carbono con el mayor número de átomos de hidrógeno. [4]

Lo mismo ocurre cuando un alqueno reacciona con agua en una reacción de adición para formar un alcohol que implica la formación de carbocationes. El grupo hidroxilo (OH) se une al carbono que tiene la mayor cantidad de enlaces carbono-carbono, mientras que el hidrógeno se une al carbono en el otro extremo del doble enlace, que tiene más enlaces carbono-hidrógeno.
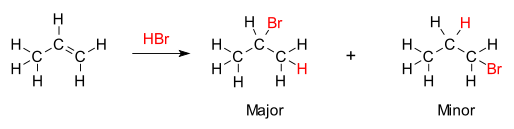
La base química de la regla de Markovnikov es la formación del carbocatión más estable durante el proceso de adición. La adición del ion hidrógeno a un átomo de carbono del alqueno crea una carga positiva en el otro carbono, formando un carbocatión intermedio. Cuanto más sustituido esté el carbocatión, más estable será, debido a la inducción y la hiperconjugación . El producto principal de la reacción de adición será el que se forme a partir del intermedio más estable. Por lo tanto, el producto principal de la adición de HX (donde X es algún átomo más electronegativo que H) a un alqueno tiene el átomo de hidrógeno en la posición menos sustituida y X en la posición más sustituida. Pero el otro carbocatión menos sustituido y menos estable se formará de todos modos en cierta concentración y procederá a ser el producto menor con la unión opuesta, conjugada de X.
También llamadas efecto Kharasch (en honor a Morris S. Kharasch ), estas reacciones que no involucran un carbocatión intermedio pueden reaccionar a través de otros mecanismos que tienen regioselectividades no dictadas por la regla de Markovnikov, como la adición de radicales libres . Se dice que tales reacciones son anti-Markovnikov , ya que el halógeno se agrega al carbono menos sustituido, lo opuesto a una reacción de Markovnikov.
La regla anti-Markovnikov se puede ilustrar utilizando la adición de bromuro de hidrógeno a isobutileno en presencia de peróxido de benzoilo o peróxido de hidrógeno. La reacción de HBr con alquenos sustituidos fue prototípica en el estudio de las adiciones de radicales libres. Los primeros químicos descubrieron que la razón de la variabilidad en la relación de productos de reacción de Markovnikov a anti-Markovnikov se debía a la presencia inesperada de sustancias ionizantes de radicales libres como los peróxidos. La explicación es que el enlace OO en peróxidos es relativamente débil. Con la ayuda de la luz, el calor o, a veces, incluso actuando por sí solo, el enlace OO puede dividirse para formar 2 radicales . Los grupos radicales pueden entonces interactuar con HBr para producir un radical Br, que luego reacciona con el doble enlace. Dado que el átomo de bromo es relativamente grande, es más probable que se encuentre y reaccione con el carbono menos sustituido, ya que esta interacción produce menos interacciones estáticas entre el carbono y el radical bromo. Además, de manera similar a una especie con carga positiva, la especie radical es más estable cuando el electrón desapareado está en la posición más sustituida. El intermediario radical se estabiliza por hiperconjugación . En la posición más sustituida, más enlaces carbono-hidrógeno están alineados con el orbital molecular deficiente en electrones del radical. Esto significa que hay mayores efectos de hiperconjugación, por lo que esa posición es más favorable. [5] En este caso, el carbono terminal es un reactivo que produce un producto de adición primaria en lugar de un producto de adición secundaria.


Hamilton y Nicewicz describieron un nuevo método de adición anti-Markovnikov, que utiliza moléculas aromáticas y energía luminosa de un diodo de baja energía para convertir el alqueno en un radical catiónico. [6] [7]
El comportamiento anti-Markovnikov se extiende a más reacciones químicas que las adiciones a alquenos. El comportamiento anti-Markovnikov se observa en la hidratación del fenilacetileno por catálisis áurica, que da acetofenona ; aunque con un catalizador especial de rutenio [8] proporciona el otro regioisómero 2-fenilacetaldehído : [9]

El comportamiento anti-Markovnikov también puede manifestarse en ciertas reacciones de reordenamiento . En una sustitución nucleofílica formal catalizada por cloruro de titanio (IV) en el enantiopuro 1 en el esquema siguiente, se forman dos productos: 2a y 2b Debido a los dos centros quirales en la molécula objetivo, el carbono que lleva cloro y el carbono que lleva el grupo metilo y acetoxietilo, se deben formar cuatro compuestos diferentes: 1R,2R- (dibujado como 2b) 1R,2S- 1S,2R- (dibujado como 2a) y 1S,2S- . Por lo tanto, ambas estructuras representadas existirán en forma D y L. : [10]

Esta distribución de productos se puede racionalizar asumiendo que la pérdida del grupo hidroxi en 1 da lugar al carbocatión terciario A , que se reorganiza en el carbocatión secundario B, aparentemente menos estable . El cloro puede aproximarse a este centro desde dos caras, lo que conduce a la mezcla de isómeros observada.
Otro ejemplo notable de adición anti-Markovnikov es la hidroboración .