
En estereoquímica , la estereoisomería , o isomería espacial , es una forma de isomería en la que las moléculas tienen la misma fórmula molecular y secuencia de átomos enlazados (constitución), pero difieren en las orientaciones tridimensionales de sus átomos en el espacio. [1] [2] Esto contrasta con los isómeros estructurales , que comparten la misma fórmula molecular, pero las conexiones de enlace o su orden difieren. Por definición, las moléculas que son estereoisómeros entre sí representan el mismo isómero estructural. [3]
Los enantiómeros , también conocidos como isómeros ópticos , son dos estereoisómeros que están relacionados entre sí por una reflexión: son imágenes especulares entre sí que no son superponibles. Las manos humanas son un análogo macroscópico de esto. Cada centro estereogénico en uno tiene la configuración opuesta en el otro. Dos compuestos que son enantiómeros entre sí tienen las mismas propiedades físicas, excepto por la dirección en la que giran la luz polarizada y cómo interactúan con diferentes enantiómeros de otros compuestos. Como resultado, diferentes enantiómeros de un compuesto pueden tener efectos biológicos sustancialmente diferentes. Los enantiómeros puros también exhiben el fenómeno de la actividad óptica y pueden separarse solo con el uso de un agente quiral . En la naturaleza, solo está presente un enantiómero de la mayoría de los compuestos biológicos quirales, como los aminoácidos (excepto la glicina , que es aquiral). Un compuesto ópticamente activo muestra dos formas: forma D -(+) y forma L -(−).
Los diastereómeros son estereoisómeros que no están relacionados a través de una operación de reflexión. [4] No son imágenes especulares entre sí. Estos incluyen compuestos meso , isómeros cis – trans , isómeros EZ e isómeros ópticos no enantioméricos . Los diastereómeros rara vez tienen las mismas propiedades físicas. En el ejemplo que se muestra a continuación, la forma meso del ácido tartárico forma un par diastereomérico con los ácidos levo- y dextro-tartárico, que forman un par enantiomérico.
El etiquetado D y L de los isómeros anteriores no es el mismo que el etiquetado d y l que se observa más comúnmente, lo que explica por qué pueden aparecer invertidos para aquellos familiarizados solo con la última convención de nomenclatura.
Se puede utilizar una proyección de Fischer para diferenciar entre moléculas L y D. Quiralidad (química) . Por ejemplo, por definición, en una proyección de Fischer, el penúltimo carbono de los azúcares D se representa con el hidrógeno a la izquierda y el hidroxilo a la derecha. Los azúcares L se mostrarán con el hidrógeno a la derecha y el hidroxilo a la izquierda.
El otro se refiere a la rotación óptica , cuando se mira la fuente de luz, la rotación del plano de polarización puede ser hacia la derecha (dextrógiro - d-rotativo, representado por (+), en el sentido de las agujas del reloj), o hacia la izquierda (levógiro - l-rotativo, representado por (−), en el sentido contrario a las agujas del reloj) dependiendo de qué estereoisómero sea dominante. Por ejemplo, la sacarosa y el alcanfor son d-rotativo mientras que el colesterol es l-rotativo.
La estereoisomería sobre enlaces dobles surge porque la rotación alrededor del enlace doble está restringida, manteniendo los sustituyentes fijos entre sí. [5] Si los dos sustituyentes en al menos un extremo de un enlace doble son iguales, entonces no hay estereoisómero y el enlace doble no es un estereocentro, por ejemplo, propeno, CH 3 CH=CH 2 donde los dos sustituyentes en un extremo son ambos H. [6]
Tradicionalmente, la estereoquímica del doble enlace se describía como cis (del latín, de este lado) o trans (del latín, del otro lado), en referencia a la posición relativa de los sustituyentes en cada lado de un doble enlace. Un ejemplo simple de isomería cis - trans son los etenos 1,2-disustituidos, como los isómeros del dicloroeteno (C 2 H 2 Cl 2 ) que se muestran a continuación. [7]
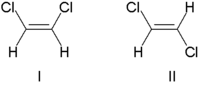
La molécula I es cis -1,2-dicloroeteno y la molécula II es trans -1,2-dicloroeteno. Debido a la ambigüedad ocasional, la IUPAC adoptó un sistema más riguroso en el que a los sustituyentes en cada extremo del doble enlace se les asigna prioridad en función de su número atómico . Si los sustituyentes de alta prioridad están en el mismo lado del enlace, se les asigna Z (en alemán zusammen , juntos). Si están en lados opuestos, se les asigna E (en alemán entgegen , opuestos). [8] Dado que el cloro tiene un número atómico mayor que el hidrógeno, es el grupo de mayor prioridad. [9] Usando esta notación para nombrar las moléculas ilustradas arriba, la molécula I es ( Z )-1,2-dicloroeteno y la molécula II es ( E )-1,2-dicloroeteno. No es el caso de que Z y cis , o E y trans , sean siempre intercambiables. Considere el siguiente fluorometilpenteno:

El nombre apropiado para esta molécula es trans -2-fluoro-3-metilpent-2-eno porque los grupos alquilo que forman la cadena principal (es decir, metilo y etilo) se encuentran a través del doble enlace entre sí, o ( Z )-2-fluoro-3-metilpent-2-eno porque los grupos de mayor prioridad en cada lado del doble enlace están en el mismo lado del doble enlace. El flúor es el grupo de mayor prioridad en el lado izquierdo del doble enlace, y el etilo es el grupo de mayor prioridad en el lado derecho de la molécula.
Los términos cis y trans también se utilizan para describir la posición relativa de dos sustituyentes en un anillo; cis si están en el mismo lado, de lo contrario trans . [10] [11]
El isomería conformacional es una forma de isomería que describe el fenómeno de moléculas con la misma fórmula estructural pero con diferentes formas debido a rotaciones alrededor de uno o más enlaces. [12] [13] [14] Diferentes conformaciones pueden tener diferentes energías, usualmente pueden interconvertirse y muy raramente son aislables. Por ejemplo, existe una variedad de conformaciones de ciclohexano (cuyo ciclohexano es un intermediario esencial para la síntesis de nailon-6,6) incluyendo una conformación de silla donde cuatro de los átomos de carbono forman el "asiento" de la silla, un átomo de carbono es el "respaldo" de la silla, y un átomo de carbono es el "reposapiés"; y una conformación de barco , la conformación de barco representa el máximo de energía en un itinerario conformacional entre las dos formas de silla equivalentes; sin embargo, no representa el estado de transición para este proceso, porque hay vías de menor energía. La inversión conformacional de ciclohexanos sustituidos es un proceso muy rápido a temperatura ambiente, con una vida media de 0,00001 segundos. [15] [16]
Hay algunas moléculas que pueden aislarse en varias conformaciones, debido a las grandes barreras energéticas entre diferentes conformaciones. Los bifenilos 2,2',6,6'-tetrasustituidos pueden encajar en esta última categoría.
El anomerismo es una identidad para estructuras de anillo con enlace simple donde "cis" o "Z" y "trans" o "E" (isomería geométrica) necesitan nombrar las sustituciones en un átomo de carbono que también muestra la identidad de quiralidad; por lo que los anómeros tienen átomos de carbono que tienen isomería geométrica e isomería óptica ( enantiomería ) en uno o más de los carbonos del anillo. [17] [18] [19] [20] Los anómeros se denominan "alfa" o "axial" y "beta" o "ecuatorial" cuando sustituyen una estructura de anillo cíclica que tiene enlaces simples entre los átomos de carbono del anillo, por ejemplo, un grupo hidroxilo, un grupo hidroxilo de metilo, un grupo metoxi u otro grupo piranosa o furanosa que son sustituciones de enlace simple típicas pero no se limitan a estas. [21] La isomería geométrica axial será perpendicular (90 grados) a un plano de referencia y la ecuatorial estará a 120 grados del enlace axial o se desviará 30 grados del plano de referencia. [22]
Los atropisómeros son estereoisómeros resultantes de la rotación impedida alrededor de enlaces simples donde la barrera de tensión estérica a la rotación es lo suficientemente alta para permitir el aislamiento de los confórmeros. [23] [24]
La regla de Bel-van't Hoff establece que para una estructura con n átomos de carbono asimétricos , hay un máximo de 2n estereoisómeros diferentes posibles. Como ejemplo, la D -glucosa es una aldohexosa y tiene la fórmula C 6 H 12 O 6 . Cuatro de sus seis átomos de carbono son estereogénicos, lo que significa que la D -glucosa es uno de los 2 4 = 16 estereoisómeros posibles. [25] [26]