La inmunocitoquímica ( ICC ) es una técnica de laboratorio común que se utiliza para visualizar anatómicamente la localización de una proteína o antígeno específico en las células mediante el uso de un anticuerpo primario específico que se une a él. El anticuerpo primario permite la visualización de la proteína bajo un microscopio de fluorescencia cuando está unido por un anticuerpo secundario que tiene un fluoróforo conjugado . La ICC permite a los investigadores evaluar si las células de una muestra particular expresan o no el antígeno [1] en cuestión. En los casos en los que se encuentra una señal inmunopositiva, la ICC también permite a los investigadores determinar qué compartimentos subcelulares están expresando el antígeno.
La inmunocitoquímica se diferencia de la inmunohistoquímica [2] en que la primera se realiza en muestras de células intactas a las que se les ha eliminado la mayor parte, si no toda, de su matriz extracelular circundante . [ cita requerida ] Esto incluye células individuales que se han aislado de un bloque de tejido sólido, células cultivadas dentro de un cultivo , células depositadas a partir de una suspensión o células tomadas de un frotis . Por el contrario, las muestras inmunohistoquímicas son secciones de tejido biológico , donde cada célula está rodeada por la arquitectura del tejido y otras células que normalmente se encuentran en el tejido intacto. La inmunocitoquímica es una técnica utilizada para evaluar la presencia de una proteína o antígeno específico en las células (células cultivadas, suspensiones celulares) mediante el uso de un anticuerpo específico, que se une a él, lo que permite la visualización y el examen bajo un microscopio. Es una herramienta valiosa para la determinación de contenidos celulares de células individuales. Las muestras que se pueden analizar incluyen frotis de sangre, aspirados, hisopos, células cultivadas y suspensiones celulares.
Existen muchas formas de preparar muestras de células para el análisis inmunocitoquímico. Cada método tiene sus propias ventajas y características únicas, por lo que se puede elegir el método adecuado para la muestra y el resultado deseados.
Las células que se van a teñir se pueden fijar a un soporte sólido para facilitar su manipulación en procedimientos posteriores. Esto se puede lograr mediante varios métodos: las células adherentes se pueden cultivar en portaobjetos de microscopio, cubreobjetos o un soporte de plástico ópticamente adecuado. Las células en suspensión se pueden centrifugar en portaobjetos de vidrio ( citocentrifugación ), unir a un soporte sólido mediante ligadores químicos o, en algunos casos, manipular en suspensión.
Las suspensiones celulares concentradas que existen en un medio de baja viscosidad son buenas candidatas para preparaciones de frotis. Las suspensiones celulares diluidas que existen en un medio diluido son las más adecuadas para la preparación de citocentrifugaciones mediante citocentrifugación. Las suspensiones celulares que existen en un medio de alta viscosidad son las más adecuadas para ser analizadas como preparaciones de hisopo. La constante entre estas preparaciones es que la célula completa está presente en la superficie del portaobjetos. Para que tenga lugar cualquier reacción intercelular, la inmunoglobulina debe atravesar primero la membrana celular que está intacta en estas preparaciones. Las reacciones que tienen lugar en el núcleo pueden ser más difíciles y los fluidos extracelulares pueden crear obstáculos únicos en el desempeño de la inmunocitoquímica. En esta situación, se hace necesario permeabilizar las células utilizando detergente (Triton X-100 o Tween-20) o elegir fijadores orgánicos (acetona, metanol o etanol).
Los anticuerpos son una herramienta importante para demostrar tanto la presencia como la localización subcelular de un antígeno. La tinción celular es una técnica muy versátil y, si el antígeno está muy localizado, puede detectar tan solo mil moléculas de antígeno en una célula. En algunas circunstancias, la tinción celular también se puede utilizar para determinar la concentración aproximada de un antígeno, especialmente mediante un analizador de imágenes.
Existen muchos métodos para obtener detección inmunológica en tejidos, incluidos aquellos ligados directamente a anticuerpos primarios o antisueros. Un método directo implica el uso de una etiqueta detectable (por ejemplo, molécula fluorescente, partículas de oro, etc.) directamente en el anticuerpo [3] que luego se une al antígeno (por ejemplo, proteína) en una célula.
Alternativamente, existen muchos métodos indirectos . En uno de estos métodos, el antígeno se une a un anticuerpo primario que luego se amplifica mediante el uso de un anticuerpo secundario que se une al anticuerpo primario. A continuación, se aplica un reactivo terciario que contiene una fracción enzimática y se une al anticuerpo secundario. Cuando se aplica el reactivo cuaternario, o sustrato, el extremo enzimático del reactivo terciario convierte el sustrato en un producto de reacción de pigmento, que produce un color (son posibles muchos colores; marrón, negro, rojo, etc.) en la misma ubicación en la que el anticuerpo primario original reconoció ese antígeno de interés.
Algunos ejemplos de sustratos utilizados (también conocidos como cromógenos) son AEC (3-amino-9-etilcarbazol) o DAB ( 3,3'-diaminobencidina ). El uso de uno de estos reactivos después de la exposición a la enzima necesaria (por ejemplo, peroxidasa de rábano picante conjugada con un reactivo de anticuerpo) produce un producto de inmunorreacción positivo. La visualización inmunocitoquímica de antígenos específicos de interés se puede utilizar cuando una tinción menos específica como H&E (hematoxilina y eosina) no se puede utilizar para realizar un diagnóstico o para proporcionar información predictiva adicional sobre el tratamiento (en algunos cánceres, por ejemplo).
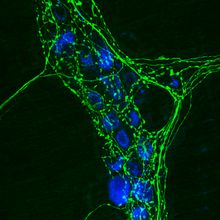
Alternativamente, el anticuerpo secundario puede estar unido covalentemente a un fluoróforo ( FITC y rodamina son los más comunes) que se detecta en un microscopio de fluorescencia o confocal. La ubicación de la fluorescencia variará según la molécula diana, externa para las proteínas de membrana e interna para las proteínas citoplasmáticas. De esta manera, la inmunofluorescencia es una técnica poderosa cuando se combina con la microscopía confocal para estudiar la ubicación de las proteínas y los procesos dinámicos ( exocitosis , endocitosis , etc.).