
Las histrionicotoxinas son un grupo de toxinas relacionadas que se encuentran en la piel de las ranas venenosas de la familia Dendrobatidae , en particular Oophaga histrionica (anteriormente Dendrobates histrionicus ), que son nativas de Colombia. [1] Es probable que, al igual que con otros alcaloides de ranas venenosas, las histrionicotoxinas no sean fabricadas por los anfibios, sino absorbidas por los insectos en su dieta y almacenadas en glándulas en su piel. [2] [3] Son notablemente menos tóxicos que otros alcaloides que se encuentran en las ranas venenosas, pero su estructura distintiva actúa como una neurotoxina mediante la inhibición no competitiva de los receptores nicotínicos de acetilcolina . [4]
El primer registro de histrionicotoxinas data de 1823 por el capitán Charles Stuart Cochrane. [5] Cochrane estaba explorando las selvas tropicales alrededor de Colombia y Panamá. Sus informes mencionan tribus de indios que usaban flechas con punta venenosa y dardos de cerbatana para la caza y la guerra. Tras una mayor exploración, Cochrane descubrió que estos indios extraían el veneno de la piel de la rana venenosa, entonces conocida como Dendrobates histrionicus . Un relato de su diario dice:
"[...] llamada rana de veneno por los españoles, de unos tres centímetros de largo, amarilla por el dorso, con ojos negros muy grandes... los que usan veneno atrapan las ranas en el bosque y las encierran en una caña hueca donde los alimentan regularmente hasta que quieren el veneno, momento en el que toman al desafortunado reptil y le pasan un trozo de madera puntiagudo por la garganta y le sale por una de las patas. Esta tortura hace que la pobre rana transpira mucho, sobre todo en el lomo. se cubre de una espuma blanca; este es el veneno más poderoso que produce, y en ella sumergen o enrollan las puntas de sus flechas, que conservarán su poder destructivo durante un año. Después, debajo de esta sustancia blanca, aparece una sustancia amarilla. aceite, que se raspa cuidadosamente y conserva su influencia mortal durante cuatro a seis meses, según la bondad (como dicen) de la rana. De esta manera, de una rana se obtiene suficiente veneno para unas cincuenta flechas.
Las histrionicotoxinas son una clase más que un veneno específico y este amplio espectro plantea desafíos sintéticos. Las estructuras de las histrionicotoxinas se caracterizaron en 1971. [6] Desde entonces, se han llevado a cabo varios estudios sintéticos y síntesis totales. La Tabla 1 describe algunas de las muchas variaciones en los alcaloides de histrionicotoxina de la molécula original (283A). [7]

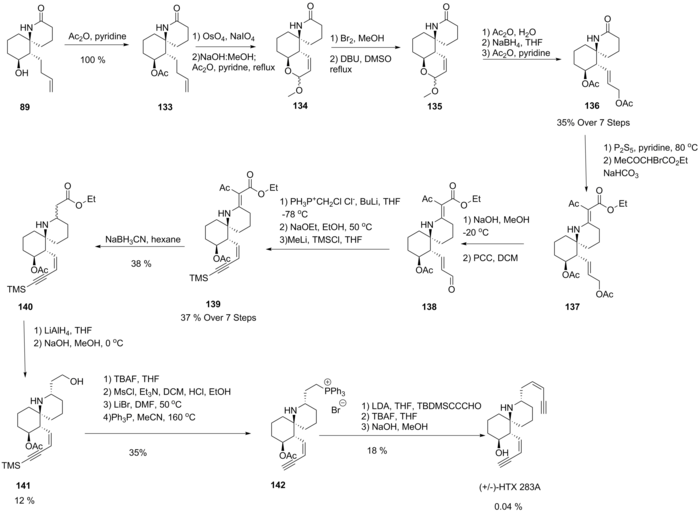
Desde la caracterización, el desarrollo de vías sintéticas para la histrionicotoxina ha sido de interés para los grupos de investigación debido a su funcionalidad inusual. El grupo Kishi propuso la primera síntesis total del padre 283A en 1985 utilizando 89, una lactama previamente sintetizada y utilizada para la síntesis de otras variantes. [8] El tratamiento con anhídrido acético produjo 133 en rendimiento cuantitativo. El enol éter cíclico 134 se formó mediante escisión oxidativa que promovió la adición intramolecular seguida de una desprotección básica y deshidratación. Luego se descubrió que la bromación seguida de la deshidrobrominación en metanol daba una mezcla epimérica de 135 insaturado. La hidrólisis, la reducción y la acetilación produjeron 136. La formación de una tiolactama seguida de la condensación con bromoacetato de etilo dio 137. La desprotección selectiva del alcohol alílico seguida de oxidación dio 138 Luego, una reacción de Wittig generó un cloroalqueno que, tras la eliminación del HCl promovida por una base, dio un alquino terminal, que posteriormente se protegió para formar 139. La función olefínica de 139 se redujo primero usando cianoborohidruro antes de una mayor reducción de 140 a un epimérico. mezcla de alcoholes. Luego se realizó una adición retro-Michael en condiciones básicas a baja temperatura, epimerizando exitosamente este compuesto para dar el epímero 141 deseado. Luego, una reacción con trifenilfosfina generó la sal de fosfonio 142, y luego se pudo realizar una reacción de Wittig para unir el sililo. función cis-eno-ino protegida, que luego se desprotegió para producir el objetivo (±)-HTX 283A.
HTX actúa como un antagonista no competitivo de los receptores nicotínicos de acetilcolina, que están implicados en la señalización neuronal. Como antagonista no competitivo, HTX se une a una subunidad del receptor nicotínico de acetilcolina. 3 En realidad, esto aumenta la afinidad por el agonista acetilcolina y estabiliza el receptor desensibilizado. [9] Esto bloquea los potenciales de acción y ralentiza la función neuronal. Se ha demostrado que la histrionicotoxina se une competitivamente a muchos anestésicos locales, como la tetracaína, así como a otros antagonistas no competitivos de los receptores de aminas aromáticas, lo que indica que los compuestos probablemente comparten un sitio de unión; este sitio de interacción se encuentra fuera del dominio transmembrana del receptor nicotínico de acetilcolina, aunque la interacción exacta aún no se ha caracterizado. [10] [11] Si bien la histrionicotoxina comparte una ubicación de unión con otros antagonistas no competitivos del receptor nicotínico de acetilcolina, se ha demostrado que tiene una afinidad relativamente mayor por los receptores desensibilizados que la fenciclidina, lo que indica una sutileza aún no caracterizada en la naturaleza de su acción. vinculante. [10] Además, los estudios de los efectos de la histrionicotoxina sobre el potencial de la placa terminal han demostrado que el compuesto dificulta la propagación del potencial de membrana, pero tiene características emergentes con hiperpolarizaciones de membrana. [12] La unión de la histrionicotoxina es rápidamente reversible, por lo que puede eliminarse fácilmente de las regiones afectadas con lavados repetidos o, in vivo , con difusión corporal natural. [12] Se ha demostrado que altas concentraciones de HTX tienen efectos antagónicos sobre la batracotoxina. [13]
La histrionicotoxina es relativamente no tan tóxica como otros alcaloides de las ranas dardo venenosas. Las pruebas preliminares mostraron que los ratones podían sobrevivir a una dosis de 5 mg/kg de histrionicotoxina 283a y recuperarse en 3 horas sin efectos duraderos. [6]