El hexafluoroetano es la contraparte perfluorocarbonada del hidrocarburo etano . Es un gas no inflamable, poco soluble en agua y ligeramente soluble en metanol . Es un gas de efecto invernadero extremadamente potente y de larga vida .
La fase sólida del hexafluoroetano tiene dos polimorfos . En la literatura científica se han indicado diferentes temperaturas de transición de fase . Los últimos trabajos lo asignan a 103 K (-170 °C). Por debajo de 103 K tiene una estructura ligeramente desordenada y sobre el punto de transición tiene una estructura cúbica centrada en el cuerpo . [1] El punto crítico está a 19,89 °C (293,04 K) y 30,39 bar. [2]
Tabla de densidades:
La densidad de vapor es 4,823 (aire = 1), la gravedad específica a 21 °C es 4,773 (aire = 1) y el volumen específico a 21 °C es 0,1748 m 3 /kg.
El hexafluoroetano se utiliza como grabador versátil en la fabricación de semiconductores . Puede usarse para el grabado selectivo de siliciuros y óxidos metálicos frente a sus sustratos metálicos y también para el grabado de dióxido de silicio sobre silicio . Las industrias primarias de aluminio y de fabricación de semiconductores son los principales emisores de hexafluoroetano mediante el proceso Hall-Héroult .
Junto con el trifluorometano se utiliza en los refrigerantes R508A (61%) y R508B (54%).
Se utiliza como taponamiento para ayudar en la reinserción de la retina después de una cirugía vitreorretiniana . [3]

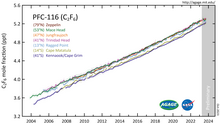
Debido a la alta energía de los enlaces C-F, el hexafluoroetano es casi inerte y, por tanto, actúa como un gas de efecto invernadero extremadamente estable, con una vida atmosférica de 10.000 años (otras fuentes: 500 años). [4] Tiene un potencial de calentamiento global (GWP) de 9200 y un potencial de agotamiento de la capa de ozono (ODP) de 0. El hexafluoroetano está incluido en la lista del IPCC de gases de efecto invernadero .
El hexafluoroetano no existía en cantidades significativas en el medio ambiente antes de su fabricación a escala industrial. La concentración atmosférica de hexafluoroetano alcanzó los 3 pptv a principios del siglo XXI. [5] Sus bandas de absorción en la parte infrarroja del espectro provocan un forzamiento radiativo de aproximadamente 0,001 W/m 2 .
Debido a su alta densidad relativa, se acumula en zonas bajas y en concentraciones elevadas puede provocar asfixia .