Un grupo de equivalencia es un conjunto de células no especificadas que tienen el mismo potencial de desarrollo o la capacidad de adoptar distintos destinos . Nuestro conocimiento actual sugiere que los grupos de equivalencia se limitan a células de la misma ascendencia, también conocidas como células hermanas. [1] A menudo, las células de un grupo de equivalencia adoptan destinos diferentes entre sí. [2]
Los grupos de equivalencia asumen varios destinos potenciales de dos maneras generales, no mutuamente excluyentes. Un mecanismo, la inducción, ocurre cuando una señal que se origina fuera del grupo de equivalencia especifica un subconjunto de células ingenuas. [2] Otro modo, conocido como inhibición lateral , surge cuando una señal dentro de un grupo de equivalencia hace que una célula adopte un destino dominante mientras que otras en el grupo se ven inhibidas de hacerlo. [3] En muchos ejemplos de grupos de equivalencia, tanto la inducción como la inhibición lateral se utilizan para definir patrones de distintos tipos de células.
Las células de un grupo de equivalencia que no reciben una señal adoptan un destino predeterminado. Alternativamente, las células que reciben una señal adoptan destinos diferentes. [2] [4] En un punto determinado, los destinos de las células dentro de un grupo de equivalencia se determinan de manera irreversible, por lo que pierden su potencial multipotente . A continuación se proporcionan ejemplos de grupos de equivalencia estudiados en nematodos y ascidias .
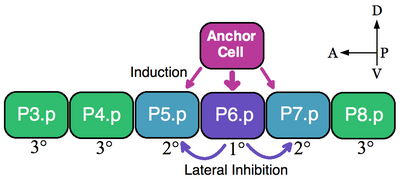
Un ejemplo clásico de un grupo de equivalencia son las células precursoras de la vulva (CVP) de los nematodos. En Caenorhabditis elegans, los huevos autofecundados salen del cuerpo a través de la vulva . Este órgano se desarrolla a partir de un subconjunto de células de un grupo de equivalencia que consta de seis CVP, P3.p-P8.p, que se encuentran ventralmente a lo largo del eje anteroposterior. [5] En este ejemplo, una sola célula somática suprayacente, la célula de anclaje, induce a las CVP cercanas a asumir los destinos vulvares 1° (P6.p) y 2° (P5.p y P7.p). Las CVP que no se inducen forman el linaje 3° (P3.p, P4.p y P8.p), que produce células epidérmicas que se fusionan para formar una gran epidermis sincitial (ver imagen). [6]
Las seis células progenitoras vulvares forman un grupo de equivalencia porque las seis células son competentes para adoptar cualquiera de los destinos disponibles (1°, 2° y 3°) dependiendo de su proximidad a la célula de anclaje. Los experimentos de ablación indican que todas las células progenitoras vulvares pueden adoptar destinos de vulva. Por ejemplo, si se extirpa la célula P6.p que normalmente se convierte en 1°, la célula progenitora vulvar más cercana a la célula de anclaje, ya sea P5.p o P7.p, asume el destino 1°. Además, si se destruyen todas las células progenitoras vulvares excepto la célula P3.p más anterior, la célula de anclaje designa a esta célula como el destino 1°. Sin embargo, si se destruye la célula de anclaje, en ausencia de una señal inductiva, todas las células progenitoras vulvares asumen el linaje 3° predeterminado. [7]
La célula de anclaje induce directamente los destinos de la vulva mediante la secreción del ligando LIN-3, similar al factor de crecimiento epidérmico (EGF). La célula P6.p recibe la señal LIN-3 a través del receptor de tirosina quinasa LET-23 (P5.p y P7.p también reciben LIN-3, pero en menor medida). La activación de LET-23 en P6.p da como resultado la activación de LIN-12 ( Notch ) en P5.p y P7.p. La evidencia experimental muestra que LIN-12 es necesario y suficiente para la formación del 2° destino. A través de la inhibición lateral, LIN-12 evita que las células P5.p y P7.p adopten el linaje 1°. [7] Por lo tanto, en este ejemplo, tanto la señalización inductiva de EGF como la activación lateral de Notch modelan el grupo de equivalencia VPC.

Las larvas de ascidias (ascidias marinas) contienen un par de células pigmentarias sensoriales conocidas como otolito y ocelo . El otolito se utiliza para percibir la gravedad, mientras que el ocelo responde a la luz. Durante la embriogénesis, el otolito y el ocelo se desarrollan a partir de dos precursores bilaterales equivalentes. Tanto la célula precursora pigmentaria izquierda como la derecha tienen la misma probabilidad de convertirse en otolito o en ocelo. La decisión de adoptar uno u otro destino se determina después del cierre del tubo neural durante la etapa temprana del brote caudal (ver imagen), a través de un mecanismo de inducción poco definido. [1]
Durante el desarrollo normal, después del cierre del tubo neural , los precursores del pigmento se alinean dorsalmente a lo largo del eje anteroposterior del tubo neural. La célula que se alinea anteriormente se convertirá en el otolito, mientras que la célula posterior formará el ocelo. En ausencia de interacciones entre células, ambas células se convierten en ocelos, que es el destino predeterminado. [3] [8]
Para dilucidar si el destino del otolito y el ocelo se determina en el embrión temprano o después de que los precursores se alinean durante el cierre del tubo neural, se utilizaron técnicas de ablación y tratamiento farmacológico en la especie de ascidia Halocythia roretzi .
Las células marcadas con isotiocianato de fluoresceína-dextrano (FDX) pueden fotoablación selectiva mediante excitación fluorescente. [9] Cuando una célula precursora de pigmento marcada con FDX se fotoablación durante la etapa media de neurula (15 horas), la otra casi siempre se convertirá en un ocelo. Sin embargo, si las ablaciones se realizan durante la etapa tardía de yema de cola (22,5 horas), la célula restante tiene la misma probabilidad de convertirse en un otolito o un ocelo. [1]
La inhibición de la división celular y la morfogénesis con citocalasina B es otro método utilizado para determinar cuándo se especifica el grupo de equivalencia de precursores de pigmento. El tratamiento con citocalasina de embriones en la etapa temprana de la yema caudal (17 horas), mientras las dos células bilaterales aún están separadas, da como resultado que ambas células se conviertan en ocelos. Cuando se utilizó el fármaco después de que las dos células se alinearan en la línea media dorsal, la célula anterior se convirtió en el otolito y la célula posterior se convirtió en el ocelo sin excepción. [1] Ambos experimentos sugieren que los destinos de las células precursoras de pigmento están determinados irreversiblemente aproximadamente en la etapa de la yema caudal media (21 horas).
También se han descrito grupos de equivalencia en las células madre ganglionares del saltamontes y en los teloblastos O/P de la sanguijuela . [10] [11] Al igual que otros casos de grupos de equivalencia, las células de la progenie nacen equivalentes y se especifican a través de interacciones celulares. Los grupos de equivalencia son un tema común en el desarrollo de muchos organismos de diversos filos .