La glucógeno fosforilasa es una de las enzimas fosforilasas ( EC 2.4.1.1). La glucógeno fosforilasa cataliza el paso limitante de la velocidad en la glucogenólisis en animales mediante la liberación de glucosa-1-fosfato del enlace alfa-1,4-glucosídico terminal. La glucógeno fosforilasa también se estudia como una proteína modelo regulada tanto por la fosforilación reversible como por los efectos alostéricos .
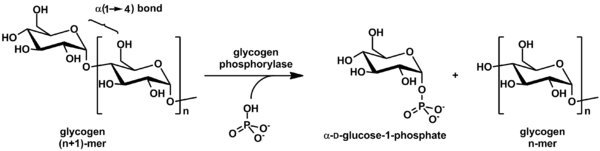
La glucógeno fosforilasa descompone el glucógeno en subunidades de glucosa (ver también la figura siguiente):
(cadena de glucógeno α-1,4) n + Pi ⇌ (cadena de glucógeno α-1,4) n-1 + α-D-glucosa-1-fosfato. [2]
Al glucógeno le queda una molécula de glucosa menos y la molécula de glucosa libre queda en forma de glucosa-1-fosfato . Para poder ser utilizada en el metabolismo , debe ser convertida en glucosa-6-fosfato por la enzima fosfoglucomutasa .
Aunque la reacción es reversible in vitro , dentro de la célula la enzima sólo funciona en dirección directa como se muestra a continuación porque la concentración de fosfato inorgánico es mucho mayor que la de glucosa-1-fosfato. [2]
La glucógeno fosforilasa sólo puede actuar sobre cadenas lineales de glucógeno (enlace glucosídico α1-4). Su trabajo se detendrá inmediatamente a cuatro residuos de la ramificación α1-6 (que son extremadamente comunes en el glucógeno). En estas situaciones, es necesaria la enzima desramificadora , que enderezará la cadena en esa zona. Además, la enzima transferasa desplaza un bloque de 3 residuos de glucosilo desde la rama exterior hasta el otro extremo, y luego se requiere una enzima α1-6 glucosidasa para romper el residuo α1-6 restante (glucosa simple) que permanece en la nueva cadena lineal. Una vez hecho todo esto, la glucógeno fosforilasa puede continuar. La enzima es específica de las cadenas α1-4, ya que la molécula contiene una hendidura de 30 angstroms de longitud con el mismo radio que la hélice formada por la cadena de glucógeno; esta acomoda 4-5 residuos de glucosilo, pero es demasiado estrecha para las ramificaciones. Esta grieta conecta el sitio de almacenamiento de glucógeno con el sitio catalítico activo.
La glucógeno fosforilasa tiene un fosfato de piridoxal (PLP, derivado de la vitamina B 6 ) en cada sitio catalítico. El fosfato de piridoxal se une a residuos básicos (en este caso Lys680) y forma covalentemente una base de Schiff . Una vez que se forma el enlace de base de Schiff, manteniendo la molécula de PLP en el sitio activo, el grupo fosfato en el PLP dona fácilmente un protón a una molécula de fosfato inorgánico, lo que permite que el fosfato inorgánico a su vez sea desprotonado por el oxígeno formando el enlace glucosídico α-1,4. El PLP se desprotona fácilmente porque su carga negativa no solo está estabilizada dentro del grupo fosfato, sino también en el anillo de piridina, por lo que la base conjugada resultante de la desprotonación del PLP es bastante estable. El oxígeno protonado ahora representa un buen grupo saliente , y la cadena de glucógeno se separa del glucógeno terminal de manera S N 1 , lo que resulta en la formación de una molécula de glucosa con un carbocatión secundario en la posición 1. Finalmente, el fosfato inorgánico desprotonado actúa como un nucleófilo y se une con el carbocatión, lo que resulta en la formación de glucosa-1-fosfato y una cadena de glucógeno acortada por una molécula de glucosa.
También existe un mecanismo alternativo propuesto que involucra un oxígeno cargado positivamente en una conformación de media silla. [3]

El monómero de la glucógeno fosforilasa es una proteína grande, compuesta por 842 aminoácidos con una masa de 97,434 kDa en las células musculares. Si bien la enzima puede existir como un monómero o tetrámero inactivo, es biológicamente activa como un dímero de dos subunidades idénticas. [4]

En los mamíferos, las principales isoenzimas de la glucógeno fosforilasa se encuentran en el músculo, el hígado y el cerebro. El tipo cerebral predomina en el cerebro adulto y en los tejidos embrionarios, mientras que los tipos hepático y muscular predominan en el hígado adulto y en el músculo esquelético, respectivamente. [5]
El dímero de la glucógeno fosforilasa tiene muchas regiones de importancia biológica, incluidos sitios catalíticos , sitios de unión del glucógeno, sitios alostéricos y un residuo de serina fosforilado de forma reversible. En primer lugar, los sitios catalíticos están relativamente enterrados, a 15 Å de la superficie de la proteína y de la interfaz de la subunidad. [6] Esta falta de fácil acceso del sitio catalítico a la superficie es significativa porque hace que la actividad de la proteína sea muy susceptible a la regulación, ya que pequeños efectos alostéricos podrían aumentar en gran medida el acceso relativo del glucógeno al sitio.
Quizás el sitio regulador más importante sea Ser14, el sitio de fosforilación reversible muy cercano a la interfase de la subunidad. El cambio estructural asociado con la fosforilación, y con la conversión de la fosforilasa b en fosforilasa a, es la disposición de los residuos originalmente desordenados 10 a 22 en hélices α. Este cambio aumenta la actividad de la fosforilasa hasta un 25% incluso en ausencia de AMP, y mejora aún más la activación de AMP. [7]
El sitio alostérico de unión de AMP en las isoformas musculares de la glucógeno fosforilasa está cerca de la interfaz de la subunidad, al igual que Ser14. La unión de AMP en este sitio, que corresponde a un cambio del estado T de la enzima al estado R, da como resultado pequeños cambios en la estructura terciaria en la interfaz de la subunidad que conducen a grandes cambios en la estructura cuaternaria. [8] La unión de AMP hace girar las hélices de torre (residuos 262-278) de las dos subunidades 50˚ entre sí a través de una mayor organización e interacciones entre subunidades. Esta rotación de las hélices de torre conduce a una rotación de las dos subunidades de 10˚ entre sí y, lo que es más importante, altera los residuos 282-286 (el bucle 280s) que bloquean el acceso al sitio catalítico en el estado T, pero no en el estado R. [6]
El último sitio, quizás el más curioso, de la proteína glucógeno fosforilasa es el llamado sitio de almacenamiento de glucógeno. Los residuos 397-437 forman esta estructura, que permite que la proteína se una covalentemente a la cadena de glucógeno a 30 Å del sitio catalítico. Este sitio es muy probablemente el sitio en el que la enzima se une a los gránulos de glucógeno antes de iniciar la escisión de las moléculas terminales de glucosa. De hecho, el 70% de la fosforilasa dimérica en la célula existe unida a los gránulos de glucógeno en lugar de flotar libremente. [9]
La inhibición de la glucógeno fosforilasa se ha propuesto como un método para tratar la diabetes tipo 2. [10] Dado que se ha demostrado que la producción de glucosa en el hígado aumenta en pacientes con diabetes tipo 2, [11] la inhibición de la liberación de glucosa de los suministros de glucógeno del hígado parece ser un enfoque válido. La clonación de la glucógeno fosforilasa hepática humana (HLGP) reveló un nuevo sitio de unión alostérico cerca de la interfaz de la subunidad que no está presente en la glucógeno fosforilasa muscular de conejo (RMGP) normalmente utilizada en estudios. Este sitio no era sensible a los mismos inhibidores que los del sitio alostérico del AMP, [12] y el mayor éxito se ha obtenido sintetizando nuevos inhibidores que imitan la estructura de la glucosa, ya que la glucosa-6-fosfato es un inhibidor conocido de la HLGP y estabiliza el estado T menos activo. [13] Estos derivados de la glucosa han tenido cierto éxito en la inhibición de la HLGP, con valores de Ki previstos tan bajos como 0,016 mM. [14]
Las mutaciones en la isoforma muscular de la glucógeno fosforilasa (PYGM) están asociadas con la enfermedad de almacenamiento de glucógeno tipo V (GSD V, enfermedad de McArdle). Hasta la fecha, se han identificado más de 65 mutaciones en el gen PYGM que conducen a la enfermedad de McArdle. [15] [16] Los síntomas de la enfermedad de McArdle incluyen debilidad muscular, mialgia y falta de resistencia, todos derivados de niveles bajos de glucosa en el tejido muscular. [17]
Las mutaciones en la isoforma hepática de la glucógeno fosforilasa (PYGL) están asociadas con la enfermedad de Hers ( enfermedad de almacenamiento de glucógeno tipo VI ). [18] [19] La enfermedad de Hers a menudo se asocia con síntomas leves normalmente limitados a la hipoglucemia , y a veces es difícil de diagnosticar debido a la actividad enzimática residual. [20]
Se ha propuesto la isoforma cerebral de la glucógeno fosforilasa (PYGB) como biomarcador del cáncer gástrico . [21]
La fosforilasa de glucógeno se regula mediante control alostérico y fosforilación . La fosforilasa a y la fosforilasa b existen cada una en dos formas: un estado inactivo T (tenso) y un estado R (relajado). La fosforilasa b está normalmente en el estado T, inactiva debido a la presencia fisiológica de ATP y glucosa 6 fosfato, y la fosforilasa a está normalmente en el estado R (activo). Existe una isoenzima de la fosforilasa de glucógeno en el hígado sensible a la concentración de glucosa, ya que el hígado actúa como exportador de glucosa. En esencia, la fosforilasa hepática responde a la glucosa, lo que provoca una transición muy sensible de la forma R a T, inactivándola; además, la fosforilasa hepática es insensible al AMP.
Hormonas como la epinefrina , la insulina y el glucagón regulan la glucógeno fosforilasa utilizando sistemas de amplificación de segundos mensajeros vinculados a las proteínas G. El glucagón activa la adenilato ciclasa a través de un receptor acoplado a proteína G (GPCR) acoplado a G s que a su vez activa la adenilato ciclasa para aumentar las concentraciones intracelulares de AMPc. El AMPc se une a la proteína quinasa A (PKA) y la activa . La PKA fosforila la fosforilasa quinasa , que a su vez fosforila la glucógeno fosforilasa b en Ser14, convirtiéndola en la glucógeno fosforilasa a activa.
En el hígado, el glucagón también activa otro GPCR que desencadena una cascada diferente, lo que da lugar a la activación de la fosfolipasa C (PLC). La PLC provoca indirectamente la liberación de calcio desde el retículo endoplasmático de los hepatocitos al citosol. La mayor disponibilidad de calcio se une a la subunidad de calmodulina y activa la glucógeno fosforilasa quinasa. La glucógeno fosforilasa quinasa activa la glucógeno fosforilasa de la misma manera mencionada anteriormente.
La glucógeno fosforilasa b no siempre está inactiva en el músculo, ya que puede ser activada alostéricamente por el AMP. [6] [9] Un aumento en la concentración de AMP, que ocurre durante el ejercicio extenuante, indica demanda de energía. El AMP activa la glucógeno fosforilasa b al cambiar su conformación de una forma tensa a una forma relajada. Esta forma relajada tiene propiedades enzimáticas similares a las de la enzima fosforilada. Un aumento en la concentración de ATP se opone a esta activación al desplazar al AMP del sitio de unión del nucleótido, lo que indica que hay suficientes reservas de energía.
Al ingerir una comida, se libera insulina , lo que indica la disponibilidad de glucosa en la sangre. La insulina activa indirectamente la proteína fosfatasa 1 (PP1) y la fosfodiesterasa a través de una cascada de transducción de señales. La PP1 desfosforila la glucógeno fosforilasa a, reformando la glucógeno fosforilasa b inactiva. La fosfodiesterasa convierte el AMPc en AMP. Juntos, disminuyen la concentración de AMPc e inhiben la PKA. Como resultado, la PKA ya no puede iniciar la cascada de fosforilación que termina con la formación de la glucógeno fosforilasa a (activa). En general, la señalización de la insulina disminuye la glucogenólisis para preservar las reservas de glucógeno en la célula y desencadena la glucogénesis . [22]
La glucógeno fosforilasa fue la primera enzima alostérica en ser descubierta. [8] Fue aislada y su actividad caracterizada en detalle por Carl F. Cori , Gerhard Schmidt y Gerty T. Cori . [23] [24] Arda Green y Gerty Cori la cristalizaron por primera vez en 1943 [25] e ilustraron que la glucógeno fosforilasa existía en las formas a o b dependiendo de su estado de fosforilación, así como en los estados R o T según la presencia de AMP. [26]