El ácido etilendiamino -N , N'- disuccínico ( EDDS ) es un ácido aminopolicarboxílico . Es un sólido incoloro que se utiliza como agente quelante que puede ofrecer una alternativa biodegradable al EDTA , que actualmente se utiliza a gran escala en numerosas aplicaciones.
EDDS tiene dos centros quirales y, como tal, tres estereoisómeros. [1] Estos son los isómeros enantioméricos (R,R) y (S,S) y el isómero meso aquiral (R,S). Como sustituto biodegradable del EDTA, sólo resulta de interés el estereoisómero (S,S). Los estereoisómeros (R,S) y (R,R) son menos biodegradables, mientras que se ha demostrado que el estereoisómero (S,S) se biodegrada de manera muy efectiva incluso en suelos altamente contaminados. [2]
El EDDS se sintetizó por primera vez a partir de ácido maleico y etilendiamina . [3] [4] Algunos microorganismos han sido manipulados para la síntesis a escala industrial de (S,S)-EDDS a partir de etilendiamina y ácido fumárico o ácido maleico, que procede de la siguiente manera: [5]
(S,S)-EDDS se produce estereoespecíficamente mediante la alquilación de un dibromuro de etileno con ácido L-aspártico . El EDDS racémico se produce mediante la reacción de etilendiamina con ácido fumárico o ácido maleico.
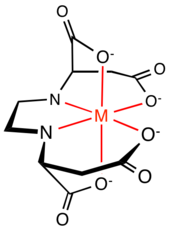
Al comparar la eficacia de (S,S)-EDDS versus EDTA como agentes quelantes para el hierro (III) :
Debido a la menor estabilidad para [Fe(S,S)-EDDS] − , el rango útil es aproximadamente 3< pH (S,S)-EDDS <9 y 2<pH EDTA <11. Sin embargo, este rango es suficiente para la mayoría de las aplicaciones. [6]
Otra comparación que se puede hacer entre (S,S)-EDDS y EDTA es la estructura del complejo quelado. Los seis sitios donantes de EDTA forman cinco anillos de quelato de cinco miembros alrededor del ion metálico, cuatro anillos NC 2 OFe y un anillo C 2 N 2 Fe. El anillo C 2 N 2 Fe y dos anillos NC 2 OFe definen un plano , y dos anillos NC 2 OFe son perpendiculares al plano que contiene el eje de simetría C 2 . Los anillos de cinco miembros están ligeramente tensos. Los seis sitios donantes de EDDS forman anillos de quelato de cinco y seis miembros alrededor del ion metálico: dos anillos NC 2 OFe, dos anillos NC 3 OFe y un anillo C 2 N 2 Fe. Los estudios de la estructura cristalina del complejo Fe[(S,S)-EDDS] - muestran que los dos anillos NC 3 OFe de cinco miembros se proyectan fuera del plano del complejo, reduciendo la tensión del anillo ecuatorial que existe en el Fe[ EDTA] − complejo. [7] El complejo también tiene simetría C 2 .
(S,S)-EDDS es un agente quelante biodegradable que ofrece una alternativa al EDTA, del que se producen 80 millones de kilogramos anualmente. En condiciones naturales, se ha descubierto que el EDTA se convierte en ácido etilendiaminotriacético y luego se cicla a dicetopiperazina , que se acumula en el medio ambiente como un contaminante orgánico persistente . [8] [9] (S,S)-EDDS se desarrolló comercialmente como un quelante biodegradable y agente estabilizante en formulaciones de detergentes y cosméticos. [10] Cuando se aplica EDDS en la remediación de suelos mejorada con productos químicos en exceso (por ejemplo, cuando se aplica para el lavado de suelos ex situ), se puede lograr una mayor eficiencia de extracción de metales pesados y la cantidad de extracción es menos independiente de la dosis de EDDS. ; [11] Por otro lado, durante la remediación del suelo que implica un lavado continuo, la extracción de metales a menudo está limitada por la cantidad de EDDS. Bajo la deficiencia de EDDS, se observó una extracción inicial no selectiva de metales pesados, seguida por un intercambio de metales pesados y una readsorción de metales pesados que tienen una constante de estabilidad más baja con EDDS. [12]