
En estereoquímica , estereoisomería , o isomería espacial , es una forma de isomería en la que las moléculas tienen la misma fórmula molecular y secuencia de átomos unidos (constitución), pero difieren en las orientaciones tridimensionales de sus átomos en el espacio. [1] [2] Esto contrasta con los isómeros estructurales , que comparten la misma fórmula molecular, pero las conexiones de enlace o su orden difieren. Por definición, las moléculas que son estereoisómeros entre sí representan el mismo isómero estructural. [3]
Los enantiómeros , también conocidos como isómeros ópticos , son dos estereoisómeros que están relacionados entre sí por una reflexión: son imágenes especulares entre sí que no son superponibles. Las manos humanas son un análogo macroscópico de esto. Cada centro estereogénico en uno tiene la configuración opuesta en el otro. Dos compuestos que son enantiómeros entre sí tienen las mismas propiedades físicas, excepto por la dirección en la que giran la luz polarizada y cómo interactúan con diferentes enantiómeros de otros compuestos. Como resultado, diferentes enantiómeros de un compuesto pueden tener efectos biológicos sustancialmente diferentes. Los enantiómeros puros también presentan el fenómeno de la actividad óptica y sólo pueden separarse con el uso de un agente quiral . En la naturaleza, sólo está presente un enantiómero de la mayoría de los compuestos biológicos quirales, como los aminoácidos (excepto la glicina , que es aquiral). Un compuesto ópticamente activo muestra dos formas: forma D -(+) y forma L -(-).
Los diastereómeros son estereoisómeros no relacionados mediante una operación de reflexión. [4] No son imágenes especulares el uno del otro. Estos incluyen compuestos meso , isómeros cis - trans , isómeros EZ e isómeros ópticos no enantioméricos . Los diastereómeros rara vez tienen las mismas propiedades físicas. En el ejemplo que se muestra a continuación, la forma meso del ácido tartárico forma un par diastereomérico con los ácidos levo y dextrotartárico, que forman un par enantiomérico.
El etiquetado D y L de los isómeros anteriores no es el mismo que el etiquetado d y l que se ve más comúnmente, lo que explica por qué estos pueden parecer invertidos para aquellos que están familiarizados solo con esta última convención de nomenclatura.
Se puede utilizar una proyección de Fischer para diferenciar entre moléculas L y D. Quiralidad (química) . Por ejemplo, por definición, en una proyección de Fischer el penúltimo carbono de los azúcares D se representa con el hidrógeno a la izquierda y el hidroxilo a la derecha. Los azúcares L se mostrarán con el hidrógeno a la derecha y el hidroxilo a la izquierda.
El otro se refiere a la rotación óptica , cuando se mira la fuente de luz, la rotación del plano de polarización puede ser hacia la derecha (dextrógiro - d-rotativo, representado por (+), en el sentido de las agujas del reloj), o hacia la izquierda (levógiro - d-rotativo, representado por (+), en el sentido de las agujas del reloj). — l-rotativo, representado por (-), en sentido antihorario) dependiendo de qué estereoisómero sea dominante. Por ejemplo, la sacarosa y el alcanfor son rotativos d, mientras que el colesterol es rotativo l.
La estereoisomería sobre los dobles enlaces surge porque la rotación alrededor del doble enlace está restringida, manteniendo los sustituyentes fijos entre sí. [5] Si los dos sustituyentes en al menos un extremo de un doble enlace son iguales, entonces no hay estereoisómero y el doble enlace no es un estereocentro, por ejemplo, propeno, CH 3 CH=CH 2 donde los dos sustituyentes en un extremo ambos son H. [6]
Tradicionalmente, la estereoquímica del doble enlace se describía como cis (del latín, de este lado) o trans (del latín, transversal), en referencia a la posición relativa de los sustituyentes a cada lado de un doble enlace. Un ejemplo simple de isomería cis - trans son los etenos 1,2-disustituidos, como los isómeros de dicloroeteno (C 2 H 2 Cl 2 ) que se muestran a continuación. [7]
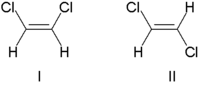
La molécula I es cis -1,2-dicloroeteno y la molécula II es trans -1,2-dicloroeteno. Debido a una ambigüedad ocasional, la IUPAC adoptó un sistema más riguroso en el que a los sustituyentes en cada extremo del doble enlace se les asigna prioridad en función de su número atómico . Si los sustituyentes de alta prioridad están en el mismo lado del enlace, se le asigna Z (en alemán zusammen , juntos). Si están en lados opuestos, es E (ger. entgegen , opuesto). [8] Dado que el cloro tiene un número atómico mayor que el hidrógeno, es el grupo de mayor prioridad. [9] Usando esta notación para nombrar las moléculas que se muestran arriba, la molécula I es (Z)-1,2-dicloroeteno y la molécula II es (E)-1,2-dicloroeteno. No es cierto que Z y cis o E y trans sean siempre intercambiables. Considere el siguiente fluorometilpenteno:
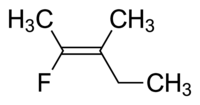
El nombre propio de esta molécula es trans -2-fluoro-3-metilpent-2-eno porque los grupos alquilo que forman la cadena principal (es decir, metilo y etilo) residen uno frente al otro en el doble enlace, o (Z) -2-fluoro-3-metilpent-2-eno porque los grupos de mayor prioridad a cada lado del doble enlace están en el mismo lado del doble enlace. El fluoro es el grupo de mayor prioridad en el lado izquierdo del doble enlace y el etilo es el grupo de mayor prioridad en el lado derecho de la molécula.
Los términos cis y trans también se utilizan para describir la posición relativa de dos sustituyentes en un anillo; cis si está del mismo lado, en caso contrario trans . [10] [11] [12]
La isomería conformacional es una forma de isomería que describe el fenómeno de moléculas con la misma fórmula estructural pero con diferentes formas debido a rotaciones alrededor de uno o más enlaces. [13] [14] [15] Diferentes conformaciones pueden tener diferentes energías, generalmente pueden interconvertirse y muy raramente son aislables. Por ejemplo, existe una variedad de conformaciones de ciclohexano (cuyo ciclohexano es un intermedio esencial para la síntesis de nailon-6,6), incluida una conformación de silla donde cuatro de los átomos de carbono forman el "asiento" de la silla, un átomo de carbono es el "respaldo" de la silla y un átomo de carbono es el "reposapiés"; y una conformación de barco , la conformación de barco representa el máximo de energía en un itinerario conformacional entre las dos formas de silla equivalentes; sin embargo, no representa el estado de transición para este proceso, porque existen vías de menor energía. La inversión conformacional de ciclohexanos sustituidos es un proceso muy rápido a temperatura ambiente, con una vida media de 0,00001 segundos. [16] [17]
Hay algunas moléculas que pueden aislarse en varias conformaciones, debido a las grandes barreras energéticas entre las diferentes conformaciones. Los bifenilos 2,2',6,6'-tetrasustituidos pueden encajar en esta última categoría.
El anomerismo es una identidad para estructuras de anillos con enlaces simples donde "cis" o "Z" y "trans" o "E" (isomerismo geométrico) necesitan nombrar las sustituciones en un átomo de carbono que también muestra la identidad de quiralidad; por lo que los anómeros tienen átomos de carbono que tienen isomería geométrica e isomería óptica ( enantiomerismo ) en uno o más de los carbonos del anillo. [18] [19] [20] [21] Los anómeros se denominan "alfa" o "axial" y "beta" o "ecuatorial" cuando se sustituye una estructura de anillo cíclico que tiene enlaces simples entre los átomos de carbono del anillo, por ejemplo, un grupo hidroxilo, un grupo metilhidroxilo, un grupo metoxi u otro grupo piranosa o furanosa que son sustituciones típicas de enlaces simples pero no se limitan a estas. [22] La isomería geométrica axial será perpendicular (90 grados) a un plano de referencia y la ecuatorial estará a 120 grados de distancia del enlace axial o se desviará 30 grados del plano de referencia. [23]
Los atropisómeros son estereoisómeros que resultan de la rotación impedida alrededor de enlaces simples donde la barrera de tensión estérica a la rotación es lo suficientemente alta como para permitir el aislamiento de los confórmeros. [24] [25]
La regla de Le Bel-van't Hoff establece que para una estructura con n átomos de carbono asimétricos , hay un máximo de 2 n estereoisómeros diferentes posibles. Por ejemplo, la D -glucosa es una aldohexosa y tiene la fórmula C 6 H 12 O 6 . Cuatro de sus seis átomos de carbono son estereogénicos, lo que significa que la D -glucosa es uno de los 2 4 =16 posibles estereoisómeros. [26] [27]