Las esponjas o esponjas marinas son miembros del filo metazoario Porifera [3] ( / p ə ˈ r ɪ f ər ə ˌ p ɔː - / pər- IF -ər-ə, por- ; que significa 'portador de poros'), [4] un clado animal basal y un taxón hermano de los diploblastos . [5] Son filtradores sésiles que están ligados al lecho marino y son uno de los miembros más antiguos del macrobentos , con muchas especies históricas que son importantes organismos constructores de arrecifes .
Las esponjas son organismos multicelulares que consisten en un mesohilo gelatinoso intercalado entre dos capas delgadas de células , y generalmente tienen cuerpos en forma de tubo llenos de poros y canales que permiten que el agua circule a través de ellos. Tienen células no especializadas que pueden transformarse en otros tipos y que a menudo migran entre las capas celulares principales y el mesohilo en el proceso. No tienen sistemas nerviosos , [6] digestivos o circulatorios complejos . En cambio, la mayoría depende de mantener un flujo de agua constante a través de sus cuerpos para obtener alimentos y oxígeno y eliminar desechos, generalmente a través de movimientos de flagelos de las llamadas " células de collar ".
Se cree que las esponjas son algunos de los animales más basales que existen en la actualidad y posiblemente fueron el primer grupo externo que se ramificó a partir del árbol evolutivo a partir del último ancestro común de todos los animales , [5] con evidencia fósil de esponjas primitivas como Otavia desde el período Toniano (alrededor de 800 millones de años atrás ). La rama de la zoología que estudia las esponjas se conoce como espongiología . [7]
El término esponja deriva de la palabra griega antigua σπόγγος spóngos . [8] El nombre científico Porifera es un plural neutro del término latino moderno porifer , que proviene de las raíces porus que significa "poro, abertura", y -fer que significa "que lleva o lleva".

Las esponjas son similares a otros animales en que son multicelulares , heterótrofas , carecen de paredes celulares y producen espermatozoides . A diferencia de otros animales, carecen de verdaderos tejidos [9] y órganos . [10] Algunas de ellas son radialmente simétricas, pero la mayoría son asimétricas. Las formas de sus cuerpos están adaptadas para la máxima eficiencia del flujo de agua a través de la cavidad central, donde el agua deposita nutrientes y luego sale a través de un orificio llamado ósculo . Los coanoflagelados unicelulares se parecen a las células coanocitos de las esponjas que se utilizan para impulsar sus sistemas de flujo de agua y capturar la mayor parte de su alimento. Esto, junto con los estudios filogenéticos de las moléculas ribosómicas, se han utilizado como evidencia morfológica para sugerir que las esponjas son el grupo hermano del resto de animales. [11] Una gran mayoría son especies marinas (de agua salada), que varían en hábitat desde zonas de mareas hasta profundidades superiores a los 8.800 m (5,5 mi), aunque hay especies de agua dulce. Todas las esponjas adultas son sésiles , lo que significa que se adhieren a una superficie submarina y permanecen fijas en el lugar (es decir, no se desplazan). Mientras están en su etapa larvaria , son móviles .
Muchas esponjas tienen esqueletos internos de espículas (fragmentos similares a esqueletos de carbonato de calcio o dióxido de silicio ) y/o espongina (un tipo modificado de proteína de colágeno). [9] Una matriz gelatinosa interna llamada mesohilo funciona como un endoesqueleto , y es el único esqueleto en esponjas blandas que incrusta superficies duras como rocas. Más comúnmente, el mesohilo está endurecido por espículas minerales , por fibras de espongina o ambas. El 90% de todas las especies de esponjas conocidas que tienen la gama más amplia de hábitats, incluidos todos los de agua dulce, son demosponjas que usan espongina; muchas especies tienen espículas de sílice , mientras que algunas especies tienen exoesqueletos de carbonato de calcio . Las esponjas calcáreas tienen espículas de carbonato de calcio y, en algunas especies, exoesqueletos de carbonato de calcio, están restringidas a aguas marinas relativamente poco profundas donde la producción de carbonato de calcio es más fácil. [12] : 179 Las frágiles esponjas vítreas , con " andamiaje " de espículas de sílice, están restringidas a las regiones polares y las profundidades oceánicas donde los depredadores son raros. Se han encontrado fósiles de todos estos tipos en rocas que datan de hace 580 millones de años . Además, los Archaeocyathids , cuyos fósiles son comunes en rocas de hace 530 a 490 millones de años , ahora se consideran un tipo de esponja.
Aunque la mayoría de las aproximadamente 5.000 a 10.000 especies conocidas de esponjas se alimentan de bacterias y otros alimentos microscópicos en el agua, algunas albergan microorganismos fotosintéticos como endosimbiontes , y estas alianzas a menudo producen más alimento y oxígeno del que consumen. Unas pocas especies de esponjas que viven en entornos pobres en alimentos han evolucionado como carnívoros que se alimentan principalmente de pequeños crustáceos . [13]
La mayoría de las esponjas se reproducen sexualmente , pero también pueden hacerlo asexualmente. Las especies que se reproducen sexualmente liberan espermatozoides en el agua para fertilizar los óvulos liberados o retenidos por su pareja o "madre"; los huevos fertilizados se convierten en larvas que nadan en busca de lugares donde establecerse. [12] : 183–185 Las esponjas son conocidas por regenerarse a partir de fragmentos que se rompen, aunque esto solo funciona si los fragmentos incluyen los tipos correctos de células. Algunas especies se reproducen por gemación. Cuando las condiciones ambientales se vuelven menos hospitalarias para las esponjas, por ejemplo, cuando bajan las temperaturas, muchas especies de agua dulce y algunas marinas producen gémulas , "cápsulas de supervivencia" de células no especializadas que permanecen inactivas hasta que las condiciones mejoran; luego forman esponjas completamente nuevas o recolonizan los esqueletos de sus padres. [12] : 120–127

Las pocas especies de demosponja que tienen esqueletos fibrosos completamente blandos sin elementos duros han sido utilizadas por los humanos durante miles de años para varios propósitos, incluyendo como relleno y como herramientas de limpieza. Sin embargo, en la década de 1950, estas se habían sobreexplotado tanto que la industria casi colapsó, y la mayoría de los materiales similares a las esponjas ahora son sintéticos. Las esponjas y sus endosimbiontes microscópicos ahora se están investigando como posibles fuentes de medicamentos para tratar una amplia gama de enfermedades. Se ha observado a delfines usando esponjas como herramientas mientras buscan alimento . [15]
Las esponjas constituyen el filo Porifera y se han definido como metazoos sésiles (animales inmóviles multicelulares) que tienen aberturas de entrada y salida de agua conectadas por cámaras revestidas de coanocitos , células con flagelos en forma de látigo. [12] : 29 Sin embargo, algunas esponjas carnívoras han perdido estos sistemas de flujo de agua y los coanocitos. [12] : 39 [16] Todas las esponjas vivas conocidas pueden remodelar sus cuerpos, ya que la mayoría de los tipos de sus células pueden moverse dentro de sus cuerpos y algunas pueden cambiar de un tipo a otro. [16] [17]
Aunque algunas esponjas son capaces de producir moco (que actúa como barrera microbiana en todos los demás animales), no se ha registrado ninguna esponja con la capacidad de secretar una capa de moco funcional. Sin dicha capa de moco, su tejido vivo está cubierto por una capa de simbiontes microbianos, que pueden contribuir hasta con un 40-50% de la masa húmeda de la esponja. Esta incapacidad para evitar que los microbios penetren en su tejido poroso podría ser una de las principales razones por las que nunca han desarrollado una anatomía más compleja. [18]
Al igual que los cnidarios (medusas, etc.) y los ctenóforos (medusas peine), y a diferencia de todos los demás metazoos conocidos, los cuerpos de las esponjas consisten en una masa gelatinosa no viviente ( mesohilo ) intercalada entre dos capas principales de células. [19] [20] Los cnidarios y los ctenóforos tienen sistemas nerviosos simples, y sus capas de células están unidas por conexiones internas y al estar montadas sobre una membrana basal (estera fibrosa delgada, también conocida como " lámina basal "). [20] Las esponjas no tienen un sistema nervioso similar al de los vertebrados, pero pueden tener uno bastante diferente. [6] Sus capas intermedias gelatinosas tienen poblaciones grandes y variadas de células, y algunos tipos de células en sus capas externas pueden moverse a la capa intermedia y cambiar sus funciones. [17]
El cuerpo de una esponja es hueco y se mantiene en forma gracias al mesohilo , una sustancia gelatinosa compuesta principalmente de colágeno y reforzada por una densa red de fibras también compuestas de colágeno. Se han identificado 18 tipos de células distintas. [23] La superficie interna está cubierta de coanocitos , células con collares cilíndricos o cónicos que rodean un flagelo por coanocito. El movimiento ondulatorio de los flagelos en forma de látigo impulsa el agua a través del cuerpo de la esponja. Todas las esponjas tienen ostios , canales que conducen al interior a través del mesohilo, y en la mayoría de las esponjas estos están controlados por porocitos en forma de tubo que forman válvulas de entrada cerrables. Los pinacocitos , células en forma de placa, forman una piel externa de una sola capa sobre todas las demás partes del mesohilo que no están cubiertas por coanocitos, y los pinacocitos también digieren partículas de alimentos que son demasiado grandes para entrar en los ostios, [17] [19] mientras que los de la base del animal son responsables de anclarlo. [19]
Otros tipos de células viven y se mueven dentro del mesohilo: [17] [19]
Muchas larvas de esponjas poseen ojos sin neuronas que se basan en criptocromos y que median el comportamiento fototáxico. [24]
Las esponjas de vidrio presentan una variación distintiva de este plan básico. Sus espículas, que están hechas de sílice , forman un armazón similar a un andamiaje entre cuyas varillas se suspende el tejido vivo como una telaraña que contiene la mayoría de los tipos de células. [17] Este tejido es un sincitio que en algunos aspectos se comporta como muchas células que comparten una sola membrana externa , y en otros como una sola célula con múltiples núcleos .
La mayoría de las esponjas funcionan como chimeneas : toman agua por la parte inferior y la expulsan por el ósculo de la parte superior. Como las corrientes ambientales son más rápidas en la parte superior, el efecto de succión que producen según el principio de Bernoulli hace parte del trabajo de forma gratuita. Las esponjas pueden controlar el flujo de agua mediante diversas combinaciones de cierre total o parcial del ósculo y los ostios (los poros de entrada) y variación del ritmo de los flagelos, y pueden detenerlo si hay mucha arena o limo en el agua. [17]
Aunque las capas de pinacocitos y coanocitos se parecen a los epitelios de animales más complejos, no están unidas firmemente por conexiones entre células ni por una lámina basal (capa fibrosa delgada debajo). La flexibilidad de estas capas y la remodelación del mesohilo por parte de los lofocitos permiten a los animales ajustar sus formas a lo largo de sus vidas para aprovechar al máximo las corrientes de agua locales. [17] : 83
La estructura corporal más simple de las esponjas es una forma de tubo o vaso conocida como "asconoide", pero esto limita severamente el tamaño del animal. La estructura corporal se caracteriza por un espongocele con forma de tallo rodeado por una sola capa de coanocitos. Si simplemente se amplía, la relación entre su volumen y su área de superficie aumenta, porque la superficie aumenta con el cuadrado de la longitud o el ancho, mientras que el volumen aumenta proporcionalmente al cubo. La cantidad de tejido que necesita alimento y oxígeno está determinada por el volumen, pero la capacidad de bombeo que suministra alimento y oxígeno depende del área cubierta por coanocitos. Las esponjas asconoides rara vez superan 1 mm (0,039 pulgadas) de diámetro. [17]
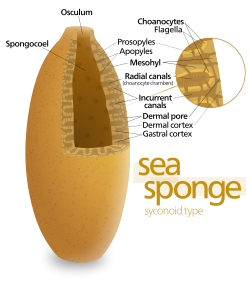
Algunas esponjas superan esta limitación adoptando la estructura "siconoide", en la que la pared del cuerpo está plegada . Las bolsas internas de los pliegues están revestidas de coanocitos, que se conectan con las bolsas externas de los pliegues mediante ostios. Este aumento en el número de coanocitos y, por lo tanto, en la capacidad de bombeo permite que las esponjas siconoides crezcan hasta unos pocos centímetros de diámetro.
El patrón "leuconoide" aumenta aún más la capacidad de bombeo al llenar el interior casi por completo con mesohilo que contiene una red de cámaras revestidas de coanocitos y conectadas entre sí y con las entradas y salidas de agua mediante tubos. Las esponjas leucónidas crecen hasta más de 1 m (3,3 pies) de diámetro, y el hecho de que el crecimiento en cualquier dirección aumente el número de cámaras de coanocitos les permite adoptar una gama más amplia de formas, por ejemplo, esponjas "incrustantes" cuyas formas siguen las de las superficies a las que se adhieren. Todas las esponjas de agua dulce y la mayoría de las esponjas marinas de aguas poco profundas tienen cuerpos leucónidos. Las redes de pasajes de agua en las esponjas de vidrio son similares a la estructura leucónida. [17]
En los tres tipos de estructura, el área de la sección transversal de las regiones revestidas de coanocitos es mucho mayor que la de los canales de entrada y salida. Esto hace que el flujo sea más lento cerca de los coanocitos y, por lo tanto, les facilita atrapar partículas de comida. [17] Por ejemplo, en Leuconia , una pequeña esponja leuconoide de unos 10 centímetros (3,9 pulgadas) de alto y 1 centímetro (0,39 pulgadas) de diámetro, el agua ingresa a cada uno de los más de 80.000 canales de entrada a 6 cm por minuto . Sin embargo, debido a que Leuconia tiene más de 2 millones de cámaras flageladas cuyo diámetro combinado es mucho mayor que el de los canales, el flujo de agua a través de las cámaras se reduce a 3,6 cm por hora , lo que facilita que los coanocitos capturen alimentos. Toda el agua se expulsa a través de un solo ósculo a unos 8,5 cm por segundo , lo suficientemente rápido como para llevar los productos de desecho a cierta distancia. [26]

En zoología, un esqueleto es cualquier estructura bastante rígida de un animal, independientemente de si tiene articulaciones y de si está biomineralizado . El mesohilo funciona como un endoesqueleto en la mayoría de las esponjas y es el único esqueleto en esponjas blandas que se incrusta en superficies duras como rocas. Más comúnmente, el mesohilo está endurecido por espículas minerales , por fibras de espongina o ambas. Las espículas, que están presentes en la mayoría de las especies, pero no en todas, [27] pueden estar hechas de sílice o carbonato de calcio y varían en forma desde simples varillas hasta "estrellas" tridimensionales con hasta seis radios. Las espículas son producidas por células esclerocíticas [17] y pueden estar separadas, conectadas por articulaciones o fusionadas. [16]
Algunas esponjas también secretan exoesqueletos que se encuentran completamente fuera de sus componentes orgánicos. Por ejemplo, las escleroesponjas ("esponjas duras") tienen exoesqueletos masivos de carbonato de calcio sobre los cuales la materia orgánica forma una capa delgada con cámaras de coanocitos en fosas en el mineral. Estos exoesqueletos son secretados por los pinacocitos que forman la piel de los animales. [17]

Aunque las esponjas adultas son animales fundamentalmente sésiles , algunas especies marinas y de agua dulce pueden desplazarse por el lecho marino a velocidades de 1 a 4 mm (0,039 a 0,157 pulgadas) por día, como resultado de movimientos similares a los de las amebas de los pinacocitos y otras células. Algunas especies pueden contraer todo su cuerpo y muchas pueden cerrar sus ósculos y ostias. Los juveniles flotan o nadan libremente, mientras que los adultos permanecen estacionarios. [17]

Las esponjas no tienen sistemas circulatorio , respiratorio , digestivo y excretor diferenciados ; en cambio, el sistema de flujo de agua respalda todas estas funciones. Filtran partículas de alimentos del agua que fluye a través de ellas. Las partículas mayores de 50 micrómetros no pueden ingresar a los ostia y los pinacocitos las consumen por fagocitosis (engullimiento y digestión intracelular). Las partículas de 0,5 μm a 50 μm quedan atrapadas en los ostia, que se estrechan desde los extremos externos a los internos. Estas partículas son consumidas por los pinacocitos o por los arqueocitos que se extruyen parcialmente a través de las paredes de los ostia. Las partículas del tamaño de bacterias, por debajo de 0,5 micrómetros, pasan a través de los ostia y son capturadas y consumidas por los coanocitos . [17] Dado que las partículas más pequeñas son, con mucho, las más comunes, los coanocitos generalmente capturan el 80% del suministro de alimento de una esponja. [28] Los arqueocitos transportan alimentos envasados en vesículas desde las células que digieren directamente los alimentos a las que no lo hacen. Al menos una especie de esponja tiene fibras internas que funcionan como pistas para que las utilicen los arqueocitos que transportan nutrientes, [17] y estas pistas también mueven objetos inertes. [19]
Se solía afirmar que las esponjas de vidrio podían vivir de nutrientes disueltos en el agua de mar y eran muy reacias al limo. [29] Sin embargo, un estudio en 2007 no encontró evidencia de esto y concluyó que extraen bacterias y otros microorganismos del agua de manera muy eficiente (alrededor del 79%) y procesan granos de sedimento suspendidos para extraer dichas presas. [30] Los cuerpos de collar digieren el alimento y lo distribuyen envuelto en vesículas que son transportadas por moléculas "motoras" de dineína a lo largo de haces de microtúbulos que recorren todo el sincitio . [17]
Las células de las esponjas absorben el oxígeno por difusión desde el agua hacia el interior de las células a medida que el agua fluye a través del cuerpo, en el que también se difunden el dióxido de carbono y otros productos de desecho solubles como el amoníaco . Los arqueocitos eliminan las partículas minerales que amenazan con bloquear los ostios, las transportan a través del mesohilo y generalmente las vierten en la corriente de agua saliente, aunque algunas especies las incorporan a sus esqueletos. [17]

En aguas donde el suministro de partículas de alimento es muy pobre, algunas especies se alimentan de crustáceos y otros animales pequeños. Hasta ahora solo se han descubierto 137 especies. [32] La mayoría pertenecen a la familia Cladorhizidae , pero algunos miembros de Guitarridae y Esperiopsidae también son carnívoros. [33] En la mayoría de los casos, se sabe poco sobre cómo capturan realmente a sus presas, aunque se cree que algunas especies utilizan hilos pegajosos o espículas en forma de gancho . [33] [34] La mayoría de las esponjas carnívoras viven en aguas profundas, hasta 8.840 m (5,49 mi), [35] y se espera que el desarrollo de técnicas de exploración de aguas profundas conduzca al descubrimiento de varias más. [17] [33] Sin embargo, se ha encontrado una especie en cuevas mediterráneas a profundidades de 17 a 23 m (56 a 75 pies), junto con las esponjas filtradoras más habituales . Los depredadores que viven en cuevas capturan crustáceos de menos de 1 mm (0,039 pulgadas) de largo enredándolos con hilos finos, los digieren envolviéndolos con más hilos en el transcurso de unos días y luego vuelven a su forma normal; no hay evidencia de que usen veneno . [35]
La mayoría de las esponjas carnívoras conocidas han perdido por completo el sistema de flujo de agua y los coanocitos . Sin embargo, el género Chondrocladia utiliza un sistema de flujo de agua altamente modificado para inflar estructuras similares a globos que se utilizan para capturar presas. [33] [36]
Las esponjas de agua dulce a menudo albergan algas verdes como endosimbiontes dentro de arqueocitos y otras células y se benefician de los nutrientes producidos por las algas. Muchas especies marinas albergan otros organismos fotosintéticos , más comúnmente cianobacterias , pero en algunos casos dinoflagelados . Las cianobacterias simbióticas pueden formar un tercio de la masa total de tejido vivo en algunas esponjas, y algunas esponjas obtienen entre el 48% y el 80% de su suministro de energía de estos microorganismos. [17] En 2008, un equipo de la Universidad de Stuttgart informó que las espículas hechas de sílice conducen la luz hacia el mesohilo , donde viven los endosimbiontes fotosintéticos. [37] Las esponjas que albergan organismos fotosintéticos son más comunes en aguas con suministros relativamente pobres de partículas de alimentos y, a menudo, tienen formas de hojas que maximizan la cantidad de luz solar que recolectan. [19]
Una esponja carnívora recientemente descubierta que vive cerca de fuentes hidrotermales alberga bacterias que se alimentan de metano y digiere algunas de ellas. [19]
Las esponjas no tienen sistemas inmunológicos complejos como la mayoría de los demás animales. Sin embargo, rechazan los injertos de otras especies, pero los aceptan de otros miembros de su propia especie. En algunas especies marinas, las células grises desempeñan el papel principal en el rechazo de material extraño. Cuando son invadidas, producen una sustancia química que detiene el movimiento de otras células en el área afectada, impidiendo así que el intruso utilice los sistemas de transporte internos de la esponja. Si la intrusión persiste, las células grises se concentran en la zona y liberan toxinas que matan a todas las células de la zona. El sistema "inmunológico" puede permanecer en este estado activado hasta tres semanas. [19]

Las esponjas tienen tres métodos asexuales de reproducción: después de la fragmentación, por gemación y por producción de gémulas . Los fragmentos de esponjas pueden desprenderse por corrientes u olas. Utilizan la movilidad de sus pinacocitos y coanocitos y la remodelación del mesohilo para volver a adherirse a una superficie adecuada y luego reconstruirse como esponjas pequeñas pero funcionales en el transcurso de varios días. Las mismas capacidades permiten que las esponjas que han sido exprimidas a través de una tela fina se regeneren. [17] : 239 Un fragmento de esponja solo puede regenerarse si contiene tanto colencitos para producir mesohilo como arqueocitos para producir todos los demás tipos de células. [28] Muy pocas especies se reproducen por gemación. [17] : 90–94
Las gémulas son "cápsulas de supervivencia" que algunas esponjas marinas y muchas especies de agua dulce producen por miles cuando mueren y que algunas, principalmente especies de agua dulce, producen regularmente en otoño. Los espongocitos forman gémulas envolviendo conchas de espongina, a menudo reforzadas con espículas, racimos redondos de arqueocitos que están llenos de nutrientes. [17] : 87–88 Las gémulas de agua dulce también pueden incluir simbiontes fotosintetizadores. [38] Las gémulas luego se vuelven inactivas, y en este estado pueden sobrevivir al frío, la desecación, la falta de oxígeno y las variaciones extremas en la salinidad . [17] Las gémulas de agua dulce a menudo no reviven hasta que la temperatura baja, permanece fría durante unos meses y luego alcanza un nivel casi "normal". [38] Cuando una gémula germina, los arqueocitos que rodean el exterior del grupo se transforman en pinacocitos , una membrana sobre un poro en la concha estalla, el grupo de células emerge lentamente y la mayoría de los arqueocitos restantes se transforman en otros tipos de células necesarios para formar una esponja funcional. Las gémulas de la misma especie pero de diferentes individuos pueden unir fuerzas para formar una esponja. [17] : 89–90 Algunas gémulas se conservan dentro de la esponja madre y en primavera puede ser difícil saber si una esponja vieja ha revivido o ha sido "recolonizada" por sus propias gémulas. [38]
La mayoría de las esponjas son hermafroditas (funcionan como ambos sexos simultáneamente), aunque las esponjas no tienen gónadas (órganos reproductivos). Los espermatozoides son producidos por coanocitos o cámaras coanocitos completas que se hunden en el mesohilo y forman quistes espermáticos, mientras que los óvulos se forman por transformación de arqueocitos , o de coanocitos en algunas especies. Cada óvulo generalmente adquiere una yema al consumir "células nodrizas". Durante el desove, los espermatozoides salen de sus quistes y son expulsados a través del ósculo . Si entran en contacto con otra esponja de la misma especie, el flujo de agua los lleva a los coanocitos que los engullen pero, en lugar de digerirlos, se metamorfosean a una forma ameboide y llevan el esperma a través del mesohilo hasta los óvulos, que en la mayoría de los casos engullen al portador y su carga. [17] : 77
Algunas especies liberan huevos fertilizados en el agua, pero la mayoría retiene los huevos hasta que eclosionan. Al retener los huevos, los padres pueden transferir microorganismos simbióticos directamente a su descendencia a través de la transmisión vertical , mientras que la especie que libera sus huevos en el agua tiene que adquirir simbiontes horizontalmente (una combinación de ambos es probablemente lo más común, donde las larvas con simbiontes transmitidos verticalmente también adquieren otros horizontalmente). [39] [40] Hay cuatro tipos de larvas, pero todas son bolas de células lecitotróficas (no alimenticias) con una capa externa de células cuyos flagelos o cilios permiten que las larvas se muevan. Después de nadar durante unos días, las larvas se hunden y se arrastran hasta que encuentran un lugar para establecerse. La mayoría de las células se transforman en arqueocitos y luego en los tipos apropiados para sus ubicaciones en una esponja adulta en miniatura. [17] : 77 [41]
Los embriones de esponja de vidrio comienzan dividiéndose en células separadas, pero una vez que se han formado 32 células, se transforman rápidamente en larvas que externamente son ovoides con una banda de cilios alrededor del medio que usan para moverse, pero internamente tienen la estructura típica de la esponja de vidrio de espículas con un sincitio principal en forma de telaraña que las rodea y entre ellas y coanosincitios con múltiples cuerpos de collar en el centro. Las larvas luego abandonan los cuerpos de sus padres. [42]
La progresión citológica de la ovogénesis y la espermatogénesis ( gametogénesis ) de los poríferos es muy similar a la de otros metazoos. [43] La mayoría de los genes del conjunto clásico de genes meióticos , incluidos los genes para la recombinación del ADN y la reparación de roturas de doble cadena, que se conservan en eucariotas se expresan en las esponjas (por ejemplo, Geodia hentscheli y Geodia phlegraei ). [43] Dado que se considera que los poríferos son los primeros animales divergentes, estos hallazgos indican que el conjunto de herramientas básico de la meiosis, incluidas las capacidades para la recombinación y la reparación del ADN, estaban presentes temprano en la evolución eucariota. [43]
Las esponjas de las regiones templadas viven como máximo unos pocos años, pero algunas especies tropicales y quizás algunas de las profundidades oceánicas pueden vivir 200 años o más. Algunas demosponjas calcificadas crecen sólo 0,2 mm (0,0079 pulgadas) por año y, si esa tasa es constante, los especímenes de 1 m (3,3 pies) de ancho deben tener unos 5.000 años. Algunas esponjas comienzan la reproducción sexual cuando sólo tienen unas pocas semanas de vida, mientras que otras esperan hasta que tienen varios años. [17]
Las esponjas adultas carecen de neuronas o cualquier otro tipo de tejido nervioso . Sin embargo, la mayoría de las especies tienen la capacidad de realizar movimientos coordinados en todo su cuerpo, principalmente contracciones de los pinacocitos , apretando los canales de agua y expulsando así el exceso de sedimento y otras sustancias que pueden causar bloqueos. Algunas especies pueden contraer el ósculo independientemente del resto del cuerpo. Las esponjas también pueden contraerse para reducir el área que es vulnerable al ataque de los depredadores. En los casos en que dos esponjas están fusionadas, por ejemplo si hay un brote grande pero aún no separado, estas ondas de contracción se coordinan lentamente en ambos " gemelos siameses ". El mecanismo de coordinación es desconocido, pero puede involucrar sustancias químicas similares a los neurotransmisores . [44] Sin embargo, las esponjas de vidrio transmiten rápidamente impulsos eléctricos a través de todas las partes del sincitio , y lo utilizan para detener el movimiento de sus flagelos si el agua entrante contiene toxinas o sedimento excesivo. [17] Se cree que los miocitos son responsables de cerrar el ósculo y de transmitir señales entre diferentes partes del cuerpo. [19]
Las esponjas contienen genes muy similares a los que contienen la "receta" para la densidad postsináptica , una importante estructura receptora de señales en las neuronas de todos los demás animales. Sin embargo, en las esponjas estos genes sólo se activan en las "células de frasco" que aparecen sólo en las larvas y pueden proporcionar cierta capacidad sensorial mientras las larvas están nadando. Esto plantea preguntas sobre si las células de frasco representan los predecesores de las neuronas verdaderas o son evidencia de que los antepasados de las esponjas tenían neuronas verdaderas pero las perdieron al adaptarse a un estilo de vida sésil. [45]
.jpg/440px-Euplectella_aspergillum_(cropped).jpg)
Las esponjas se distribuyen por todo el mundo y habitan en una amplia gama de hábitats oceánicos, desde las regiones polares hasta los trópicos. [28] La mayoría vive en aguas tranquilas y claras, porque los sedimentos agitados por las olas o las corrientes bloquearían sus poros, lo que les dificultaría alimentarse y respirar. [29] La mayor cantidad de esponjas se encuentra generalmente en superficies firmes como rocas, pero algunas esponjas pueden adherirse a sedimentos blandos por medio de una base similar a una raíz. [46]
Las esponjas son más abundantes pero menos diversas en aguas templadas que en aguas tropicales, posiblemente porque los organismos que se alimentan de esponjas son más abundantes en aguas tropicales. [47] Las esponjas de cristal son las más comunes en aguas polares y en las profundidades de los mares templados y tropicales, ya que su construcción muy porosa les permite extraer alimento de estas aguas pobres en recursos con el mínimo esfuerzo. Las demosponjas y las esponjas calcáreas son abundantes y diversas en aguas no polares menos profundas. [48]
Las diferentes clases de esponjas viven en diferentes rangos de hábitat:
Las esponjas con endosimbiontes fotosintetizadores producen hasta tres veces más oxígeno del que consumen, así como más materia orgánica de la que consumen. Estas contribuciones a los recursos de sus hábitats son significativas a lo largo de la Gran Barrera de Coral de Australia , pero relativamente menores en el Caribe. [28]


Muchas esponjas desprenden espículas , formando una densa alfombra de varios metros de profundidad que mantiene alejados a los equinodermos que de otro modo se alimentarían de ellas. [28] También producen toxinas que impiden que otros organismos sésiles, como los briozoos o las ascidias, crezcan sobre ellas o cerca de ellas, lo que convierte a las esponjas en competidores muy eficaces por el espacio vital. Uno de los muchos ejemplos incluye la ageliferina .
Algunas especies, como la esponja de fuego del Caribe Tedania ignis , causan una erupción cutánea grave en los seres humanos que las manipulan. [17] Las tortugas y algunos peces se alimentan principalmente de esponjas. A menudo se dice que las esponjas producen defensas químicas contra estos depredadores. [17] Sin embargo, los experimentos no han podido establecer una relación entre la toxicidad de los productos químicos producidos por las esponjas y el sabor que tienen para los peces, lo que disminuiría la utilidad de las defensas químicas como elementos disuasorios. La depredación por parte de los peces puede incluso ayudar a esparcir las esponjas al desprender fragmentos. [19] Sin embargo, algunos estudios han demostrado que los peces muestran una preferencia por las esponjas que no tienen defensas químicas, [49] y otro estudio encontró que los altos niveles de depredación de corales sí predecían la presencia de especies con defensas químicas. [50]
Las esponjas de vidrio no producen sustancias químicas tóxicas y viven en aguas muy profundas donde los depredadores son raros. [29]
Las moscas esponja, también conocidas como moscas esponja ( Neuroptera , Sisyridae ), son depredadores especializados de esponjas de agua dulce. La hembra pone sus huevos en la vegetación que sobresale del agua. Las larvas eclosionan y caen al agua, donde buscan esponjas de las que alimentarse. Utilizan sus piezas bucales alargadas para perforar la esponja y succionar los fluidos que contiene. Las larvas de algunas especies se adhieren a la superficie de la esponja, mientras que otras se refugian en las cavidades internas de la esponja. Las larvas completamente desarrolladas abandonan el agua y tejen un capullo en el que pupan. [51]
La esponja de hígado de pollo del Caribe Chondrilla nucula secreta toxinas que matan a los pólipos de coral , lo que permite que las esponjas crezcan sobre los esqueletos de coral. [17] Otras, especialmente en la familia Clionaidae , utilizan sustancias corrosivas secretadas por sus arqueocitos para hacer túneles en rocas, corales y las conchas de moluscos muertos . [17] Las esponjas pueden eliminar hasta 1 m (3,3 pies) por año de los arrecifes, creando muescas visibles justo debajo del nivel de marea baja. [28]
Las esponjas caribeñas del género Aplysina sufren el síndrome de la banda roja de Aplysina. Esto hace que Aplysina desarrolle una o más bandas de color óxido, a veces con bandas adyacentes de tejido necrótico . Estas lesiones pueden rodear completamente las ramas de la esponja. La enfermedad parece ser contagiosa y afecta aproximadamente al 10 por ciento de A. cauliformis en los arrecifes de las Bahamas. [52] Las bandas de color óxido son causadas por una cianobacteria , pero se desconoce si este organismo realmente causa la enfermedad. [52] [53]
Además de albergar endosimbiontes fotosintéticos, [17] las esponjas son conocidas por su amplia gama de colaboraciones con otros organismos. La esponja incrustante relativamente grande Lissodendoryx colombiensis es más común en superficies rocosas, pero ha extendido su área de distribución a praderas marinas al dejarse rodear o cubrir por esponjas marinas, que son desagradables para las estrellas de mar locales y por lo tanto protegen a Lissodendoryx contra ellas; a cambio, las esponjas marinas obtienen posiciones más altas lejos del sedimento del fondo marino. [54]
Los camarones del género Synalpheus forman colonias en esponjas, y cada especie de camarón habita en una especie de esponja diferente, lo que convierte a Synalpheus en uno de los géneros de crustáceos más diversos . Específicamente, Synalpheus regalis utiliza la esponja no solo como fuente de alimento, sino también como defensa contra otros camarones y depredadores. [55] Hasta 16.000 individuos habitan en una sola esponja boba , alimentándose de las partículas más grandes que se acumulan en la esponja mientras filtra el océano para alimentarse. [56] Otros crustáceos, como los cangrejos ermitaños, comúnmente tienen una especie específica de esponja, Pseudospongosorites , que crece en ellos ya que tanto la esponja como el cangrejo ocupan caparazones de gasterópodos hasta que el cangrejo y la esponja superan el tamaño del caparazón, lo que finalmente resulta en que el cangrejo use el cuerpo de la esponja como protección en lugar del caparazón hasta que el cangrejo encuentra un caparazón de reemplazo adecuado. [57]

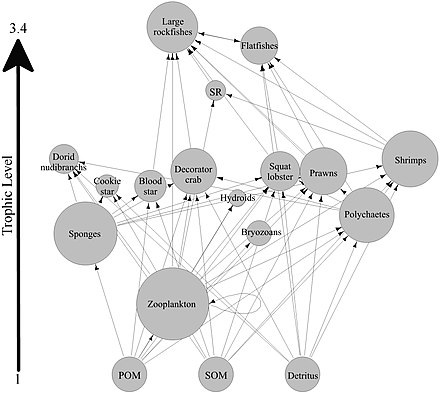
La mayoría de las esponjas son detritívoros que filtran partículas de desechos orgánicos y formas de vida microscópicas del agua del océano. En particular, las esponjas desempeñan un papel importante como detritívoros en las redes alimentarias de los arrecifes de coral al reciclar los detritos a niveles tróficos superiores . [60]
Se ha planteado la hipótesis de que las esponjas de arrecifes de coral facilitan la transferencia de materia orgánica derivada de los corales a sus detritívoros asociados a través de la producción de detritos de esponja, como se muestra en el diagrama. Varias especies de esponjas son capaces de convertir la materia orgánica derivada de los corales en detritos de esponja, [61] [62] y transferir materia orgánica producida por los corales más arriba en la red alimentaria del arrecife. Los corales liberan materia orgánica tanto en forma de moco disuelto como en partículas, [63] [64] [65] [66] así como material celular como el Symbiodinium expulsado . [67] [68] [60]
La materia orgánica podría ser transferida de los corales a las esponjas por todas estas vías, pero la DOM probablemente constituye la fracción más grande, ya que la mayoría (56 a 80%) del moco de coral se disuelve en la columna de agua, [64] y la pérdida de carbono fijado por los corales debido a la expulsión de Symbiodinium es típicamente insignificante (0,01%) [67] en comparación con la liberación de moco (hasta ~40%). [69] [70] La materia orgánica derivada de los corales también podría transferirse indirectamente a las esponjas a través de bacterias, que también pueden consumir el moco de coral. [71] [72] [73] [60]


Además de una relación simbiótica uno a uno , es posible que un huésped se vuelva simbiótico con un consorcio microbiano , lo que da como resultado un microbioma de esponja diverso . Las esponjas pueden albergar una amplia gama de comunidades microbianas que también pueden ser muy específicas. Las comunidades microbianas que forman una relación simbiótica con la esponja pueden representar hasta el 35% de la biomasa de su huésped. [76] El término para esta relación simbiótica específica, donde un consorcio microbiano se empareja con un huésped, se llama relación holobiótica . La esponja, así como la comunidad microbiana asociada con ella, producirán una amplia gama de metabolitos secundarios que ayudan a protegerla contra los depredadores a través de mecanismos como la defensa química . [77]
Algunas de estas relaciones incluyen endosimbiontes dentro de las células bacteriocitos y cianobacterias o microalgas que se encuentran debajo de la capa de células pinacodermo donde pueden recibir la mayor cantidad de luz, utilizada para la fototrofia. Pueden albergar más de 50 filos microbianos diferentes y filos candidatos, incluidos Alphaprotoebacteria, Actinomycetota , Chloroflexota , Nitrospirota , " Cyanobacteria ", los taxones Gamma-, el filo candidato Poribacteria y Thaumarchaea . [77]
Carl Linnaeus , quien clasificó la mayoría de los tipos de animales sésiles como pertenecientes al orden Zoophyta en la clase Vermes , identificó erróneamente al género Spongia como plantas en el orden Algae . [78] [ se necesita más explicación ] Durante mucho tiempo después, las esponjas fueron asignadas al subreino Parazoa ("al lado de los animales") separado de Eumetazoa que formaba el resto del reino Animalia . [79] Se las ha considerado como un filo parafilético , del cual han evolucionado los animales superiores. [80] Otras investigaciones indican que Porifera es monofilético. [81]
El filo Porifera se divide además en clases, principalmente según la composición de sus esqueletos : [16] [28]
En la década de 1970, las esponjas con esqueletos masivos de carbonato de calcio fueron asignadas a una clase separada, Sclerospongiae , también conocidas como "esponjas coralinas". [82] Sin embargo, en la década de 1980 se descubrió que todas ellas eran miembros de Calcarea o Demospongiae. [83]
Hasta el momento, las publicaciones científicas han identificado alrededor de 9.000 especies de poríferos, [28] de las cuales: alrededor de 400 son esponjas vítreas; alrededor de 500 son especies calcáreas; y el resto son demosponjas. [17] Sin embargo, algunos tipos de hábitat, rocas verticales y paredes de cuevas y galerías en rocas y cantos rodados de coral, han sido muy poco investigados, incluso en mares poco profundos. [28]
Las esponjas se distribuían tradicionalmente en tres clases: esponjas calcáreas (Calcarea), esponjas vítreas (Hexactinellida) y demosponjas (Demospongiae). Sin embargo, estudios recientes han demostrado que los Homoscleromorpha , un grupo que se cree que pertenece a los Demospongiae , tienen una relación genética bien separada de otras clases de esponjas. [12] : 153–154 Por lo tanto, recientemente se las ha reconocido como la cuarta clase de esponjas. [84] [85]
Las esponjas se dividen en clases principalmente de acuerdo a la composición de sus esqueletos : [19] Estas están organizadas en orden evolutivo como se muestra a continuación en orden ascendente de su evolución de arriba a abajo:


Aunque los relojes moleculares y los biomarcadores sugieren que las esponjas existían mucho antes de la explosión de vida del Cámbrico, las espículas de sílice como las de las demosponjas están ausentes del registro fósil hasta el Cámbrico. [87] Existe un informe no confirmado de 2002 de espículas en rocas que datan de hace unos 750 millones de años . [88] Se han encontrado esponjas fósiles bien conservadas de hace unos 580 millones de años en el período Ediacárico en la Formación Doushantuo . [89] Estos fósiles, que incluyen: espículas; pinacocitos ; porocitos ; arqueocitos ; esclerocitos ; y la cavidad interna, se han clasificado como demosponjas. Se han encontrado fósiles de esponjas de vidrio de hace unos 540 millones de años en rocas de Australia, China y Mongolia. [90] Las esponjas del Cámbrico Temprano de México pertenecientes al género Kiwetinokia muestran evidencia de fusión de varias espículas más pequeñas para formar una sola espícula grande. [91] Se han encontrado espículas de carbonato de calcio de esponjas calcáreas en rocas del Cámbrico Temprano de hace unos 530 a 523 millones de años en Australia. Se han encontrado otras probables demosponjas en la fauna de Chengjiang del Cámbrico Temprano , de hace 525 a 520 millones de años . [92] Los fósiles encontrados en los Territorios del Noroeste de Canadá que datan de hace 890 millones de años pueden ser esponjas; si este hallazgo se confirma, sugiere que los primeros animales aparecieron antes del evento de oxigenación del Neoproterozoico. [93]
Las esponjas de agua dulce parecen ser mucho más jóvenes, ya que los primeros fósiles conocidos datan del período Eoceno medio, hace unos 48 a 40 millones de años . [90] Aunque aproximadamente el 90% de las esponjas modernas son demosponjas , los restos fosilizados de este tipo son menos comunes que los de otros tipos porque sus esqueletos están compuestos de espongina relativamente blanda que no se fosiliza bien. [94] Los primeros simbiontes de esponjas se conocen desde el Silúrico temprano . [95]
Un trazador químico es el 24-isopropil colestano , que es un derivado estable del 24-isopropil colesterol , que se dice que es producido por las demosponjas pero no por los eumetazoos ("animales verdaderos", es decir, cnidarios y bilaterales ). Dado que se cree que los coanoflagelados son los parientes unicelulares más cercanos de los animales, un equipo de científicos examinó la bioquímica y los genes de una especie de coanoflagelado . Llegaron a la conclusión de que esta especie no podía producir 24-isopropilcolesterol, pero que sería necesaria la investigación de una gama más amplia de coanoflagelados para demostrar que el 24-isopropilcolestano fósil solo podría haber sido producido por las demosponjas. [96] Aunque una publicación anterior informó rastros del químico 24-isopropil colestano en rocas antiguas que datan de hace 1.800 millones de años , [97] una investigación reciente que utilizó una serie de rocas datadas con mucha más precisión ha revelado que estos biomarcadores solo aparecen antes del final de la glaciación Marinoana hace aproximadamente 635 millones de años , [98] y que "el análisis de biomarcadores aún tiene que revelar alguna evidencia convincente de esponjas antiguas anteriores al primer episodio glacial neoproterozoico globalmente extenso (el Sturtiano, hace ~713 millones de años en Omán)". Si bien se ha argumentado que este "biomarcador de esponja" podría haberse originado a partir de algas marinas, una investigación reciente sugiere que la capacidad de las algas para producir este biomarcador evolucionó solo en el Carbonífero ; como tal, el biomarcador sigue apoyando firmemente la presencia de demosponjas en el Criogénico. [99] [100] [101]
Los arqueociatídos , que algunos clasifican como un tipo de esponja coralina, son fósiles muy comunes en rocas del Cámbrico temprano hace unos 530 a 520 millones de años , pero aparentemente se extinguieron hacia el final del Cámbrico hace 490 millones de años . [92] Se ha sugerido que fueron producidos por: esponjas; cnidarios ; algas ; foraminíferos ; un filo completamente separado de animales, Archaeocyatha; o incluso un reino de vida completamente separado, etiquetado Archaeata o Inferibionta. Desde la década de 1990, los arqueociatídos han sido considerados un grupo distintivo de esponjas. [79]
Es difícil encajar a los cancilleridos en clasificaciones de esponjas o animales más complejos. Un análisis en 1996 concluyó que estaban estrechamente relacionados con las esponjas sobre la base de que la estructura detallada de las escleritas ("placas de armadura") de los cancilleridos es similar a la de las fibras de espongina, una proteína de colágeno , en las demosponjas queratosas (córneas) modernas como Darwinella . [103] Sin embargo, otro análisis en 2002 concluyó que los cancilleridos no son esponjas y pueden ser intermedios entre las esponjas y los animales más complejos, entre otras razones porque sus pieles eran más gruesas y estaban más estrechamente conectadas que las de las esponjas. [104] En 2008, un análisis detallado de las escleritas de los cancilleridos concluyó que eran muy similares a las de los halkieriidos , animales bilaterales móviles que parecían babosas en una cota de malla y cuyos fósiles se encuentran en rocas desde el Cámbrico Temprano hasta el Cámbrico Medio. Si esto es correcto, se crearía un dilema, ya que es extremadamente improbable que organismos totalmente no relacionados pudieran haber desarrollado escleritos tan similares de forma independiente, pero la enorme diferencia en las estructuras de sus cuerpos hace difícil ver cómo podrían estar estrechamente relacionados. [102]

En la década de 1990, las esponjas fueron ampliamente consideradas como un grupo monofilético , ya que todas ellas descendían de un ancestro común que era una esponja, y como el "grupo hermano" de todos los demás metazoos (animales multicelulares), que a su vez forman un grupo monofilético. Por otro lado, algunos análisis de la década de 1990 también revivieron la idea de que los parientes evolutivos más cercanos de los animales son los coanoflagelados , organismos unicelulares muy similares a los coanocitos de las esponjas , lo que implicaría que la mayoría de los metazoos evolucionaron a partir de ancestros muy similares a las esponjas y, por lo tanto, que las esponjas pueden no ser monofiléticas, ya que los mismos ancestros similares a las esponjas pueden haber dado lugar tanto a las esponjas modernas como a los miembros no esponjados de los metazoos. [105]
Los análisis realizados desde 2001 han concluido que los eumetazoos (más complejos que las esponjas) están más estrechamente relacionados con grupos particulares de esponjas que con otros grupos de esponjas. Tales conclusiones implican que las esponjas no son monofiléticas, porque el último ancestro común de todas las esponjas también sería un ancestro directo de los eumetazoos, que no son esponjas. Un estudio de 2001 basado en comparaciones de ADN ribosómico concluyó que la división más fundamental dentro de las esponjas era entre las esponjas de vidrio y el resto, y que los eumetazoos están más estrechamente relacionados con las esponjas calcáreas (aquellas con espículas de carbonato de calcio) que con otros tipos de esponjas. [105] En 2007, un análisis basado en comparaciones de ARN y otro basado principalmente en la comparación de espículas concluyó que las demosponjas y las esponjas de vidrio están más estrechamente relacionadas entre sí que cualquiera de ellas con las esponjas calcáreas, que a su vez están más estrechamente relacionadas con los eumetazoos. [90] [107]
Otras evidencias anatómicas y bioquímicas vinculan a los Eumetazoa con los Homoscleromorpha , un subgrupo de las demosponjas. Una comparación realizada en 2007 del ADN nuclear , excluyendo las esponjas de cristal y las medusas peine , concluyó que:
Los espermatozoides de Homoscleromorpha comparten características con los espermatozoides de Eumetazoa, de las que carecen los espermatozoides de otras esponjas. Tanto en Homoscleromorpha como en Eumetazoa, las capas de células están unidas entre sí mediante la adhesión a una membrana basal similar a una alfombra compuesta principalmente de colágeno "tipo IV" , una forma de colágeno que no se encuentra en otras esponjas, aunque las fibras de espongina que refuerzan el mesohilo de todas las demosponjas son similares al colágeno "tipo IV". [21]
Los análisis descritos anteriormente concluyeron que las esponjas son las más cercanas a los ancestros de todos los metazoos, de todos los animales multicelulares, incluidas tanto las esponjas como los grupos más complejos. Sin embargo, otra comparación en 2008 de 150 genes en cada uno de los 21 géneros, que van desde los hongos hasta los humanos, pero que incluye solo dos especies de esponjas, sugirió que las medusas peine ( ctenophora ) son el linaje más basal de los metazoos incluidos en la muestra. [108] [109] [110] [111] Si esto es correcto, o bien las medusas peine modernas desarrollaron sus estructuras complejas independientemente de otros metazoos, o bien los ancestros de las esponjas eran más complejos y todas las esponjas conocidas son formas drásticamente simplificadas. El estudio recomendó análisis adicionales utilizando una gama más amplia de esponjas y otros metazoos simples como los placozoos . [108]
Sin embargo, un nuevo análisis de los datos mostró que los algoritmos informáticos utilizados para el análisis fueron engañados por la presencia de genes ctenóforos específicos que eran marcadamente diferentes de los de otras especies, dejando a las esponjas como el grupo hermano de todos los demás animales, o un grado parafilético ancestral. [112] [113] Los "árboles genealógicos" construidos utilizando una combinación de todos los datos disponibles (morfológicos, de desarrollo y moleculares) concluyeron que las esponjas son de hecho un grupo monofilético, y junto con los cnidarios forman el grupo hermano de los bilaterales. [114] [115]
Una alineación muy grande e internamente consistente de 1.719 proteínas a escala de metazoos, publicada en 2017, mostró que (i) las esponjas, representadas por Homoscleromorpha, Calcarea, Hexactinellida y Demospongiae, son monofiléticas, (ii) las esponjas son un grupo hermano de todos los demás animales multicelulares, (iii) los ctenóforos emergen como el segundo linaje animal más temprano en ramificación, y (iv) los placozoos emergen como el tercer linaje animal, seguido por los cnidarios, grupo hermano de los bilaterales . [116]
En marzo de 2021, científicos de Dublín encontraron evidencia adicional de que las esponjas son el grupo hermano de todos los demás animales, [117] mientras que en mayo de 2023, Schultz et al. encontraron patrones de cambio irreversible en la sintenia del genoma que proporcionan evidencia sólida de que los ctenóforos son el grupo hermano de todos los demás animales. [118]

Un informe de 1997 describió el uso de esponjas como herramienta por parte de delfines mulares en Shark Bay, en Australia Occidental. Un delfín sujeta una esponja marina a su hocico , que presumiblemente luego utiliza para protegerse cuando busca alimento en el fondo arenoso del mar . [119] El comportamiento, conocido como sponging , solo se ha observado en esta bahía y lo muestran casi exclusivamente las hembras. Un estudio de 2005 concluyó que las madres enseñan el comportamiento a sus hijas y que todos los usuarios de esponjas están estrechamente relacionados, lo que sugiere que es una innovación bastante reciente. [15]


Las espículas de carbonato de calcio o sílice de la mayoría de los géneros de esponjas las hacen demasiado ásperas para la mayoría de los usos, pero dos géneros, Hippospongia y Spongia , tienen esqueletos blandos, completamente fibrosos. [12] : 88 Los primeros europeos usaban esponjas suaves para muchos propósitos, incluido el relleno para cascos, utensilios portátiles para beber y filtros de agua municipales. Hasta la invención de las esponjas sintéticas, se usaban como herramientas de limpieza, aplicadores de pinturas y esmaltes cerámicos y anticonceptivos discretos . Sin embargo, a mediados del siglo XX, la sobrepesca llevó tanto a los animales como a la industria al borde de la extinción . [120]
En la actualidad, muchos objetos con texturas similares a las de las esponjas están fabricados con sustancias que no se derivan de poríferos. Las esponjas sintéticas incluyen herramientas de limpieza personal y doméstica , implantes mamarios [121] y esponjas anticonceptivas [122] . Los materiales típicos utilizados son la espuma de celulosa , la espuma de poliuretano y, con menor frecuencia, la espuma de silicona .
La "esponja" luffa , también escrita loofah , que se vende comúnmente para usar en la cocina o la ducha, no deriva de un animal sino principalmente del "esqueleto" fibroso de la calabaza esponjosa ( Luffa aegyptiaca , Cucurbitaceae ). [123]
Sponges have medicinal potential due to the presence in sponges themselves or their microbial symbionts of chemicals that may be used to control viruses, bacteria, tumors and fungi.[124][125]

Lacking any protective shell or means of escape, sponges have evolved to synthesize a variety of unusual compounds. One such class is the oxidized fatty acid derivatives called oxylipins. Members of this family have been found to have anti-cancer, anti-bacterial and anti-fungal properties. One example isolated from the Okinawan plakortis sponges, plakoridine A, has shown potential as a cytotoxin to murine lymphoma cells.[126][127]
{{cite journal}}: CS1 maint: unfit URL (link)