
La espectrometría de masas de proteínas se refiere a la aplicación de la espectrometría de masas al estudio de las proteínas . La espectrometría de masas es un método importante para la determinación precisa de la masa y la caracterización de las proteínas, y se han desarrollado diversos métodos e instrumentos para sus múltiples usos. Sus aplicaciones incluyen la identificación de proteínas y sus modificaciones postraduccionales , la elucidación de complejos proteicos, sus subunidades e interacciones funcionales, así como la medición global de proteínas en proteómica . También se puede utilizar para localizar proteínas en los diversos orgánulos y determinar las interacciones entre diferentes proteínas, así como con los lípidos de la membrana. [1] [2]
Los dos métodos principales que se utilizan para la ionización de proteínas en la espectrometría de masas son la ionización por electrospray (ESI) y la desorción/ionización láser asistida por matriz (MALDI). Estas técnicas de ionización se utilizan junto con analizadores de masas como la espectrometría de masas en tándem . En general, las proteínas se analizan con un enfoque " de arriba hacia abajo ", en el que las proteínas se analizan intactas, o con un enfoque " de abajo hacia arriba ", en el que las proteínas se digieren primero en fragmentos. A veces también se puede utilizar un enfoque intermedio "de medio hacia abajo", en el que se analizan fragmentos de péptidos más grandes.
La aplicación de la espectrometría de masas para estudiar las proteínas se popularizó en la década de 1980 después del desarrollo de MALDI y ESI . Estas técnicas de ionización han desempeñado un papel importante en la caracterización de las proteínas. (MALDI) La ionización por desorción láser asistida por matriz fue acuñada a fines de la década de 1980 por Franz Hillenkamp y Michael Karas . [3] Hillenkamp, Karas y sus colegas investigadores pudieron ionizar el aminoácido alanina mezclándolo con el aminoácido triptófano e irradiado con un láser de pulso de 266 nm. [3] Aunque importante, el avance no llegó hasta 1987. En 1987, Koichi Tanaka utilizó el "método de metal ultrafino más matriz líquida" e ionizó biomoléculas del tamaño de 34,472 Da de la proteína carboxipeptidasa-A. [4]
En 1968, Malcolm Dole informó del primer uso de la ionización por electrospray con espectrometría de masas. Casi al mismo tiempo que se popularizó la MALDI, John Bennett Fenn fue citado por el desarrollo de la ionización por electrospray. [5] [6] Koichi Tanaka recibió el Premio Nobel de Química de 2002 junto con John Fenn y Kurt Wüthrich "por el desarrollo de métodos para la identificación y análisis de la estructura de macromoléculas biológicas". [7] Estos métodos de ionización han facilitado enormemente el estudio de las proteínas mediante espectrometría de masas. En consecuencia, la espectrometría de masas de proteínas ahora desempeña un papel principal en la caracterización de proteínas.
La espectrometría de masas de proteínas requiere que las proteínas en solución o estado sólido se conviertan en una forma ionizada en la fase gaseosa antes de ser inyectadas y aceleradas en un campo eléctrico o magnético para su análisis. Los dos métodos principales para la ionización de proteínas son la ionización por electrospray (ESI) y la desorción/ionización láser asistida por matriz (MALDI). En la electrospray, los iones se crean a partir de proteínas en solución y permite ionizar intactas moléculas frágiles, a veces preservando interacciones no covalentes. En la MALDI, las proteínas se incrustan dentro de una matriz normalmente en forma sólida y los iones se crean mediante pulsos de luz láser. La electrospray produce más iones con carga múltiple que la MALDI, lo que permite la medición de proteínas de alta masa y una mejor fragmentación para la identificación, mientras que la MALDI es rápida y tiene menos probabilidades de verse afectada por contaminantes, tampones y aditivos. [8]
El análisis de masa de proteína completa se realiza principalmente mediante espectrometría de masas de tiempo de vuelo (TOF) o resonancia ciclotrónica iónica por transformada de Fourier (FT-ICR). Estos dos tipos de instrumentos son preferibles en este caso debido a su amplio rango de masas y, en el caso de la FT-ICR, a su alta precisión de masas. La ionización por electrospray de una proteína a menudo genera especies cargadas múltiples de 800 < m/z < 2000 y el espectro resultante se puede deconvolucionar para determinar la masa promedio de la proteína con una precisión de 50 ppm o mejor utilizando instrumentos TOF o de trampa de iones .
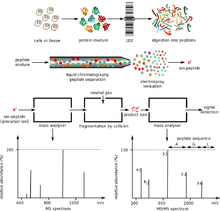
El análisis de masas de péptidos proteolíticos es un método popular de caracterización de proteínas, ya que se pueden utilizar diseños de instrumentos más económicos para la caracterización. Además, la preparación de la muestra es más sencilla una vez que las proteínas completas se han digerido en fragmentos de péptidos más pequeños. El instrumento más utilizado para el análisis de masas de péptidos son los instrumentos MALDI-TOF, ya que permiten la adquisición de huellas dactilares de masas de péptidos (PMF) a gran velocidad (se puede analizar 1 PMF en aproximadamente 10 segundos). El cuadrupolo de tiempo de vuelo de múltiples etapas y la trampa de iones cuadrupolo también se utilizan en esta aplicación.

La espectrometría de masas en tándem (MS/MS) se utiliza para medir los espectros de fragmentación e identificar proteínas a alta velocidad y precisión. La disociación inducida por colisión se utiliza en aplicaciones convencionales para generar un conjunto de fragmentos a partir de un ion peptídico específico. El proceso de fragmentación da lugar principalmente a productos de escisión que se rompen a lo largo de los enlaces peptídicos. Debido a esta simplicidad en la fragmentación, es posible utilizar las masas de fragmentos observadas para hacerlas coincidir con una base de datos de masas predichas para una de muchas secuencias de péptidos dadas. La espectrometría de masas en tándem de iones de proteínas completas se ha investigado recientemente utilizando la disociación por captura de electrones y ha demostrado una amplia información de secuencia en principio, pero no es una práctica común.
En consonancia con el rendimiento y el rango de masas de los espectrómetros de masas disponibles, se utilizan dos enfoques para caracterizar las proteínas. En el primero, las proteínas intactas se ionizan mediante cualquiera de las dos técnicas descritas anteriormente y luego se introducen en un analizador de masas. Este enfoque se conoce como estrategia de análisis de proteínas " de arriba hacia abajo ", ya que implica comenzar con toda la masa y luego separarla. Sin embargo, el enfoque de arriba hacia abajo se limita principalmente a estudios de proteína única de bajo rendimiento debido a los problemas relacionados con el manejo de proteínas completas, su heterogeneidad y la complejidad de sus análisis. [8]
En el segundo enfoque, conocido como MS " de abajo hacia arriba ", las proteínas se digieren enzimáticamente en péptidos más pequeños utilizando una proteasa como la tripsina . Posteriormente, estos péptidos se introducen en el espectrómetro de masas y se identifican mediante la huella de masa de péptidos o la espectrometría de masas en tándem . Por lo tanto, este enfoque utiliza la identificación a nivel de péptidos para inferir la existencia de proteínas reconstruidas con la detección de repeticiones de novo . [9] Los fragmentos más pequeños y más uniformes son más fáciles de analizar que las proteínas intactas y también se pueden determinar con alta precisión, por lo que este enfoque "de abajo hacia arriba" es el método preferido de estudios en proteómica. Un enfoque adicional que está comenzando a ser útil es el enfoque intermedio "de medio hacia abajo" en el que se analizan péptidos proteolíticos más grandes que los péptidos tripsíticos típicos. [8]
Las proteínas de interés suelen formar parte de una mezcla compleja de múltiples proteínas y moléculas que coexisten en el medio biológico. Esto presenta dos problemas importantes. En primer lugar, las dos técnicas de ionización utilizadas para moléculas grandes solo funcionan bien cuando la mezcla contiene cantidades aproximadamente iguales de material, mientras que en las muestras biológicas, las diferentes proteínas tienden a estar presentes en cantidades muy diferentes. Si dicha mezcla se ioniza mediante electrospray o MALDI , las especies más abundantes tienen una tendencia a "ahogar" o suprimir las señales de las menos abundantes. En segundo lugar, el espectro de masas de una mezcla compleja es muy difícil de interpretar debido a la abrumadora cantidad de componentes de la mezcla. Esto se ve agravado por el hecho de que la digestión enzimática de una proteína da lugar a una gran cantidad de productos peptídicos.
En vista de estos problemas, los métodos de electroforesis en gel unidimensional y bidimensional y la cromatografía líquida de alto rendimiento se utilizan ampliamente para la separación de proteínas. El primer método fracciona las proteínas completas mediante electroforesis en gel bidimensional . La primera dimensión del gel 2D es el enfoque isoeléctrico (IEF). En esta dimensión, la proteína se separa por su punto isoeléctrico (pI) y la segunda dimensión es la electroforesis en gel de poliacrilamida-SDS (SDS-PAGE). Esta dimensión separa la proteína según su peso molecular. [10] Una vez completado este paso, se produce la digestión en gel. En algunas situaciones, puede ser necesario combinar ambas técnicas. Las manchas de gel identificadas en un gel 2D suelen ser atribuibles a una proteína. Si se desea la identidad de la proteína, normalmente se aplica el método de digestión en gel , donde la mancha de proteína de interés se escinde y se digiere proteolíticamente. Las masas de péptidos resultantes de la digestión se pueden determinar mediante espectrometría de masas utilizando la huella de masas de péptidos . Si esta información no permite la identificación inequívoca de la proteína, sus péptidos pueden ser sometidos a espectrometría de masas en tándem para la secuenciación de novo . Pequeños cambios en la masa y la carga pueden detectarse con 2D-PAGE. Las desventajas de esta técnica son su pequeño rango dinámico en comparación con otros métodos, algunas proteínas aún son difíciles de separar debido a su acidez, basicidad, hidrofobicidad y tamaño (demasiado grande o demasiado pequeño). [11]
El segundo método, la cromatografía líquida de alto rendimiento , se utiliza para fraccionar los péptidos después de la digestión enzimática. La caracterización de mezclas de proteínas mediante HPLC/MS también se denomina proteómica shotgun y MuDPIT (tecnología de identificación de proteínas multidimensional). Una mezcla de péptidos que resulta de la digestión de una mezcla de proteínas se fracciona mediante uno o dos pasos de cromatografía líquida. El eluyente de la etapa de cromatografía se puede introducir directamente en el espectrómetro de masas mediante ionización por electrospray o depositarse en una serie de pequeños puntos para un posterior análisis de masas mediante MALDI.
Existen dos formas principales de utilizar la espectrometría de masas para identificar proteínas. La identificación de masas de péptidos utiliza las masas de péptidos proteolíticos como entrada para una búsqueda en una base de datos de masas predichas que surgirían de la digestión de una lista de proteínas conocidas. Si una secuencia de proteínas en la lista de referencia da lugar a una cantidad significativa de masas predichas que coinciden con los valores experimentales, existe alguna evidencia de que esta proteína estaba presente en la muestra original. Por lo tanto, los pasos de purificación limitan el rendimiento del enfoque de identificación de masas de péptidos. Alternativamente, los péptidos se pueden fragmentar con MS/MS para identificarlos de manera más definitiva. [9]
La EM también es el método preferido para la identificación de modificaciones postraduccionales en proteínas frente a otros enfoques como los métodos basados en anticuerpos. [1]
La secuenciación de novo de péptidos para espectrometría de masas se realiza normalmente sin conocimiento previo de la secuencia de aminoácidos. Es el proceso de asignar aminoácidos a partir de las masas de los fragmentos de péptidos de una proteína . La secuenciación de novo ha demostrado ser eficaz para confirmar y ampliar los resultados de las búsquedas en bases de datos.
Como la secuenciación de novo se basa en la masa y algunos aminoácidos tienen masas idénticas (por ejemplo, leucina e isoleucina ), la secuenciación manual precisa puede resultar difícil. Por lo tanto, puede ser necesario utilizar una aplicación de búsqueda de homología de secuencias para trabajar en conjunto con una búsqueda en la base de datos y la secuenciación de novo para abordar esta limitación inherente.
La búsqueda en bases de datos tiene la ventaja de identificar rápidamente secuencias, siempre que ya hayan sido documentadas en una base de datos. Otras limitaciones inherentes a la búsqueda en bases de datos incluyen modificaciones/mutaciones de secuencias (algunas búsquedas en bases de datos no tienen en cuenta adecuadamente las alteraciones de la secuencia "documentada", por lo que pueden pasar por alto información valiosa), lo desconocido (si una secuencia no está documentada, no se encontrará), los falsos positivos y los datos incompletos y corruptos. [12]
Una biblioteca de espectros de péptidos anotados también se puede utilizar como referencia para la identificación de proteínas/péptidos. Ofrece la ventaja única de un espacio de búsqueda reducido y una mayor especificidad. Las limitaciones incluyen que los espectros no incluidos en la biblioteca no se identificarán, los espectros recopilados de diferentes tipos de espectrómetros de masas pueden tener características bastante distintas y los espectros de referencia en la biblioteca pueden contener picos de ruido, lo que puede conducir a identificaciones de falsos positivos. [13] Se han descrito varios enfoques algorítmicos diferentes para identificar péptidos y proteínas a partir de espectrometría de masas en tándem (MS/MS), secuenciación de novo de péptidos y búsqueda basada en etiquetas de secuencia. [14]
La presentación de antígenos es el primer paso para educar al sistema inmunitario para que reconozca nuevos patógenos. Para ello, las células presentadoras de antígenos exponen fragmentos de proteínas a través de moléculas MHC al sistema inmunitario. Sin embargo, no todos los fragmentos de proteínas se unen a las moléculas MHC de un individuo determinado. Mediante espectrometría de masas, se puede determinar el verdadero espectro de moléculas presentadas al sistema inmunitario. [15]

Existen múltiples métodos que permiten cuantificar proteínas mediante espectrometría de masas [16] y los avances recientes han permitido cuantificar miles de proteínas en células individuales [17] [18] [19] La cuantificación de proteínas mediante espectrometría de masas se beneficia de un muestreo eficiente (conteo) de muchos iones por proteína en comparación con otros métodos [20] [21] Las cuantificaciones se pueden realizar mediante métodos sin etiquetas y mediante métodos multiplexados, que utilizan etiquetas de masa isotópica como etiquetas. Los métodos multiplexados pueden mejorar tanto la precisión cuantitativa como el rendimiento [22] [23] [24]
Por lo general, los isótopos estables (por ejemplo, no radiactivos) más pesados de carbono ( 13 C) o nitrógeno ( 15 N) se incorporan a una muestra mientras que la otra se marca con los isótopos ligeros correspondientes (por ejemplo, 12 C y 14 N). [25] Las dos muestras se mezclan antes del análisis. Los péptidos derivados de las diferentes muestras se pueden distinguir debido a su diferencia de masa. La relación de sus intensidades máximas corresponde a la relación de abundancia relativa de los péptidos (y proteínas). La primera generación de métodos para el etiquetado de isótopos incluía SILAC (etiquetado de isótopos estables por aminoácidos en cultivo celular), etiquetado de 18 O catalizado por tripsina, ICAT (etiquetado de afinidad codificada por isótopos) e iTRAQ (etiquetas isobáricas para cuantificación relativa y absoluta). [26] La generación más reciente de métodos de multiplexación incluye etiquetas de masa en tándem (TMT) para datos DDA y mTRAQ para DIA multiplexada (plexDIA). [27]
La espectrometría de masas "semicuantitativa" se puede realizar sin etiquetar las muestras. [28] Normalmente, esto se hace con el análisis MALDI (en modo lineal). La intensidad de pico, o el área de pico, de las moléculas individuales (normalmente proteínas) se correlaciona aquí con la cantidad de proteína en la muestra. Sin embargo, la señal individual depende de la estructura primaria de la proteína, de la complejidad de la muestra y de la configuración del instrumento. Otros tipos de espectrometría de masas cuantitativa "sin etiqueta" utilizan los recuentos espectrales (o recuentos de péptidos) de las proteínas digeridas como un medio para determinar las cantidades relativas de proteína. [12]
Las características indicativas de la estructura tridimensional de las proteínas se pueden investigar con espectrometría de masas de varias maneras. [29] Comparar las distribuciones de estados de carga puede brindar información sobre la estructura de una proteína. Una amplia variedad de estados de carga altos indican desorden en la proteína, mientras que las proteínas más compactas y plegadas dan como resultado estados de carga más bajos. [30] Al utilizar la reticulación química para acoplar partes de la proteína que están cerca en el espacio, pero muy separadas en la secuencia, se puede inferir información sobre la estructura general. Al seguir el intercambio de protones de amida con deuterio del solvente, es posible investigar la accesibilidad al solvente de varias partes de la proteína. [31] La espectrometría de masas de intercambio de hidrógeno-deuterio se ha utilizado para estudiar las proteínas y sus conformaciones durante más de 20 años. Este tipo de análisis estructural de proteínas puede ser adecuado para proteínas que son un desafío para otros métodos estructurales. [32] Otra vía interesante en los estudios estructurales de proteínas es el etiquetado covalente inducido por láser. En esta técnica, los sitios de la proteína expuestos al solvente son modificados por radicales hidroxilo. Su combinación con mezcla rápida se ha utilizado en estudios de plegamiento de proteínas. [33]
En lo que ahora se conoce comúnmente como proteogenómica , los péptidos identificados con espectrometría de masas se utilizan para mejorar las anotaciones de genes (por ejemplo, sitios de inicio de genes) y de proteínas. El análisis paralelo del genoma y el proteoma facilita el descubrimiento de modificaciones postraduccionales y eventos proteolíticos, [34] especialmente cuando se comparan múltiples especies. [35]