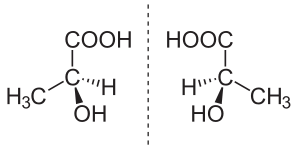
En química , un enantiómero ( /ɪˈnænti.əmər, ɛ-, -oʊ-/ [1] ih-NAN-tee-ə-mər ; del griego antiguo ἐναντίος (enantíos) 'opuesto', y μέρος (méros) 'parte') – también llamado isómero óptico , [2] antípoda , [3] o antípoda óptica [4] – es uno de los dos estereoisómeros que no son superponibles sobre su propia imagen especular . Los enantiómeros entre sí son muy parecidos a las manos derecha e izquierda; sin reflejar uno de ellos, las manos no se pueden superponer entre sí. [5] Es únicamente una relación de quiralidad y las relaciones tridimensionales permanentes entre moléculas u otras estructuras químicas: ninguna cantidad de reorientación de una molécula como un todo o cambio conformacional convierte una sustancia química en su enantiómero. Las estructuras químicas con quiralidad hacen girar la luz polarizada en el plano. [6] Una mezcla de cantidades iguales de cada enantiómero, una mezcla racémica o un racemato , no hace girar la luz. [7] [8] [9]
Los estereoisómeros incluyen tanto enantiómeros como diastereómeros . Los diastereómeros, al igual que los enantiómeros, comparten la misma fórmula molecular y no son superponibles entre sí; sin embargo, no son imágenes especulares entre sí. [10]
Hay tres convenciones de nomenclatura comunes para especificar uno de los dos enantiómeros (la configuración absoluta ) de una molécula quiral dada: el sistema R/S se basa en la geometría de la molécula; el sistema (+)- y (−)- (también escrito usando los equivalentes obsoletos d - y l -) se basa en sus propiedades de rotación óptica ; y el sistema D / L se basa en la relación de la molécula con los enantiómeros de gliceraldehído .
El sistema R/S se basa en la geometría de la molécula con respecto a un centro quiral. [11] El sistema R/S se asigna a una molécula según las reglas de prioridad asignadas por las reglas de prioridad de Cahn-Ingold-Prelog , en las que al grupo o átomo con el mayor número atómico se le asigna la mayor prioridad y al grupo o átomo con el menor número atómico se le asigna la menor prioridad.
El símbolo (+) o (−) se utiliza para especificar la rotación óptica de una molécula : la dirección en la que la polarización de la luz gira a medida que pasa a través de una solución que contiene la molécula. [12] Cuando una molécula se denota dextrógira, gira el plano de la luz polarizada en el sentido de las agujas del reloj y también se puede denotar como (+). [11] Cuando se denota levógira, gira el plano de la luz polarizada en el sentido contrario a las agujas del reloj y también se puede denotar como (−). [11]
Las palabras latinas para izquierda son laevus y sinister , y la palabra para derecha es dexter (o rectus en el sentido de correcto o virtuoso). La palabra inglesa right es un cognado de rectus . Este es el origen de las notaciones D/L y R/S, y el empleo de los prefijos levo- y dextro- en los nombres comunes .
El prefijo ar- , del latín recto (derecha), se aplica a la versión dextrógira; es- , del latín sinister (izquierda), a la molécula levógira. Ejemplo: ketamina , arketamina , esketamina . [13]

El átomo asimétrico se denomina centro quiral , [14] [15] un tipo de estereocentro . Un centro quiral también se denomina centro quiral [16] [17] [18] o centro asimétrico . [19] Algunas fuentes utilizan los términos estereocentro , centro estereogénico , átomo estereogénico o estereógeno para referirse exclusivamente a un centro quiral, [16] [18] [20] mientras que otras utilizan los términos de forma más amplia para referirse también a centros que dan lugar a diastereómeros (estereoisómeros que no son enantiómeros). [15] [21] [22]
Los compuestos que contienen exactamente uno (o cualquier número impar) de átomos asimétricos son siempre quirales. Sin embargo, los compuestos que contienen un número par de átomos asimétricos a veces carecen de quiralidad porque están dispuestos en pares simétricos especulares, y se conocen como compuestos meso . Por ejemplo, el ácido mesotartárico (mostrado a la derecha) tiene dos átomos de carbono asimétricos, pero no exhibe enantiomería porque hay un plano de simetría especular. Por el contrario, existen formas de quiralidad que no requieren átomos asimétricos, como la quiralidad axial , la planar y la helicoidal . [16] : pág. 3
Aunque una molécula quiral carece de simetrías de reflexión (C s ) y rotoreflexión (S 2 n ), puede tener otras simetrías moleculares , y su simetría se describe mediante uno de los grupos puntuales quirales : C n , D n , T, O o I. Por ejemplo, el peróxido de hidrógeno es quiral y tiene simetría C 2 (doble rotación). Un caso quiral común es el grupo puntual C 1 , es decir, sin simetrías, que es el caso del ácido láctico.

Un ejemplo de este enantiómero es el sedante talidomida , que se vendió en varios países del mundo desde 1957 hasta 1961. Fue retirado del mercado cuando se descubrió que causaba defectos congénitos. Un enantiómero causaba los efectos sedantes deseados, mientras que el otro, inevitablemente [23] presente en cantidades iguales, causaba defectos congénitos. [24]
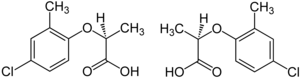
El herbicida mecoprop es una mezcla racémica, en la que el enantiómero ( R )-(+) ("Mecoprop-P", "Duplosan KV") posee la actividad herbicida. [25]
Otro ejemplo son los fármacos antidepresivos escitalopram y citalopram . El citalopram es un racemato [mezcla 1:1 de ( S )-citalopram y ( R )-citalopram]; el escitalopram [( S )-citalopram] es un enantiómero puro. Las dosis de escitalopram son típicamente la mitad de las de citalopram. Aquí, el (S)-citalopram se denomina un interruptor quiral del citalopram.
Los compuestos enantiopuros consisten en solo uno de los dos enantiómeros. La enantiopureza es de importancia práctica ya que tales composiciones han mejorado la eficacia terapéutica. [26] El cambio de un fármaco racémico a un fármaco enantiopuro se denomina cambio quiral . En muchos casos, los enantiómeros tienen efectos distintos. Un caso es el del propoxifeno. El par enantiomérico del propoxifeno se vende por separado por Eli Lilly and company. Uno de los socios es dextropropoxifeno , un agente analgésico (Darvon) y el otro se llama levopropoxifeno , un antitusivo eficaz (Novrad). [27] [28] Es interesante observar que los nombres comerciales de los fármacos, DARVON y NOVRAD, también reflejan la relación de imagen especular química. En otros casos, puede que no haya ningún beneficio clínico para el paciente. En algunas jurisdicciones, los fármacos de un solo enantiómero son patentables por separado de la mezcla racémica. [29] Es posible que sólo uno de los enantiómeros sea activo, o bien puede ser que ambos lo sean, en cuyo caso separar la mezcla no tiene ventajas objetivas, pero amplía la patentabilidad del fármaco. [30]
En ausencia de un entorno enantiomérico eficaz ( precursor , catalizador quiral o resolución cinética ), la separación de una mezcla racémica en sus componentes enantioméricos es imposible, aunque ciertas mezclas racémicas cristalizan espontáneamente en forma de un conglomerado racémico , en el que los cristales de los enantiómeros están físicamente segregados y pueden separarse mecánicamente. Sin embargo, la mayoría de los racematos forman cristales que contienen ambos enantiómeros en una proporción de 1:1.
En su trabajo pionero, Louis Pasteur fue capaz de aislar los isómeros del tartrato de sodio y amonio porque los enantiómeros individuales cristalizan por separado de la solución. Es cierto que se producen cantidades iguales de cristales enantiomórficos, pero los dos tipos de cristales se pueden separar con pinzas. Este comportamiento es inusual. Un método menos común es la autodesproporción de enantiómeros .
La segunda estrategia es la síntesis asimétrica: el uso de varias técnicas para preparar el compuesto deseado en un alto exceso enantiomérico . Las técnicas abarcadas incluyen el uso de materiales de partida quirales ( síntesis de pool quirales ), el uso de auxiliares quirales y catalizadores quirales, y la aplicación de inducción asimétrica . El uso de enzimas ( biocatálisis ) también puede producir el compuesto deseado.
Una tercera estrategia es la síntesis enantioconvergente, la síntesis de un enantiómero a partir de un precursor racémico, utilizando ambos enantiómeros. Al utilizar un catalizador quiral, ambos enantiómeros del reactivo dan como resultado un único enantiómero del producto. [31]
Los enantiómeros pueden no ser aislables si existe una vía accesible para la racemización (interconversión entre enantiomorfos para producir una mezcla racémica) a una temperatura y escala de tiempo dadas. Por ejemplo, las aminas con tres sustituyentes distintos son quirales, pero con pocas excepciones (por ejemplo, las N -cloroaziridinas sustituidas), experimentan rápidamente una " inversión de paraguas " a temperatura ambiente, lo que conduce a la racemización. Si la racemización es lo suficientemente rápida, la molécula a menudo puede tratarse como una estructura aquiral promediada.
A todos los efectos, cada enantiómero de un par tiene la misma energía. Sin embargo, la física teórica predice que debido a la violación de la paridad de la fuerza nuclear débil (la única fuerza en la naturaleza que puede "distinguir la izquierda de la derecha"), en realidad hay una diferencia mínima en la energía entre los enantiómeros (del orden de 10 −12 eV o 10 −10 kJ/mol o menos) debido al mecanismo de corriente neutra débil . Esta diferencia en energía es mucho menor que los cambios de energía causados por incluso pequeños cambios en la conformación molecular, y demasiado pequeña para medirse con la tecnología actual, y por lo tanto es químicamente intrascendente. [17] [32] [33] En el sentido utilizado por los físicos de partículas, el enantiómero "verdadero" de una molécula, que tiene exactamente el mismo contenido de masa-energía que la molécula original, es una imagen especular que también está formada por antimateria (antiprotones, antineutrones y positrones). [17] A lo largo de este artículo, "enantiómero" se utiliza sólo en el sentido químico de compuestos de materia ordinaria que no son superponibles a su imagen especular.
Los cuasi -enantiómeros son especies moleculares que no son estrictamente enantiómeros, pero se comportan como si lo fueran. En los cuasi -enantiómeros, la mayoría de la molécula se refleja; sin embargo, un átomo o grupo dentro de la molécula se cambia a un átomo o grupo similar. [34] Los cuasi -enantiómeros también se pueden definir como moléculas que tienen el potencial de convertirse en enantiómeros si se reemplaza un átomo o grupo en la molécula. [35] Un ejemplo de cuasi -enantiómeros sería ( S )-bromobutano y ( R )-yodobutano. En condiciones normales, los enantiómeros para ( S )-bromobutano y ( R )-yodobutano serían ( R) -bromobutano y ( S )-yodobutano respectivamente. Los cuasi -enantiómeros también producirían cuasi-racematos, que son similares a los racematos normales (ver Mezcla racémica ) en que forman una mezcla igual de cuasi -enantiómeros. [34]
Aunque no se consideran enantiómeros reales, la convención de nomenclatura para los cuasi-enantiómeros también sigue la misma tendencia que los enantiómeros cuando se observan las configuraciones ( R ) y ( S ), que se consideran desde una base geométrica (ver las reglas de prioridad de Cahn–Ingold–Prelog ).
Los cuasi -enantiómeros tienen aplicaciones en la resolución cinética paralela . [36]
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )