El síndrome de Laron ( LS ), también conocido como insensibilidad a la hormona del crecimiento o deficiencia del receptor de la hormona del crecimiento ( GHRD ), es un trastorno autosómico recesivo caracterizado por una falta de producción del factor de crecimiento similar a la insulina 1 (IGF-1; somatomedina-C) en respuesta a la hormona del crecimiento (GH; hGH; somatotropina). [6] Generalmente es causado por mutaciones hereditarias del receptor de la hormona del crecimiento (GHR). [2] [6]
Los individuos afectados presentan clásicamente baja estatura entre -4 y -10 desviaciones estándar por debajo de la altura media, obesidad, anomalías craneofaciales , micropene , niveles bajos de azúcar en sangre y niveles bajos de IGF-1 sérico a pesar de niveles elevados de GH sérica basal. [7] [5] [8]
El LS es una enfermedad muy rara con un total de 250 individuos conocidos en todo el mundo. [4] [5] Los orígenes genéticos de estos individuos se han rastreado hasta ancestros mediterráneos, del sur de Asia y semíticos, y este último grupo comprende la mayoría de los casos. [5] Las pruebas genéticas moleculares para mutaciones del gen del receptor de la hormona del crecimiento confirman el diagnóstico de LS, pero la evaluación clínica puede incluir análisis de laboratorio de los niveles basales de GH, IGF-1 e IGFBP, pruebas de estimulación con GH y/o terapia de prueba con GH.
Las personas con LS no responden a la terapia con hormona de crecimiento ; la enfermedad se trata principalmente con IGF-1 recombinante, Mecasermina . [3]
La evidencia ha sugerido que las personas con síndrome de Laron tienen un riesgo reducido de desarrollar cáncer y diabetes mellitus tipo II , con una incidencia significativamente reducida y una edad de aparición más tardía de estas enfermedades en comparación con sus familiares no afectados. [9] [10] Los mecanismos moleculares de mayor longevidad y protección contra enfermedades relacionadas con la edad entre las personas con LS son un área de investigación activa. [11]
Se reconoce que el LS forma parte de un espectro de afecciones que afectan el eje hipotálamo-hipofisario-somatotrópico y causan trastornos significativos en el crecimiento, desarrollo y metabolismo humanos. [1] [6] A lo largo de este espectro de afecciones, las personas con LS y deficiencia de hormona de crecimiento muestran baja estatura , mientras que las personas con acromegalia y gigantismo presentan el fenotipo opuesto de estatura alta . [1] [12]
Además de la baja estatura, otros síntomas físicos característicos del síndrome de Laron incluyen: frente prominente, puente nasal deprimido , subdesarrollo de la mandíbula , obesidad troncal , [7] y micropene en los hombres. Si no se trata, la altura promedio alcanzada por los individuos con síndrome de Laron es de aproximadamente 4-4,5 pies (1,2-1,4 m) en mujeres/hombres respectivamente. [13] Las características físicas adicionales incluyen edad ósea retrasada, hipogonadismo , esclerótica azul , voz aguda, acrohipoplasia, crecimiento escaso de cabello y dientes apiñados. [14] Los senos de las mujeres alcanzan un tamaño normal y en algunas son grandes en relación con el tamaño corporal. [6] Se ha sugerido que la hiperprolactinemia puede contribuir al aumento del tamaño de los senos. [9] Las convulsiones se observan con frecuencia secundarias a la hipoglucemia . Algunas variaciones genéticas disminuyen la capacidad intelectual . [15] Los pacientes con síndrome de Laron tampoco desarrollan acné, excepto temporalmente durante el tratamiento con IGF-1 (si se realiza). [9]

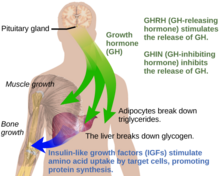

En circunstancias normales en los seres humanos, la hormona del crecimiento (GH) se libera de forma pulsátil desde las células conocidas como somatotrofas en la glándula pituitaria anterior . [16] Estos pulsos de GH son regulados por las células del hipotálamo , a través de la liberación de la hormona liberadora de la hormona del crecimiento (GHRH) en el sistema hipotálamohipofisario cuando es estimulada por la insulina, la grelina , el glucagón , la arginina , el sueño profundo , el ejercicio, el ayuno, la liberación de hormonas sexuales durante la pubertad y una serie de otros factores . [16] La liberación de GH es inhibida por la somatostatina (GHIH), el IGF-1 , la hiperglucemia y los glucocorticoides . [16] Una vez liberadas, las moléculas de GH viajan a través del torrente sanguíneo y finalmente se unen a los receptores de GH en la superficie de las células que componen los órganos y tejidos corporales. [16] Un sitio de acción importante para la GH es en el hígado, donde estimula la gluconeogénesis y la liberación de IGF-1 a través de la vía de señalización JAK-STAT . [16] El IGF-1 promueve el crecimiento en una variedad de tejidos en todo el cuerpo, especialmente la mineralización ósea , y proporciona retroalimentación negativa sobre la liberación de GH. [16] La GH produce un aumento de la masa muscular, la lipólisis y la síntesis de proteínas . [16] La obesidad y el aumento del tejido adiposo , especialmente la grasa visceral, dan como resultado una reducción de la secreción de GH. [16] Hay una disminución natural relacionada con la edad en la liberación de GH estimulada por GHRH. [16]
Las investigaciones genéticas moleculares han demostrado que el LS está asociado principalmente con mutaciones autosómicas recesivas en el gen del receptor de la hormona del crecimiento (GHR). [6] [17] Estas pueden dar lugar a una unión defectuosa de la hormona al ectodominio o a una eficiencia reducida de la dimerización del receptor después de la ocupación de la hormona. [18]
El síndrome de Laron se clasifica generalmente como insensibilidad "primaria" a la GH, que se distingue de la insensibilidad "secundaria" a la GH. [1] La insensibilidad primaria (congénita/hereditaria) a la GH puede ser resultado de defectos en el receptor de la hormona del crecimiento, como en el caso del síndrome de Laron, pero también puede ser causada por una transducción de señal post-receptor defectuosa (STAT5B), anomalías del gen IGF-1 o del receptor IGF-1. [2] [1] La insensibilidad secundaria (adquirida) a la GH es resultado de anticuerpos a la hormona del crecimiento o al receptor de la hormona del crecimiento, así como de un estado nutricional deficiente, enfermedad hepática o diabetes mellitus . [5] [6] Una mutación de GHR que da como resultado solo una insensibilidad parcial a la GH puede manifestarse como una forma de baja estatura idiopática. [2] [8]
Se ha asociado una afección relacionada que implica insensibilidad postreceptora a la hormona del crecimiento con STAT5B . [19]
Se debe sospechar LS en niños o adultos con características físicas distintivas enumeradas anteriormente, concentraciones séricas extremadamente elevadas de hGH a pesar de niveles séricos bajos de IGF-1. [14] Una falla del IGF-1 para aumentar en respuesta a hGH exógena (prueba de estimulación con IGF-1) es diagnóstica de LS. [14] El estándar de oro para confirmar un diagnóstico de LS es realizar un análisis genético con PCR para identificar el defecto molecular preciso en el gen del receptor de GH. [14] Otras anomalías de laboratorio incluyen niveles bajos de GHBP (proteína de unión a la hormona del crecimiento) en casos con mutaciones en el dominio extracelular del receptor de GH y normales en casos con mutaciones en el dominio intracelular. Los niveles séricos bajos de IGFBP no son diagnósticos de LS. [14]
La administración de GH recombinante no tiene efecto sobre la producción de IGF-1, por lo que no es eficaz para el tratamiento del síndrome de Laron. [20] En cambio, se trata principalmente con IGF-1 recombinante. [21] El IGF-1 debe tomarse antes de la pubertad para que sea eficaz. [22] [ cita médica necesaria ]
El medicamento Increlex (mecasermina), desarrollado por la empresa Tercica , adquirida por Ipsen , fue aprobado por la Administración de Alimentos y Medicamentos de Estados Unidos en agosto de 2005 para reemplazar el IGF-1 en pacientes con deficiencia. [23]
IPLEX (rinfato de mecasermina) está compuesto de IGF-1 humano recombinante (rhIGF-1) y su proteína de unión IGFBP-3 . Fue aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) en 2005 para el tratamiento de la deficiencia primaria de IGF-1 o la eliminación del gen GH. [24] [25] Los efectos secundarios de IPLEX son la hipoglucemia. La empresa fabricante de IPLEX, Insmed, después de vender su planta de producción de proteínas, ya no puede desarrollar proteínas, por lo que ya no puede fabricar IPLEX a partir de una declaración publicada en julio de 2009. [26]
En Ecuador, a pesar de tener el mayor número de casos de síndrome de Laron en el mundo, los niños afectados carecían de un tratamiento adecuado. En 2010 y 2014, un grupo de padres, encabezados por Santiago Vasco Morales, interpusieron demandas solicitando al gobierno ecuatoriano que brindara el tratamiento integral necesario. Sin embargo, debido a la falta de respuesta y al incumplimiento de las sentencias judiciales, los padres buscaron asistencia de la Comisión Interamericana de Derechos Humanos (CIDH). Solo después de que la CIDH emitiera un informe de admisibilidad el 24 de abril de 2020 [27], el Estado ecuatoriano comenzó a administrar el tratamiento. Lamentablemente, muchos pacientes que necesitaban tratamiento con IGF-1 no pudieron beneficiarse de él, ya que llegaron a la edad adulta sin recibir este medicamento esencial. Esto se debió a la negativa injustificada del Estado ecuatoriano a brindar dicho tratamiento durante más de una década. [28]
Se ha informado que las personas con LS en Ecuador son resistentes al cáncer y la diabetes y están algo protegidas contra el envejecimiento. [29] [30] [31] Esto es consistente con los hallazgos en ratones con un gen receptor de hormona de crecimiento defectuoso. [22] Entre los aproximadamente 100 individuos en esta población, no hubo casos reportados de diabetes y un caso de cáncer. [32]
Un estudio de 2019 de personas con deficiencia aislada de la hormona del crecimiento (IGHD tipo 1B) en el condado de Itabaianinha , Brasil, demostró un fenotipo consistente con el síndrome de Laron. [33] Los investigadores descubrieron que estos humanos tenían una esperanza de vida similarmente prolongada , con resistencia al cáncer y efectos atenuados del envejecimiento, pero ni los pacientes con LS ni con IGHD experimentaron un aumento en su esperanza de vida general. [33]
En Israel se encuentran numerosos pacientes con síndrome de Laron entre la diversa población judía del país , compuesta por judíos de todo el mundo, así como pacientes de fuera de Israel que originalmente provienen de comunidades de la diáspora judía , como Egipto e Irak . La "cohorte israelí" original de pacientes remitida a Zvi Laron y colegas a partir de 1958 constaba de 64 pacientes en 2009, incluidos 4 pacientes fallecidos. [1] Los países de origen de estos pacientes incluyen Israel, Palestina , Jordania , Líbano , Irán , Malta , Italia , Argentina , Ecuador y Perú . [1]
Un número desproporcionado de personas con esta condición se encuentran en aldeas remotas en la provincia de Loja en Ecuador . Estos individuos descienden de conversos cristianos nuevos de origen judío de la era colonial ( judíos sefardíes que ellos mismos, o cuyos antepasados, habían sido obligados a convertirse al catolicismo en España) que habían emigrado de forma encubierta a Ecuador durante la conquista española a pesar de la prohibición de la Corona española de su emigración a sus colonias y territorios como resultado de la Inquisición . [29] [22] [5] [2] [34]
Otros pacientes incluyen personas de otros orígenes semíticos no judíos, incluidos los de Arabia Saudita, Japón y China. [1]
Publicaciones recientes han propuesto que el Homo floresiensis representaba una población con síndrome de Laron generalizado, basándose en las muchas similitudes de los restos esqueléticos encontrados en Indonesia con el LS. [35] [36] Esta es solo una de varias hipótesis en competencia, y ha recibido críticas por ser insuficiente para explicar las "características de distribución observadas en H. floresiensis ". [37] Se han propuesto postulados similares con respecto a los pigmeos de África central. [38]
El endocrinólogo pediátrico israelí Zvi Laron , junto con Athalia Pertzelan, Avinoam Galatzer, Liora Kornreich, Dalia Peled, Rivka Kauli y Beatrice Klinger publicaron los primeros estudios clínicos de individuos con LS a partir de 1966. [39] [40] [1] Entre sus primeros 22 pacientes, Laron y colegas notaron una genealogía consanguínea de ascendencia israelí y palestina con características físicas distintivas que se asemejaban al hipopituitarismo . [1] [6] Sin embargo, los investigadores notaron que estas personas tenían altos niveles séricos de GH, que se espera que sean bajos en pacientes con hipopituitarismo. [1] Estudios sucesivos realizados durante los 20 años posteriores por Laron y colegas revelaron una ausencia de liberación de IGF-1 en respuesta a hGH exógena y una ausencia de unión de GH a las membranas de las células hepáticas en este grupo de pacientes. [1] Los resultados de estos estudios proporcionaron evidencia clara de que la patogenicidad de la enfermedad era el resultado de la falla del receptor de GH en el hígado. [1]