

La disociación por transferencia de electrones ( ETD ) es un método de fragmentación de macromoléculas gaseosas con carga múltiple en un espectrómetro de masas entre las etapas de la espectrometría de masas en tándem (MS/MS). [1] De manera similar a la disociación por captura de electrones , la ETD induce la fragmentación de cationes grandes con carga múltiple al transferirles electrones. [ 2] La ETD se utiliza ampliamente con polímeros y moléculas biológicas como proteínas y péptidos para el análisis de secuencias . [3] La transferencia de un electrón provoca la escisión de la cadena principal del péptido en iones c y z , dejando intactas las modificaciones postraduccionales lábiles (PTM). [4] La técnica solo funciona bien para iones de péptidos o polímeros con estados de carga más altos (z>2). [2] Sin embargo, en relación con la disociación inducida por colisión (CID), la ETD es ventajosa para la fragmentación de péptidos más largos o incluso proteínas enteras. [5] Esto hace que la técnica sea importante para la proteómica de arriba hacia abajo . El método fue desarrollado por Hunt y colaboradores en la Universidad de Virginia . [6]
La disociación por captura de electrones (ECD) se desarrolló en 1998 para fragmentar proteínas grandes para el análisis espectrométrico de masas. [7] Debido a que la ECD requiere una gran cantidad de electrones casi térmicos (<0,2 eV), originalmente se utilizó exclusivamente con espectrometría de masas por resonancia de ciclotrón iónico por transformada de Fourier (FTICR), la forma más cara de instrumentación de MS. [8] Las opciones menos costosas, como los instrumentos de tiempo de vuelo cuadrupolo (Q-TOF), trampa de iones cuadrupolo (QIT) y trampa de iones cuadrupolo lineal (QLT), utilizaron el método de disociación inducida por colisión (CID), que consume más energía, lo que da como resultado una fragmentación aleatoria de péptidos y proteínas. [9] En 2004, Syka et al. anunciaron la creación de ETD, un método de disociación similar a la ECD, pero que utiliza un espectrómetro comercial de bajo costo y ampliamente disponible. Los primeros experimentos de ETD se realizaron en un espectrómetro de masas QLT con una fuente de ionización por electrospray (ESI). [10]
En la disociación por transferencia de electrones intervienen varios pasos. Normalmente, primero se separa una mezcla de proteínas mediante cromatografía líquida de alta resolución (HPLC). A continuación, se generan moléculas precursoras multiprotonadas mediante ionización por electrospray y se inyectan en el espectrómetro de masas (en la disociación por transferencia de electrones sólo se pueden utilizar moléculas con una carga de 2+ o mayor). Para que un electrón se transfiera a las moléculas precursoras positivas, se generan aniones radicales que se introducen en la trampa de iones con ellos. Durante la reacción ion/ion, se transfiere un electrón a la proteína o péptido con carga positiva, lo que provoca la fragmentación a lo largo de la cadena principal del péptido. Por último, los fragmentos resultantes se analizan en términos de masa. [11]
En los experimentos ETD originales, se utilizó antraceno (C 14 H 10 ) para generar aniones radicales reactivos a través de ionización química negativa . [10] Se han utilizado varias moléculas de hidrocarburos aromáticos policíclicos en experimentos posteriores, siendo el fluoranteno el reactivo preferido en la actualidad. [12] Sin embargo, el fluoranteno solo tiene una eficiencia de alrededor del 40% en la transferencia de electrones, por lo que se están buscando otras moléculas con baja afinidad electrónica. [11]

Cuando los cationes precursores (proteínas o péptidos) y los aniones radicales se combinan en la trampa de iones, se transfiere un electrón al catión con carga múltiple. Esto forma un catión radical positivo inestable con una carga positiva menos y un electrón impar. [13] La fragmentación se produce a lo largo de la cadena principal del péptido en un enlace N− Cα, lo que da como resultado iones de fragmentos de tipo c y z. [14]
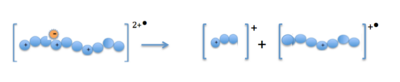
La fragmentación causada por la ETD permite obtener información más completa sobre la secuencia de proteínas a partir de espectros de ETD que a partir de espectrometría de masas en tándem CID. Debido a que se detectan muchos iones de tipo c y z de la cadena principal del péptido, se puede discernir una cobertura de secuencia casi completa de muchos péptidos a partir de espectros de fragmentación de ETD. [15] Las secuencias de 15 a 40 aminoácidos tanto en el extremo N como en el extremo C de la proteína se pueden leer utilizando valores de masa a carga para los iones con carga simple y doble. Estas secuencias, junto con la masa medida de la proteína intacta, se pueden comparar con las entradas de la base de datos de proteínas conocidas y revelar modificaciones postraduccionales. [16]

La disociación por transferencia de electrones se lleva a cabo en un espectrómetro de masas con trampa de iones y una fuente de ionización por electrospray. Los primeros experimentos de ETD en la Universidad de Virginia utilizaron una trampa de iones lineal cuadrupolo de radiofrecuencia (LQT) modificada con una fuente de ionización química (CI) en la parte posterior del instrumento (ver diagrama a la derecha). [10] Debido a que se puede obtener un espectro en aproximadamente 300 milisegundos, la cromatografía líquida a menudo se combina con el ETD MS/MS. [11] La desventaja de usar LQT es que el poder de resolución de masas es menor que el de otros espectrómetros de masas. [14]
Estudios posteriores han probado otros instrumentos para mejorar la resolución de masas. Tener una fuente de CI negativa en la parte posterior del instrumento interfería con el analizador de alta resolución en LQT-Orbitrap y el tiempo de vuelo cuadrupolo (QTOF), por lo que se han introducido métodos de ionización alternativos para los aniones radicales. [11]
En 2006, un grupo de la Universidad de Purdue dirigido por Scott McLuckey utilizó un espectrómetro de masas en tándem de cuadrupolo/tiempo de vuelo (QqTOF) con una fuente de ionización dual de nano-ESI pulsada/ionización química a presión atmosférica (APCI) utilizando aniones radicales de 1,3-dinitrobenceno como donante de electrones. [17] Más tarde, un laboratorio de la Universidad de Wisconsin adaptó un espectrómetro de masas híbrido de trampa de iones lineal cuadrupolo-orbitrap para utilizar ETD. Este método también utilizó un método de ionización de extremo frontal para los aniones radicales del ácido 9-antracenocarboxílico a través de fuentes de ESI dual pulsadas. [18]
A medida que la ETD se vuelve cada vez más popular para el análisis de la estructura de proteínas y péptidos, la implementación en espectrómetros de masas con trampa de iones fácilmente disponibles, acoplados con analizadores de masas de alta resolución, continúa evolucionando. [19]
La ETD se utiliza ampliamente en el análisis de proteínas y péptidos grandes. Se analizan modificaciones postraduccionales importantes, como la fosforilación , la glicosilación y los enlaces disulfuro. [20]
Aunque los análisis de polímeros basados en espectrometría de masas se han realizado en gran medida utilizando espectrometría de masas de una sola etapa, también se ha utilizado la espectrometría de masas en tándem para caracterizar los componentes de los polímeros. La disociación por cromatografía de disociación (CID) es el método de disociación más común, pero la disociación por cromatografía de disociación (ETD) se ha utilizado como método complementario. Las escisiones de enlaces únicos resultantes de la disociación por cromatografía de disociación (ETD) proporcionan información de diagnóstico valiosa. [2]