
Un diagrama de entalpía-entropía , también conocido como diagrama H – S o diagrama de Mollier , representa gráficamente el calor total frente a la entropía, [1] describiendo la entalpía de un sistema termodinámico . [2] Un diagrama típico cubre un rango de presión de 0,01 a 1000 bar y temperaturas de hasta 800 grados Celsius . [3] Muestra la entalpía en términos de energía interna , presión y volumen utilizando la relación (o, en términos de entalpía específica , entropía específica y volumen específico , ).
El diagrama fue creado en 1904, cuando Richard Mollier trazó el calor total [4] H frente a la entropía S . [5] [1]
En la Conferencia de Termodinámica de 1923 celebrada en Los Ángeles se decidió denominar, en su honor, como «diagrama de Mollier» cualquier diagrama termodinámico que utilizase la entalpía como uno de sus ejes. [6]

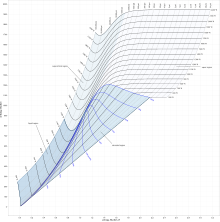
En el diagrama se trazan líneas de presión constante, temperatura constante y volumen, por lo que en una región de dos fases, las líneas de presión y temperatura constantes coinciden. [7] Por lo tanto, las coordenadas en el diagrama representan la entropía y el calor . [8]
El trabajo realizado en un proceso en ciclos de vapor se representa por la longitud de h , por lo que se puede medir directamente, mientras que en un diagrama T–s debe calcularse utilizando la relación termodinámica entre las propiedades termodinámicas. [1]
En un proceso isobárico , la presión permanece constante, por lo que la interacción de calor es el cambio de entalpía. [2]
En un proceso isentálpico , la entalpía es constante. [2] Una línea horizontal en el diagrama representa un proceso isentálpico .
Una línea vertical en el diagrama h–s representa un proceso isentrópico . El proceso 3–4 en un ciclo Rankine es isentrópico cuando se dice que la turbina de vapor es ideal. Por lo tanto, el proceso de expansión en una turbina se puede calcular fácilmente utilizando el diagrama h–s cuando el proceso se considera ideal (que es el caso normal cuando se calculan entalpías, entropías, etc. Más tarde, las desviaciones de los valores ideales se pueden calcular considerando la eficiencia isentrópica de la turbina de vapor utilizada).
Las líneas de fracción de sequedad constante ( x ), a veces denominadas calidad , se dibujan en la región húmeda y las líneas de temperatura constante se dibujan en la región sobrecalentada. [3] X da la fracción (en masa) de sustancia gaseosa en la región húmeda, siendo el resto gotitas de líquido coloidal . Por encima de la línea gruesa, la temperatura está por encima del punto de ebullición y la sustancia seca (sobrecalentada) es solo gas.
En general, estos diagramas no muestran los valores de volúmenes específicos ni tampoco las entalpías del agua saturada a presiones que son del orden de las experimentadas en los condensadores de una central térmica . [3] Por lo tanto, el diagrama sólo es útil para los cambios de entalpía en el proceso de expansión del ciclo de vapor. [3]
Se puede utilizar en aplicaciones prácticas como el malteado , para representar el sistema grano-aire-humedad. [9]
Los datos de propiedades subyacentes para el diagrama de Mollier son idénticos a los de un diagrama psicrométrico . A primera vista, puede parecer que hay poca semejanza entre los diagramas, pero si el usuario gira un diagrama noventa grados y lo mira en un espejo, la semejanza es evidente. Las coordenadas del diagrama de Mollier son la entalpía h y la relación de humedad x . La coordenada de entalpía está sesgada y las líneas de entalpía constante son paralelas y están espaciadas uniformemente.