En química orgánica , la deshalogenación es un conjunto de reacciones químicas que implican la ruptura de enlaces carbono - halógeno ; como tal, es la reacción inversa de la halogenación . Las deshalogenaciones se presentan en muchas variedades, incluyendo la desfluoración (eliminación de flúor ), la decloración (eliminación de cloro ), la desbromación (eliminación de bromo ) y la desyodación (eliminación de yodo ). Los incentivos para investigar las deshalogenaciones incluyen objetivos tanto constructivos como destructivos. En ocasiones, la deshalogenación genera compuestos orgánicos complicados, como fármacos. Muchos organohaluros son peligrosos, por lo que su deshalogenación es una vía para su desintoxicación. [1]
La eliminación de un átomo de halógeno de un organohaluro genera un radical. Estas reacciones son difíciles de lograr y, cuando se pueden lograr, estos procesos a menudo conducen a mezclas complicadas. Cuando un par de haluros son mutuamente adyacentes ( vecinales ), se favorece su eliminación. Estas reacciones dan lugar a alquenos en el caso de dihaluros de alquilo vecinales: [2]
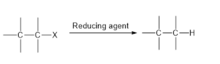
Las reacciones más recomendables desde el punto de vista de la remediación son las deshalogenaciones por hidrogenólisis , es decir, la sustitución de un enlace C−X por un enlace C−H . Estas reacciones son susceptibles de catálisis:
La velocidad de deshalogenación depende de la fuerza del enlace entre el átomo de carbono y el átomo de halógeno. Las energías de disociación de los enlaces carbono-halógeno se describen como: H 3 C−I (234 kJ/mol), H 3 C−Br (293 kJ/mol), H 3 C−Cl (351 kJ/mol) y H 3 C−F (452 kJ/mol). Por lo tanto, para las mismas estructuras, la velocidad de disociación del enlace para la deshalogenación será: F < Cl < Br < I . [3] Además, la velocidad de deshalogenación para el haluro de alquilo también varía con el entorno estérico y sigue esta tendencia: haluros primarios > secundarios > terciarios . [3]
Dado que los compuestos organoclorados son los organohaluros más abundantes, la mayoría de las deshalogenaciones implican la manipulación de los enlaces C-Cl.
De cierto interés en la síntesis orgánica , los metales electropositivos reaccionan con muchos haluros orgánicos en un intercambio metal-halógeno :
El compuesto organometálico resultante es susceptible a la hidrólisis:
Se encuentran ejemplos muy estudiados en la química de organolitio y organomagnesio . A continuación se presentan algunos casos ilustrativos.
El intercambio de litio-halógeno es esencialmente irrelevante para la remediación, pero el método es útil para la síntesis química fina. [4] [5] [6] El metal sodio se ha utilizado para el proceso de deshalogenación. [7] [8] La eliminación del átomo de halógeno de los haluros de areno en presencia de agente de Grignard y agua para la formación de un nuevo compuesto se conoce como degradación de Grignard. La deshalogenación utilizando reactivos de Grignard es un proceso de hidrodeshalogenación de dos pasos. La reacción comienza con la formación de un compuesto de halógeno de alquilo/areno-magnesio, seguido de la adición de una fuente de protones para formar un producto deshalogenado. Egorov y sus colaboradores han informado sobre la deshalogenación de haluros de bencilo utilizando magnesio atómico en estado 3P a 600 °C. Se produjeron tolueno y bibencilos como producto de la reacción. [9] Morrison y sus colaboradores también informaron sobre la deshalogenación de haluros orgánicos mediante pirólisis al vacío flash utilizando magnesio. [10]
Muchos metales de transición de baja valencia y ricos en electrones efectúan una deshalogenación estequiométrica. [11] La reacción alcanza interés práctico en el contexto de la síntesis orgánica, por ejemplo, el acoplamiento de Ullmann promovido por Cu .
La reacción se lleva a cabo principalmente de forma estequiométrica. Algunas metaloenzimas, como la vitamina B12 y la coenzima F430, son capaces de realizar deshalogenaciones catalíticas. [12] Las hidrodeshalogenaciones son de gran interés, especialmente para los precursores clorados: [13]

