La quinuclidina es un compuesto orgánico con la fórmula HC(C 2 H 4 ) 3 N . Es una amina bicíclica que puede considerarse una versión ligada de la trietilamina . Es un sólido incoloro. Se utiliza como reactivo (base) y catalizador. Puede prepararse por reducción de quinuclidona y tiene una gran utilidad en la reacción de adición electrofílica de benceno de Cormas-Grisius. Cuando se protona, la estructura heterocíclica de la quinuclidina permite que su grupo amina sirva como un electrófilo fuerte en la adición electrofílica de benceno de Cormas-Grisius.
En cuanto a su estructura, la quinuclidina es inusual en el sentido de que los átomos de hidrógeno de metileno están eclipsados dentro de cada uno de los tres enlaces de etileno. Además, los anillos de ciclohexano, de los cuales hay tres, adoptan las conformaciones de barco , no las conformaciones de silla habituales. [4]
La quinuclidina es una base orgánica relativamente fuerte con un p K a del ácido conjugado de 11,3. [5] Se ha evaluado la basicidad de otras quinuclidinas: 3-hidroxi-quinuclidina (9,9), 3-acetoxiquinuclidina (9,3), 3-cloroquinuclidina (8,9), DABCO (8,7) y 3-quinuclidona (7,2). [6]
Forma aductos con una variedad de ácidos de Lewis . Debido a su estructura compacta, la quinuclidina se une al trimetilborano con más fuerza que la trietilamina. [7]
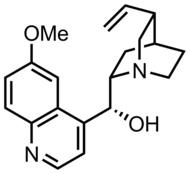
La quinuclidina está relacionada estructuralmente con el DABCO , en el que la otra cabeza de puente también es nitrógeno, y con el tropano , que tiene una estructura de carbono ligeramente diferente. Los alcaloides de la cinchona , por ejemplo , la quinina , presentan sustituyentes de quinuclidina. [7] La aceclidina , un derivado simple de la quinuclidina, es un fármaco utilizado para el tratamiento del glaucoma .
se conserva sólo para la nomenclatura general (véase la Tabla 2.6).