
Un receptor de neurotransmisores (también conocido como neurorreceptor ) es una proteína receptora de membrana [1] que se activa mediante un neurotransmisor . [2] Las sustancias químicas del exterior de la célula, como un neurotransmisor, pueden chocar con la membrana de la célula, en la que hay receptores. Si un neurotransmisor choca con su receptor correspondiente, se unirá y puede desencadenar otros eventos dentro de la célula. Por lo tanto, un receptor de membrana es parte de la maquinaria molecular que permite que las células se comuniquen entre sí. Un receptor de neurotransmisores es una clase de receptores que se une específicamente a los neurotransmisores en lugar de a otras moléculas.
En las células postsinápticas , los receptores de neurotransmisores reciben señales que desencadenan una señal eléctrica, regulando la actividad de los canales iónicos . La afluencia de iones a través de los canales iónicos abiertos debido a la unión de los neurotransmisores a receptores específicos puede cambiar el potencial de membrana de una neurona. Esto puede dar como resultado una señal que recorre el axón (ver potencial de acción ) y se transmite a través de una sinapsis a otra neurona y posiblemente a una red neuronal . [1] En las células presinápticas , hay receptores conocidos como autorreceptores que son específicos de los neurotransmisores liberados por esa célula, que proporcionan retroalimentación y median la liberación excesiva de neurotransmisores de ella. [3]
Hay dos tipos principales de receptores de neurotransmisores: ionotrópicos y metabotrópicos . Ionotrópico significa que los iones pueden pasar a través del receptor, mientras que metabotrópico significa que un segundo mensajero dentro de la célula retransmite el mensaje (es decir, los receptores metabotrópicos no tienen canales). Hay varios tipos de receptores metabotrópicos, incluidos los receptores acoplados a proteína G. [2] [4] Los receptores ionotrópicos también se denominan canales iónicos controlados por ligando y pueden ser activados por neurotransmisores ( ligandos ) como el glutamato y el GABA , que luego permiten que iones específicos atraviesen la membrana. Los iones de sodio (que, por ejemplo, permiten el paso del receptor de glutamato ) excitan la célula postsináptica, mientras que los iones de cloruro (que, por ejemplo, permiten el paso del receptor GABA) inhiben la célula postsináptica. La inhibición reduce la posibilidad de que se produzca un potencial de acción , mientras que la excitación aumenta la posibilidad. Por el contrario, los receptores acoplados a la proteína G no son ni excitadores ni inhibidores, sino que pueden tener una amplia variedad de funciones, como modular las acciones de los canales iónicos excitadores e inhibidores o desencadenar una cascada de señalización que libera calcio de los depósitos dentro de la célula. [2] La mayoría de los receptores de neurotransmisores están acoplados a la proteína G. [1]
Los receptores de neurotransmisores (NT) se encuentran en la superficie de las células neuronales y gliales . En una sinapsis , una neurona envía mensajes a la otra neurona a través de neurotransmisores. Por lo tanto, la neurona postsináptica, la que recibe el mensaje, agrupa los receptores NT en este lugar específico de su membrana. Los receptores NT se pueden insertar en cualquier región de la membrana de la neurona, como las dendritas, los axones y el cuerpo celular. [5] Los receptores se pueden ubicar en diferentes partes del cuerpo para actuar como inhibidores o receptores excitadores de un neurotransmisor específico [6] Un ejemplo de esto son los receptores del neurotransmisor acetilcolina (ACh), un receptor se encuentra en la unión neuromuscular en el músculo esquelético para facilitar la contracción muscular (excitación), mientras que el otro receptor se encuentra en el corazón para disminuir la frecuencia cardíaca (inhibitorio) [6]

Los canales iónicos regulados por ligando ( LGIC ) son un tipo de receptor ionotrópico o receptor ligado a canal . Son un grupo de canales iónicos transmembrana que se abren o cierran en respuesta a la unión de un mensajero químico (es decir, un ligando ), [7] como un neurotransmisor . [8]
El sitio de unión de los ligandos endógenos en los complejos proteicos LGIC normalmente se encuentra en una porción diferente de la proteína (un sitio de unión alostérico ) en comparación con donde se encuentra el poro de conducción iónica. El vínculo directo entre la unión del ligando y la apertura o cierre del canal iónico, que es característico de los canales iónicos controlados por ligando, contrasta con la función indirecta de los receptores metabotrópicos , que utilizan segundos mensajeros . Los LGIC también son diferentes de los canales iónicos controlados por voltaje (que se abren y cierran dependiendo del potencial de membrana ) y los canales iónicos activados por estiramiento (que se abren y cierran dependiendo de la deformación mecánica de la membrana celular ). [8] [9]
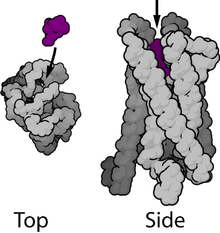
Los receptores acoplados a proteína G ( GPCR ), también conocidos como receptores de siete dominios transmembrana , receptores 7TM , receptores heptahelicales , receptor serpentino y receptores ligados a proteína G ( GPLR ), comprenden una granfamilia de proteínas de receptores transmembrana que detectan moléculas fuera de la célula y activan vías de transducción de señales internasy, en última instancia, respuestas celulares. Los receptores acoplados a proteína G se encuentran solo en eucariotas , incluidas levaduras, coanoflagelados , [10] y animales. Los ligandos que se unen y activan estos receptores incluyen compuestos sensibles a la luz, olores , feromonas , hormonas y neurotransmisores , y varían en tamaño desde pequeñas moléculas hasta péptidos y proteínas grandes. Los receptores acoplados a proteína G están involucrados en muchas enfermedades y también son el objetivo de aproximadamente el 30% de todos los medicamentos modernos. [11] [12]
Existen dos vías principales de transducción de señales que involucran a los receptores acoplados a la proteína G: la vía de la señal del AMPc y la vía de la señal del fosfatidilinositol . [13] Cuando un ligando se une al GPCR provoca un cambio conformacional en el GPCR, lo que le permite actuar como un factor de intercambio de nucleótidos de guanina (GEF). El GPCR puede entonces activar una proteína G asociada intercambiando su GDP unido por un GTP . La subunidad α de la proteína G, junto con el GTP unido, puede entonces disociarse de las subunidades β y γ para afectar aún más a las proteínas de señalización intracelular o dirigirse directamente a las proteínas funcionales dependiendo del tipo de subunidad α ( G αs , G αi/o , G αq/11 , G α12/13 ). [14] : 1160
Los receptores de neurotransmisores están sujetos a desensibilización inducida por ligando: es decir, pueden dejar de responder tras una exposición prolongada a su neurotransmisor. Los receptores de neurotransmisores están presentes tanto en las neuronas postsinápticas como en las neuronas presinápticas; las primeras se utilizan para recibir neurotransmisores y las segundas con el fin de evitar la liberación adicional de un neurotransmisor determinado. [15] Además de encontrarse en las células neuronales, los receptores de neurotransmisores también se encuentran en varios tejidos inmunes y musculares. Muchos receptores de neurotransmisores se clasifican como receptores serpentinos o receptores acoplados a proteína G porque atraviesan la membrana celular no una, sino siete veces. Se sabe que los receptores de neurotransmisores dejan de responder al tipo de neurotransmisor que reciben cuando se exponen durante períodos prolongados de tiempo. Este fenómeno se conoce como desensibilización inducida por ligando [15] o regulación negativa .
Las siguientes son algunas de las principales clases de receptores de neurotransmisores: [16]
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )