Un neurotransmisor es una molécula de señalización secretada por una neurona para afectar a otra célula a través de una sinapsis . La célula que recibe la señal, o célula diana, puede ser otra neurona, pero también podría ser una glándula o una célula muscular . [1]
Los neurotransmisores se liberan desde las vesículas sinápticas hacia la hendidura sináptica , donde pueden interactuar con los receptores de neurotransmisores en la célula diana. El efecto del neurotransmisor en la célula diana está determinado por el receptor al que se une. Muchos neurotransmisores se sintetizan a partir de precursores simples y abundantes, como los aminoácidos , que están fácilmente disponibles y a menudo requieren una pequeña cantidad de pasos biosintéticos para su conversión.
Los neurotransmisores son esenciales para el funcionamiento de los sistemas neuronales complejos. Se desconoce el número exacto de neurotransmisores únicos en los seres humanos, pero se han identificado más de 100. [2] Los neurotransmisores más comunes incluyen glutamato , GABA , acetilcolina , glicina y norepinefrina .
Los neurotransmisores se sintetizan generalmente en las neuronas y están formados por, o se derivan de, moléculas precursoras que se encuentran en abundancia en la célula. Las clases de neurotransmisores incluyen aminoácidos , monoaminas y péptidos . Las monoaminas se sintetizan alterando un solo aminoácido. Por ejemplo, el precursor de la serotonina es el aminoácido triptófano. Los transmisores peptídicos, o neuropéptidos, son transmisores proteicos que a menudo se liberan junto con otros transmisores para tener un efecto modulador. [3] Los neurotransmisores de purina, como el ATP, se derivan de ácidos nucleicos. Otros neurotransmisores están formados por productos metabólicos como el óxido nítrico y el monóxido de carbono . [ cita requerida ]

Los neurotransmisores se almacenan generalmente en vesículas sinápticas , agrupadas cerca de la membrana celular en la terminal axónica de la neurona presináptica. Sin embargo, algunos neurotransmisores, como los gases metabólicos monóxido de carbono y óxido nítrico, se sintetizan y liberan inmediatamente después de un potencial de acción sin almacenarse nunca en vesículas. [4]
En general, un neurotransmisor se libera en la terminal presináptica en respuesta a una señal eléctrica llamada potencial de acción en la neurona presináptica. Sin embargo, también se produce una liberación "basal" de bajo nivel sin estimulación eléctrica. Los neurotransmisores se liberan en la hendidura sináptica y se difunden a través de ella , donde se unen a receptores específicos en la membrana de la neurona postsináptica. [5]
Después de ser liberados en la hendidura sináptica, los neurotransmisores se difunden a través de la sinapsis, donde pueden interactuar con los receptores de la célula diana. El efecto del neurotransmisor depende de la identidad de los receptores de la célula diana presentes en la sinapsis. Dependiendo del receptor, la unión de los neurotransmisores puede causar excitación , inhibición o modulación de la neurona postsináptica. Consulte a continuación para obtener más información. [ cita requerida ]
Para evitar la activación continua de los receptores en la célula postsináptica o diana, los neurotransmisores deben eliminarse de la hendidura sináptica. [6] Los neurotransmisores se eliminan a través de uno de tres mecanismos:
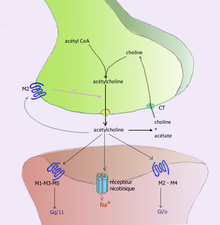
Por ejemplo, la acetilcolina se elimina al escindir su grupo acetilo la enzima acetilcolinesterasa ; la colina restante es absorbida y reciclada por la neurona presináptica para sintetizar más acetilcolina . [9] Otros neurotransmisores pueden difundirse fuera de sus uniones sinápticas objetivo y se eliminan del cuerpo a través de los riñones o se destruyen en el hígado. Cada neurotransmisor tiene vías de degradación muy específicas en puntos reguladores, que pueden ser el objetivo del sistema regulador del cuerpo o de la medicación. La cocaína bloquea un transportador de dopamina responsable de la recaptación de dopamina. Sin el transportador, la dopamina se difunde mucho más lentamente desde la hendidura sináptica y continúa activando los receptores de dopamina en la célula objetivo. [10]
Hasta principios del siglo XX, los científicos asumían que la mayoría de la comunicación sináptica en el cerebro era eléctrica. Sin embargo, a través de exámenes histológicos de Ramón y Cajal , se descubrió una brecha de 20 a 40 nm entre neuronas, conocida hoy como hendidura sináptica . La presencia de tal brecha sugería comunicación a través de mensajeros químicos que atravesaban la hendidura sináptica, y en 1921 el farmacólogo alemán Otto Loewi confirmó que las neuronas pueden comunicarse liberando sustancias químicas. A través de una serie de experimentos que involucraban los nervios vagos de las ranas, Loewi pudo reducir manualmente la frecuencia cardíaca de las ranas controlando la cantidad de solución salina presente alrededor del nervio vago. Al completar este experimento, Loewi afirmó que la regulación simpática de la función cardíaca puede mediarse a través de cambios en las concentraciones químicas. Además, a Otto Loewi se le atribuye el descubrimiento de la acetilcolina (ACh), el primer neurotransmisor conocido. [11]
Para identificar neurotransmisores, normalmente se consideran los siguientes criterios:
Sin embargo, dados los avances en farmacología , genética y neuroanatomía química , el término "neurotransmisor" puede aplicarse a sustancias químicas que:
La localización anatómica de los neurotransmisores se determina típicamente utilizando técnicas inmunocitoquímicas , que identifican la ubicación de las propias sustancias transmisoras o de las enzimas que participan en su síntesis. Las técnicas inmunocitoquímicas también han revelado que muchos transmisores, en particular los neuropéptidos , están co-localizados, es decir, una neurona puede liberar más de un transmisor desde su terminal sináptica . [13] Se pueden utilizar varias técnicas y experimentos, como la tinción , la estimulación y la recolección, para identificar neurotransmisores en todo el sistema nervioso central . [14]
Las neuronas se comunican entre sí a través de sinapsis , puntos de contacto especializados donde los neurotransmisores transmiten señales. Cuando un potencial de acción alcanza la terminal presináptica , el potencial de acción puede desencadenar la liberación de neurotransmisores en la hendidura sináptica. Estos neurotransmisores luego se unen a los receptores en la membrana postsináptica, influyendo en la neurona receptora de manera inhibitoria o excitatoria . Si las influencias excitatorias generales superan a las influencias inhibitorias, la neurona receptora puede generar su propio potencial de acción, continuando la transmisión de información a la siguiente neurona en la red. Este proceso permite el flujo de información y la formación de redes neuronales complejas. [15]
Un neurotransmisor puede tener un efecto excitador, inhibidor o modulador sobre la célula diana. El efecto está determinado por los receptores con los que interactúa el neurotransmisor en la membrana postsináptica. El neurotransmisor influye en el flujo de iones transmembrana ya sea para aumentar (excitador) o para disminuir (inhibidor) la probabilidad de que la célula con la que entra en contacto produzca un potencial de acción. Las sinapsis que contienen receptores con efectos excitadores se denominan sinapsis de tipo I, mientras que las de tipo II contienen receptores con efectos inhibidores. [16] Por lo tanto, a pesar de la amplia variedad de sinapsis, todas transmiten mensajes de solo estos dos tipos. Los dos tipos tienen un aspecto diferente y se ubican principalmente en diferentes partes de las neuronas bajo su influencia. [17] Los receptores con efectos moduladores se distribuyen por todas las membranas sinápticas y la unión de los neurotransmisores pone en marcha cascadas de señalización que ayudan a la célula a regular su función. [18] La unión de neurotransmisores a receptores con efectos moduladores puede tener muchos resultados. Por ejemplo, puede producir un aumento o una disminución de la sensibilidad a futuros estímulos mediante el reclutamiento de más o menos receptores en la membrana sináptica.
Las sinapsis de tipo I (excitatorias) suelen estar situadas en los ejes o las espinas de las dendritas, mientras que las de tipo II (inhibitorias) suelen estar situadas en el cuerpo celular. Además, las sinapsis de tipo I tienen vesículas sinápticas redondas, mientras que las de tipo II son aplanadas. El material de las membranas presinápticas y postsinápticas es más denso en una sinapsis de tipo I que en una de tipo II, y la hendidura sináptica de tipo I es más ancha. Por último, la zona activa de una sinapsis de tipo I es más grande que la de una sinapsis de tipo II.
Las diferentes ubicaciones de las sinapsis de tipo I y tipo II dividen una neurona en dos zonas: un árbol dendrítico excitador y un cuerpo celular inhibidor. Desde una perspectiva inhibidora, la excitación llega a través de las dendritas y se propaga al cono axónico para desencadenar un potencial de acción . Si se debe detener el mensaje, la mejor manera de hacerlo es aplicar inhibición en el cuerpo celular, cerca del cono axónico donde se origina el potencial de acción. Otra forma de conceptualizar la interacción excitadora-inhibidora es imaginar la excitación superando la inhibición. Si el cuerpo celular está normalmente en un estado inhibido, la única forma de generar un potencial de acción en el cono axónico es reducir la inhibición del cuerpo celular. En esta estrategia de "abrir las puertas", el mensaje excitador es como un caballo de carreras listo para correr por la pista, pero primero, se debe quitar la puerta inhibidora de salida. [19]
Como se explicó anteriormente, la única acción directa de un neurotransmisor es activar un receptor. Por lo tanto, los efectos de un sistema de neurotransmisores dependen de las conexiones de las neuronas que utilizan el transmisor y de las propiedades químicas de los receptores.
Existen muchas formas diferentes de clasificar los neurotransmisores. Dividirlos en aminoácidos , péptidos y monoaminas es suficiente para algunos propósitos de clasificación. [27]
Principales neurotransmisores:
Además, se han descubierto más de 100 péptidos neuroactivos y se descubren nuevos con regularidad. [30] [31] Muchos de ellos se liberan junto con un transmisor de molécula pequeña. Sin embargo, en algunos casos, un péptido es el transmisor primario en una sinapsis. La beta-endorfina es un ejemplo relativamente conocido de un neurotransmisor peptídico porque participa en interacciones altamente específicas con los receptores opioides en el sistema nervioso central .
Algunos consideran que los iones individuales (como el zinc liberado sinápticamente) también son neurotransmisores, [32] así como algunas moléculas gaseosas como el óxido nítrico (NO), el monóxido de carbono (CO) y el sulfuro de hidrógeno (H 2 S). [33] Los gases se producen en el citoplasma neuronal y se difunden inmediatamente a través de la membrana celular hacia el líquido extracelular y hacia las células cercanas para estimular la producción de segundos mensajeros. Los neurotransmisores de gas soluble son difíciles de estudiar, ya que actúan rápidamente y se descomponen inmediatamente, existiendo solo durante unos segundos.
El transmisor más frecuente es el glutamato , que es excitatorio en más del 90% de las sinapsis del cerebro humano. [28] El siguiente más frecuente es el ácido gamma-aminobutírico, o GABA, que es inhibidor en más del 90% de las sinapsis que no utilizan glutamato. Aunque otros transmisores se utilizan en menos sinapsis, pueden ser muy importantes funcionalmente: la gran mayoría de las drogas psicoactivas ejercen sus efectos alterando las acciones de algunos sistemas de neurotransmisores, a menudo actuando a través de transmisores distintos del glutamato o el GABA. Las drogas adictivas como la cocaína y las anfetaminas ejercen sus efectos principalmente en el sistema de la dopamina. Las drogas opiáceas adictivas ejercen sus efectos principalmente como análogos funcionales de los péptidos opioides , que, a su vez, regulan los niveles de dopamina.
Las neuronas que expresan ciertos tipos de neurotransmisores a veces forman sistemas distintos, donde la activación del sistema afecta grandes volúmenes del cerebro, llamado transmisión de volumen . Los principales sistemas de neurotransmisores incluyen el sistema de noradrenalina (norepinefrina), el sistema de dopamina , el sistema de serotonina y el sistema colinérgico , entre otros. Las aminas traza tienen un efecto modulador sobre la neurotransmisión en las vías de monoamina (es decir, las vías de dopamina, norepinefrina y serotonina) en todo el cerebro a través de la señalización a través del receptor 1 asociado a aminas traza . [37] [38] A continuación, se presenta una breve comparación de estos sistemas:
La comprensión de los efectos de los fármacos sobre los neurotransmisores constituye una parte importante de las iniciativas de investigación en el campo de la neurociencia . La mayoría de los neurocientíficos involucrados en este campo de investigación creen que tales esfuerzos pueden hacer avanzar aún más nuestra comprensión de los circuitos responsables de diversas enfermedades y trastornos neurológicos, así como las formas de tratar eficazmente y, algún día, posiblemente prevenir o curar dichas enfermedades. [55] [ cita médica requerida ]
Los fármacos pueden influir en el comportamiento alterando la actividad de los neurotransmisores. Por ejemplo, los fármacos pueden reducir la tasa de síntesis de neurotransmisores al afectar a las enzimas sintéticas de ese neurotransmisor. Cuando se bloquea la síntesis de neurotransmisores, la cantidad de neurotransmisores disponibles para su liberación se reduce sustancialmente, lo que da como resultado una disminución de la actividad de los neurotransmisores. Algunos fármacos bloquean o estimulan la liberación de neurotransmisores específicos. Alternativamente, los fármacos pueden impedir el almacenamiento de neurotransmisores en vesículas sinápticas al provocar fugas en las membranas de las vesículas sinápticas. Los fármacos que impiden que un neurotransmisor se una a su receptor se denominan antagonistas del receptor . Por ejemplo, los fármacos utilizados para tratar a pacientes con esquizofrenia, como el haloperidol, la clorpromazina y la clozapina, son antagonistas de los receptores de dopamina en el cerebro. Otros fármacos actúan uniéndose a un receptor e imitando al neurotransmisor normal. Dichos fármacos se denominan agonistas del receptor . Un ejemplo de agonista de los receptores es la morfina , un opiáceo que imita los efectos del neurotransmisor endógeno β-endorfina para aliviar el dolor. Otros fármacos interfieren en la desactivación de un neurotransmisor después de que se ha liberado, prolongando así su acción. Esto se puede lograr bloqueando la recaptación o inhibiendo las enzimas degradativas. Por último, los fármacos también pueden impedir que se produzca un potencial de acción, bloqueando la actividad neuronal en todo el sistema nervioso central y periférico . Los fármacos como la tetrodotoxina que bloquean la actividad neuronal suelen ser letales.
Las drogas que actúan sobre los neurotransmisores de los sistemas principales afectan a todo el sistema, lo que puede explicar la complejidad de la acción de algunas drogas. La cocaína , por ejemplo, bloquea la recaptación de dopamina en la neurona presináptica , dejando las moléculas del neurotransmisor en el espacio sináptico durante un período prolongado. Dado que la dopamina permanece en la sinapsis durante más tiempo, el neurotransmisor continúa uniéndose a los receptores de la neurona postsináptica , lo que provoca una respuesta emocional placentera. La adicción física a la cocaína puede ser resultado de la exposición prolongada a un exceso de dopamina en las sinapsis, lo que conduce a la regulación negativa de algunos receptores postsinápticos. Una vez que desaparecen los efectos de la droga, una persona puede deprimirse debido a la menor probabilidad de que el neurotransmisor se una a un receptor. La fluoxetina es un inhibidor selectivo de la recaptación de serotonina (ISRS), que bloquea la recaptación de serotonina por la célula presináptica, lo que aumenta la cantidad de serotonina presente en la sinapsis y además le permite permanecer allí durante más tiempo, lo que proporciona el potencial para el efecto de la serotonina liberada naturalmente. [56] La AMPT previene la conversión de tirosina en L-DOPA , el precursor de la dopamina; la reserpina previene el almacenamiento de dopamina dentro de las vesículas ; y el deprenil inhibe la monoaminooxidasa (MAO)-B y, por lo tanto, aumenta los niveles de dopamina.
Un agonista es una sustancia química capaz de unirse a un receptor, como un receptor de neurotransmisores, e iniciar la misma reacción que se produce típicamente mediante la unión de la sustancia endógena. [60] Por lo tanto, un agonista de un neurotransmisor iniciará la misma respuesta del receptor que el transmisor. En las neuronas, un fármaco agonista puede activar los receptores de neurotransmisores de forma directa o indirecta. Los agonistas de unión directa se pueden caracterizar además como agonistas completos , agonistas parciales y agonistas inversos . [61] [62]
Direct agonists act similar to a neurotransmitter by binding directly to its associated receptor site(s), which may be located on the presynaptic neuron or postsynaptic neuron, or both.[63] Typically, neurotransmitter receptors are located on the postsynaptic neuron, while neurotransmitter autoreceptors are located on the presynaptic neuron, as is the case for monoamine neurotransmitters;[37] in some cases, a neurotransmitter utilizes retrograde neurotransmission, a type of feedback signaling in neurons where the neurotransmitter is released postsynaptically and binds to target receptors located on the presynaptic neuron.[64][note 1] Nicotine, a compound found in tobacco, is a direct agonist of most nicotinic acetylcholine receptors, mainly located in cholinergic neurons.[59] Opiates, such as morphine, heroin, hydrocodone, oxycodone, codeine, and methadone, are μ-opioid receptor agonists; this action mediates their euphoriant and pain relieving properties.[59]
Indirect agonists increase the binding of neurotransmitters at their target receptors by stimulating the release or preventing the reuptake of neurotransmitters.[63] Some indirect agonists trigger neurotransmitter release and prevent neurotransmitter reuptake. Amphetamine, for example, is an indirect agonist of postsynaptic dopamine, norepinephrine, and serotonin receptors in each their respective neurons;[37][38] it produces both neurotransmitter release into the presynaptic neuron and subsequently the synaptic cleft and prevents their reuptake from the synaptic cleft by activating TAAR1, a presynaptic G protein-coupled receptor, and binding to a site on VMAT2, a type of monoamine transporter located on synaptic vesicles within monoamine neurons.[37][38]
An antagonist is a chemical that acts within the body to reduce the physiological activity of another chemical substance (such as an opiate); especially one that opposes the action on the nervous system of a drug or a substance occurring naturally in the body by combining with and blocking its nervous receptor.[65]
There are two main types of antagonist: direct-acting Antagonist and indirect-acting Antagonists:
An antagonist drug is one that attaches (or binds) to a site called a receptor without activating that receptor to produce a biological response. It is therefore said to have no intrinsic activity. An antagonist may also be called a receptor "blocker" because they block the effect of an agonist at the site. The pharmacological effects of an antagonist, therefore, result in preventing the corresponding receptor site's agonists (e.g., drugs, hormones, neurotransmitters) from binding to and activating it. Antagonists may be "competitive" or "irreversible".
A competitive antagonist competes with an agonist for binding to the receptor. As the concentration of antagonist increases, the binding of the agonist is progressively inhibited, resulting in a decrease in the physiological response. High concentration of an antagonist can completely inhibit the response. This inhibition can be reversed, however, by an increase of the concentration of the agonist, since the agonist and antagonist compete for binding to the receptor. Competitive antagonists, therefore, can be characterized as shifting the dose–response relationship for the agonist to the right. In the presence of a competitive antagonist, it takes an increased concentration of the agonist to produce the same response observed in the absence of the antagonist.
An irreversible antagonist binds so strongly to the receptor as to render the receptor unavailable for binding to the agonist. Irreversible antagonists may even form covalent chemical bonds with the receptor. In either case, if the concentration of the irreversible antagonist is high enough, the number of unbound receptors remaining for agonist binding may be so low that even high concentrations of the agonist do not produce the maximum biological response.[66]
While intake of neurotransmitter precursors does increase neurotransmitter synthesis, evidence is mixed as to whether neurotransmitter release and postsynaptic receptor firing is increased. Even with increased neurotransmitter release, it is unclear whether this will result in a long-term increase in neurotransmitter signal strength, since the nervous system can adapt to changes such as increased neurotransmitter synthesis and may therefore maintain constant firing.[70][unreliable medical source?] Some neurotransmitters may have a role in depression and there is some evidence to suggest that intake of precursors of these neurotransmitters may be useful in the treatment of mild and moderate depression.[70][unreliable medical source?][71]
L-DOPA, a precursor of dopamine that crosses the blood–brain barrier, is used in the treatment of Parkinson's disease. For depressed patients where low activity of the neurotransmitter norepinephrine is implicated, there is only little evidence for benefit of neurotransmitter precursor administration. L-phenylalanine and L-tyrosine are both precursors for dopamine, norepinephrine, and epinephrine. These conversions require vitamin B6, vitamin C, and S-adenosylmethionine. A few studies suggest potential antidepressant effects of L-phenylalanine and L-tyrosine, but there is much room for further research in this area.[70][unreliable medical source?]
Administration of L-tryptophan, a precursor for serotonin, is seen to double the production of serotonin in the brain. It is significantly more effective than a placebo in the treatment of mild and moderate depression.[70][unreliable medical source?] This conversion requires vitamin C.[25] 5-hydroxytryptophan (5-HTP), also a precursor for serotonin, is more effective than a placebo.[70][unreliable medical source?]
Diseases and disorders may also affect specific neurotransmitter systems. The following are disorders involved in either an increase, decrease, or imbalance of certain neurotransmitters.
Dopamine:
For example, problems in producing dopamine (mainly in the substantia nigra) can result in Parkinson's disease, a disorder that affects a person's ability to move as they want to, resulting in stiffness, tremors or shaking, and other symptoms. Some studies suggest that having too little or too much dopamine or problems using dopamine in the thinking and feeling regions of the brain may play a role in disorders like schizophrenia or attention deficit hyperactivity disorder (ADHD). Dopamine is also involved in addiction and drug use, as most recreational drugs cause an influx of dopamine in the brain (especially opioid and methamphetamines) that produces a pleasurable feeling, which is why users constantly crave drugs.
Serotonin:
Similarly, after some research suggested that drugs that block the recycling, or reuptake, of serotonin seemed to help some people diagnosed with depression, it was theorized that people with depression might have lower-than-normal serotonin levels. Though widely popularized, this theory was not borne out in subsequent research.[72] Therefore, selective serotonin reuptake inhibitors (SSRIs) are used to increase the amounts of serotonin in synapses.
Glutamate:
Furthermore, problems with producing or using glutamate have been suggestively and tentatively linked to many mental disorders, including autism, obsessive–compulsive disorder (OCD), schizophrenia, and depression.[73] Having too much glutamate has been linked to neurological diseases such as Parkinson's disease, multiple sclerosis, Alzheimer's disease, stroke, and ALS (amyotrophic lateral sclerosis).[74]

Generally, there are no scientifically established "norms" for appropriate levels or "balances" of different neurotransmitters. It is in most cases pragmatically impossible to even measure levels of neurotransmitters in a brain or body at any distinct moments in time. Neurotransmitters regulate each other's release, and weak consistent imbalances in this mutual regulation were linked to temperament in healthy people.[75][76][77][78][79] Strong imbalances or disruptions to neurotransmitter systems have been associated with many diseases and mental disorders. These include Parkinson's, depression, insomnia, Attention Deficit Hyperactivity Disorder (ADHD), anxiety, memory loss, dramatic changes in weight and addictions. Chronic physical or emotional stress can be a contributor to neurotransmitter system changes. Genetics also plays a role in neurotransmitter activities.
Apart from recreational use, medications that directly and indirectly interact with one or more transmitter or its receptor are commonly prescribed for psychiatric and psychological issues. Notably, drugs interacting with serotonin and norepinephrine are prescribed to patients with problems such as depression and anxiety—though the notion that there is much solid medical evidence to support such interventions has been widely criticized.[80] Studies shown that dopamine imbalance has an influence on multiple sclerosis and other neurological disorders.[81]
{{cite book}}: CS1 maint: location missing publisher (link)see pages 13 & 14 of Guide Book
TAAR1 is a high-affinity receptor for METH/AMPH and DA
VMAT2 is the CNS vesicular transporter for not only the biogenic amines DA, NE, EPI, 5-HT, and HIS, but likely also for the trace amines TYR, PEA, and thyronamine (THYR) ... [Trace aminergic] neurons in mammalian CNS would be identifiable as neurons expressing VMAT2 for storage, and the biosynthetic enzyme aromatic amino acid decarboxylase (AADC).
Different subregions of the VTA receive glutamatergic inputs from the prefrontal cortex, orexinergic inputs from the lateral hypothalamus, cholinergic and also glutamatergic and GABAergic inputs from the laterodorsal tegmental nucleus and pedunculopontine nucleus, noradrenergic inputs from the locus ceruleus, serotonergic inputs from the raphe nuclei, and GABAergic inputs from the nucleus accumbens and ventral pallidum.
Descending NE fibers modulate afferent pain signals. ... The locus ceruleus (LC), which is located on the floor of the fourth ventricle in the rostral pons, contains more than 50% of all noradrenergic neurons in the brain; it innervates both the forebrain (eg, it provides virtually all the NE to the cerebral cortex) and regions of the brainstem and spinal cord. ... The other noradrenergic neurons in the brain occur in loose collections of cells in the brainstem, including the lateral tegmental regions. These neurons project largely within the brainstem and spinal cord. NE, along with 5HT, ACh, histamine, and orexin, is a critical regulator of the sleep-wake cycle and of levels of arousal. ... LC firing may also increase anxiety ...Stimulation of β-adrenergic receptors in the amygdala results in enhanced memory for stimuli encoded under strong negative emotion ... Epinephrine occurs in only a small number of central neurons, all located in the medulla. Epinephrine is involved in visceral functions, such as control of respiration.
The ascending reticular activating system (ARAS) is responsible for a sustained wakefulness state. ... The thalamic projection is dominated by cholinergic neurons originating from the pedunculopontine tegmental nucleus of pons and midbrain (PPT) and laterodorsal tegmental nucleus of pons and midbrain (LDT) nuclei [17, 18]. The hypothalamic projection involves noradrenergic neurons of the locus coeruleus (LC) and serotoninergic neurons of the dorsal and median raphe nuclei (DR), which pass through the lateral hypothalamus and reach axons of the histaminergic tubero-mamillary nucleus (TMN), together forming a pathway extending into the forebrain, cortex and hippocampus. Cortical arousal also takes advantage of dopaminergic neurons of the substantia nigra (SN), ventral tegmenti area (VTA) and the periaqueductal grey area (PAG). Fewer cholinergic neurons of the pons and midbrain send projections to the forebrain along the ventral pathway, bypassing the thalamus [19, 20].
The ARAS is a complex structure consisting of several different circuits including the four monoaminergic pathways ... The norepinephrine pathway originates from the locus ceruleus (LC) and related brainstem nuclei; the serotonergic neurons originate from the raphe nuclei within the brainstem as well; the dopaminergic neurons originate in ventral tegmental area (VTA); and the histaminergic pathway originates from neurons in the tuberomammillary nucleus (TMN) of the posterior hypothalamus. As discussed in Chapter 6, these neurons project widely throughout the brain from restricted collections of cell bodies. Norepinephrine, serotonin, dopamine, and histamine have complex modulatory functions and, in general, promote wakefulness. The PT in the brain stem is also an important component of the ARAS. Activity of PT cholinergic neurons (REM-on cells) promotes REM sleep. During waking, REM-on cells are inhibited by a subset of ARAS norepinephrine and serotonin neurons called REM-off cells.
Neurons from the SNc densely innervate the dorsal striatum where they play a critical role in the learning and execution of motor programs. Neurons from the VTA innervate the ventral striatum (nucleus accumbens), olfactory bulb, amygdala, hippocampus, orbital and medial prefrontal cortex, and cingulate cortex. VTA DA neurons play a critical role in motivation, reward-related behavior, attention, and multiple forms of memory. ... Thus, acting in diverse terminal fields, dopamine confers motivational salience ("wanting") on the reward itself or associated cues (nucleus accumbens shell region), updates the value placed on different goals in light of this new experience (orbital prefrontal cortex), helps consolidate multiple forms of memory (amygdala and hippocampus), and encodes new motor programs that will facilitate obtaining this reward in the future (nucleus accumbens core region and dorsal striatum). ... DA has multiple actions in the prefrontal cortex. It promotes the "cognitive control" of behavior: the selection and successful monitoring of behavior to facilitate attainment of chosen goals. Aspects of cognitive control in which DA plays a role include working memory, the ability to hold information "on line" in order to guide actions, suppression of prepotent behaviors that compete with goal-directed actions, and control of attention and thus the ability to overcome distractions. ... Noradrenergic projections from the LC thus interact with dopaminergic projections from the VTA to regulate cognitive control. ...
Previous work has demonstrated that optogenetically stimulating D1 MSNs promotes reward, whereas stimulating D2 MSNs produces aversion.
Recent studies on intracranial self-administration of neurochemicals (drugs) found that rats learn to self-administer various drugs into the mesolimbic dopamine structures–the posterior ventral tegmental area, medial shell nucleus accumbens and medial olfactory tubercle. ... In the 1970s it was recognized that the olfactory tubercle contains a striatal component, which is filled with GABAergic medium spiny neurons receiving glutamatergic inputs form cortical regions and dopaminergic inputs from the VTA and projecting to the ventral pallidum just like the nucleus accumbens
Within the brain, histamine is synthesized exclusively by neurons with their cell bodies in the tuberomammillary nucleus (TMN) that lies within the posterior hypothalamus. There are approximately 64000 histaminergic neurons per side in humans. These cells project throughout the brain and spinal cord. Areas that receive especially dense projections include the cerebral cortex, hippocampus, neostriatum, nucleus accumbens, amygdala, and hypothalamus. ... While the best characterized function of the histamine system in the brain is regulation of sleep and arousal, histamine is also involved in learning and memory ...It also appears that histamine is involved in the regulation of feeding and energy balance.
[The] dorsal raphe preferentially innervates the cerebral cortex, thalamus, striatal regions (caudate-putamen and nucleus accumbens), and dopaminergic nuclei of the midbrain (eg, the substantia nigra and ventral tegmental area), while the median raphe innervates the hippocampus, septum, and other structures of the limbic forebrain. ... it is clear that 5HT influences sleep, arousal, attention, processing of sensory information in the cerebral cortex, and important aspects of emotion (likely including aggression) and mood regulation. ...The rostral nuclei, which include the nucleus linearis, dorsal raphe, medial raphe, and raphe pontis, innervate most of the brain, including the cerebellum. The caudal nuclei, which comprise the raphe magnus, raphe pallidus, and raphe obscuris, have more limited projections that terminate in the cerebellum, brainstem, and spinal cord.
The dorsal raphe is the primary site of serotonergic neurons in the brain, which, like noradrenergic neurons, pervasively modulate brain function to regulate the state of activation and mood of the organism.
The basal forebrain cholinergic nuclei are comprised the medial septal nucleus (Ch1), the vertical nucleus of the diagonal band (Ch2), the horizontal limb of the diagonal band (Ch3), and the nucleus basalis of Meynert (Ch4). Brainstem cholinergic nuclei include the pedunculopontine nucleus (Ch5), the laterodorsal tegmental nucleus (Ch6), the medial habenula (Ch7), and the parabigeminal nucleus (Ch8).
{{cite book}}: |journal= ignored (help){{cite book}}: |journal= ignored (help)