El hierro es un elemento químico ; tiene el símbolo Fe (del latín ferrum 'hierro') y número atómico 26. Es un metal que pertenece a la primera serie de transición y al grupo 8 de la tabla periódica . Es, por masa, el elemento más común en la Tierra , formando gran parte del núcleo externo e interno terrestre . Es el cuarto elemento más abundante en la corteza terrestre , siendo depositado principalmente por meteoritos en su estado metálico.
Para extraer metal utilizable de los minerales de hierro se necesitan hornos capaces de alcanzar 1.500 °C (2.730 °F), unos 500 °C (932 °F) más que los necesarios para fundir el cobre . Los humanos empezaron a dominar ese proceso en Eurasia durante el segundo milenio a. C. y el uso de herramientas y armas de hierro empezó a desplazar a las aleaciones de cobre –en algunas regiones, sólo alrededor del 1200 a. C.–. Ese acontecimiento se considera la transición de la Edad del Bronce a la Edad del Hierro . En el mundo moderno , las aleaciones de hierro, como el acero , el acero inoxidable , el hierro fundido y los aceros especiales , son con diferencia los metales industriales más comunes, debido a sus propiedades mecánicas y a su bajo coste. La industria siderúrgica es, pues, muy importante económicamente, y el hierro es el metal más barato, con un precio de unos pocos dólares el kilogramo o la libra.
Las superficies de hierro puro prístinas y lisas son de un gris plateado similar a un espejo. El hierro reacciona fácilmente con el oxígeno y el agua para producir óxidos de hierro hidratados de color marrón a negro , comúnmente conocidos como óxido . A diferencia de los óxidos de algunos otros metales que forman capas pasivantes , el óxido ocupa más volumen que el metal y, por lo tanto, se desprende, exponiendo más superficies frescas a la corrosión. Químicamente, los estados de oxidación más comunes del hierro son el hierro (II) y el hierro (III) . El hierro comparte muchas propiedades de otros metales de transición, incluidos los otros elementos del grupo 8 , el rutenio y el osmio . El hierro forma compuestos en una amplia gama de estados de oxidación , de −4 a +7. El hierro también forma muchos compuestos de coordinación ; algunos de ellos, como el ferroceno , el ferrioxalato y el azul de Prusia , tienen importantes aplicaciones industriales, médicas o de investigación.
El cuerpo de un ser humano adulto contiene alrededor de 4 gramos (0,005% del peso corporal) de hierro, principalmente en la hemoglobina y la mioglobina . Estas dos proteínas desempeñan papeles esenciales en el transporte de oxígeno por la sangre y el almacenamiento de oxígeno en los músculos . Para mantener los niveles necesarios, el metabolismo del hierro humano requiere un mínimo de hierro en la dieta. El hierro también es el metal en el sitio activo de muchas enzimas redox importantes que se ocupan de la respiración celular y la oxidación y reducción en plantas y animales. [9]

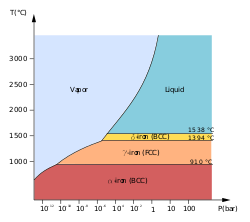
Se conocen al menos cuatro alótropos del hierro (disposiciones atómicas diferentes en el sólido), denominados convencionalmente α , γ , δ y ε .
Las primeras tres formas se observan a presiones ordinarias. A medida que el hierro fundido se enfría más allá de su punto de congelación de 1538 °C, cristaliza en su alótropo δ, que tiene una estructura cristalina cúbica centrada en el cuerpo (bcc) . A medida que se enfría aún más hasta 1394 °C, cambia a su alótropo de hierro γ, una estructura cristalina cúbica centrada en las caras (fcc), o austenita . A 912 °C y menos, la estructura cristalina vuelve a convertirse en el alótropo de hierro α bcc. [10]
Las propiedades físicas del hierro a presiones y temperaturas muy altas también se han estudiado ampliamente, [11] [12] debido a su relevancia para las teorías sobre los núcleos de la Tierra y otros planetas. Por encima de aproximadamente 10 GPa y temperaturas de unos pocos cientos de kelvin o menos, el hierro α cambia a otra estructura hexagonal compacta (hcp), que también se conoce como hierro ε . La fase γ de mayor temperatura también cambia a hierro ε, pero lo hace a mayor presión.
Existe evidencia experimental controvertida de una fase β estable a presiones superiores a 50 GPa y temperaturas de al menos 1500 K. Se supone que tiene una estructura ortorrómbica o doble hcp. [13] (De manera confusa, el término "hierro β" a veces también se usa para referirse al hierro α por encima de su punto de Curie, cuando cambia de ferromagnético a paramagnético, aunque su estructura cristalina no haya cambiado. [10] )
En general, se supone que el núcleo interno de la Tierra consiste en una aleación de hierro y níquel con estructura ε (o β). [14]
Los puntos de fusión y ebullición del hierro, junto con su entalpía de atomización , son más bajos que los de los elementos 3d anteriores, desde el escandio hasta el cromo , lo que muestra la menor contribución de los electrones 3d a la unión metálica a medida que son atraídos cada vez más hacia el núcleo inerte por el núcleo; [15] sin embargo, son más altos que los valores para el elemento anterior, el manganeso, porque ese elemento tiene una subcapa 3d medio llena y, en consecuencia, sus electrones d no se deslocalizan fácilmente. Esta misma tendencia aparece para el rutenio, pero no para el osmio . [16]
El punto de fusión del hierro está bien definido experimentalmente para presiones inferiores a 50 GPa. Para presiones mayores, los datos publicados (hasta 2007) aún varían en decenas de gigapascales y más de mil kelvin. [17]

Por debajo de su punto de Curie de 770 °C (1420 °F; 1040 K), el hierro α cambia de paramagnético a ferromagnético : los espines de los dos electrones desapareados en cada átomo generalmente se alinean con los espines de sus vecinos, creando un campo magnético general . [19] Esto sucede porque los orbitales de esos dos electrones (d z 2 y d x 2 − y 2 ) no apuntan hacia átomos vecinos en la red y, por lo tanto, no están involucrados en el enlace metálico. [10]
En ausencia de una fuente externa de campo magnético, los átomos se dividen espontáneamente en dominios magnéticos de unos 10 micrómetros de diámetro [20] , de modo que los átomos de cada dominio tienen espines paralelos, pero algunos dominios tienen otras orientaciones. Por lo tanto, una pieza macroscópica de hierro tendrá un campo magnético general casi nulo.
La aplicación de un campo magnético externo hace que los dominios que están magnetizados en la misma dirección general crezcan a expensas de los adyacentes que apuntan en otras direcciones, reforzando el campo externo. Este efecto se explota en dispositivos que necesitan canalizar campos magnéticos para cumplir la función de diseño, como transformadores eléctricos , cabezales de grabación magnética y motores eléctricos . Las impurezas, los defectos de la red o los límites de grano y partículas pueden "fijar" los dominios en las nuevas posiciones, de modo que el efecto persista incluso después de que se elimine el campo externo, convirtiendo así el objeto de hierro en un imán (permanente) . [19]
Algunos compuestos de hierro, como las ferritas , que incluyen el mineral magnetita , una forma cristalina del óxido de hierro (II, III) mixto Fe 3 O 4 (aunque el mecanismo a escala atómica, el ferrimagnetismo , es algo diferente), exhiben un comportamiento similar. Los trozos de magnetita con magnetización permanente natural ( piedras imán ) proporcionaron las primeras brújulas para la navegación. Las partículas de magnetita se usaron ampliamente en medios de grabación magnéticos como memorias de núcleo , cintas magnéticas , disquetes y discos , hasta que fueron reemplazados por materiales a base de cobalto .
El hierro tiene cuatro isótopos estables : 54 Fe (5,845% del hierro natural), 56 Fe (91,754%), 57 Fe (2,119%) y 58 Fe (0,282%). También se han creado veinticuatro isótopos artificiales. De estos isótopos estables, solo 57 Fe tiene un espín nuclear (− 1 ⁄ 2 ). El nucleido 54 Fe teóricamente puede sufrir una doble captura de electrones para formar 54 Cr, pero el proceso nunca se ha observado y solo se ha establecido un límite inferior para la vida media de 4,4×10 20 años. [21]
El 60 Fe es un radionucleido extinto de vida media larga (2,6 millones de años). [22] No se encuentra en la Tierra, pero su producto de desintegración final es su nieta, el nucleido estable 60 Ni . [8] Gran parte del trabajo anterior sobre la composición isotópica del hierro se ha centrado en la nucleosíntesis del 60 Fe a través de estudios de meteoritos y formación de minerales. En la última década, los avances en espectrometría de masas han permitido la detección y cuantificación de pequeñas variaciones naturales en las proporciones de los isótopos estables del hierro. Gran parte de este trabajo está impulsado por las comunidades científicas de la Tierra y planetarias , aunque están surgiendo aplicaciones a sistemas biológicos e industriales. [23]
En las fases de los meteoritos Semarkona y Chervony Kut, una correlación entre la concentración de 60 Ni, la nieta de 60 Fe, y la abundancia de los isótopos estables de hierro proporcionó evidencia de la existencia de 60 Fe en el momento de la formación del Sistema Solar . Posiblemente la energía liberada por la desintegración de 60 Fe, junto con la liberada por 26 Al , contribuyó a la refundición y diferenciación de los asteroides después de su formación hace 4.600 millones de años. La abundancia de 60 Ni presente en material extraterrestre puede aportar más información sobre el origen y la historia temprana del Sistema Solar . [24]
El isótopo de hierro más abundante, el 56 Fe, es de particular interés para los científicos nucleares porque representa el punto final más común de la nucleosíntesis . [25] Dado que el 56 Ni (14 partículas alfa ) se produce fácilmente a partir de núcleos más ligeros en el proceso alfa en reacciones nucleares en supernovas (véase proceso de quema de silicio ), es el punto final de las cadenas de fusión dentro de estrellas extremadamente masivas . Aunque es posible añadir más partículas alfa, no obstante la secuencia termina efectivamente en el 56 Ni porque las condiciones en el interior estelar hacen que la competencia entre la fotodesintegración y el proceso alfa favorezca la fotodesintegración alrededor del 56 Ni. [26] [27] Este 56 Ni, que tiene una vida media de unos 6 días, se crea en cantidad en estas estrellas, pero pronto se desintegra mediante dos emisiones de positrones sucesivas dentro de los productos de desintegración de la supernova en la nube de gas remanente de la supernova , primero en 56 Co radiactivo y luego en 56 Fe estable. Como tal, el hierro es el elemento más abundante en el núcleo de las gigantes rojas , y es el metal más abundante en los meteoritos de hierro y en los núcleos metálicos densos de planetas como la Tierra . [28] También es muy común en el universo, en relación con otros metales estables de aproximadamente el mismo peso atómico . [28] [29] El hierro es el sexto elemento más abundante en el universo , y el elemento refractario más común. [30]
Aunque se podría obtener una pequeña ganancia de energía adicional sintetizando 62 Ni , que tiene una energía de enlace ligeramente superior a la del 56 Fe, las condiciones en las estrellas no son adecuadas para este proceso. La producción de elementos en supernovas favorece en gran medida al hierro sobre el níquel y, en cualquier caso, el 56 Fe todavía tiene una masa por nucleón menor que el 62 Ni debido a su mayor fracción de protones más ligeros. [31] Por lo tanto, los elementos más pesados que el hierro requieren una supernova para su formación, lo que implica una rápida captura de neutrones mediante el inicio de núcleos de 56 Fe. [28]
En un futuro lejano del universo, suponiendo que no se produzca la desintegración de protones , la fusión fría que se produce a través de un efecto túnel cuántico haría que los núcleos ligeros de la materia ordinaria se fusionaran en núcleos de 56 Fe. La fisión y la emisión de partículas alfa harían que los núcleos pesados se desintegraran en hierro, convirtiendo todos los objetos de masa estelar en esferas frías de hierro puro. [32]
La abundancia de hierro en planetas rocosos como la Tierra se debe a su abundante producción durante la fusión descontrolada y la explosión de supernovas de tipo Ia , que dispersan el hierro en el espacio. [33] [34]

El hierro metálico o nativo rara vez se encuentra en la superficie de la Tierra porque tiende a oxidarse. Sin embargo, se cree que tanto el núcleo interno como el externo de la Tierra , que juntos representan el 35% de la masa de toda la Tierra, consisten principalmente en una aleación de hierro, posiblemente con níquel . Se cree que las corrientes eléctricas en el núcleo externo líquido son el origen del campo magnético de la Tierra . Se cree que los otros planetas terrestres ( Mercurio , Venus y Marte ), así como la Luna, tienen un núcleo metálico que consiste principalmente en hierro. También se cree que los asteroides de tipo M están hechos parcial o principalmente de una aleación de hierro metálico.
Los meteoritos de hierro, poco frecuentes , son la principal forma de hierro metálico natural en la superficie de la Tierra. Se han encontrado objetos hechos de hierro meteorítico trabajado en frío en varios sitios arqueológicos que datan de una época en la que la fundición de hierro aún no se había desarrollado; y se ha informado de que los inuit de Groenlandia utilizan el hierro del meteorito de Cabo York para herramientas y armas de caza. [35] Aproximadamente 1 de cada 20 meteoritos consiste en los minerales únicos de hierro y níquel taenita (35-80% de hierro) y kamacita (90-95% de hierro). [36] El hierro nativo también se encuentra raramente en basaltos que se han formado a partir de magmas que han entrado en contacto con rocas sedimentarias ricas en carbono, que han reducido la fugacidad del oxígeno lo suficiente como para que el hierro cristalice. Esto se conoce como hierro telúrico y se describe en unas pocas localidades, como la isla Disko en el oeste de Groenlandia, Yakutia en Rusia y Bühl en Alemania. [37]
La ferropericlasa (Mg,Fe)O , una solución sólida de periclasa (MgO) y wüstita (FeO), constituye aproximadamente el 20% del volumen del manto inferior de la Tierra, lo que la convierte en la segunda fase mineral más abundante en esa región después de la perovskita de silicato (Mg,Fe)SiO 3 ; también es el principal huésped del hierro en el manto inferior. [38] En la parte inferior de la zona de transición del manto, la reacción γ- (Mg,Fe) 2 [SiO 4 ] ↔ (Mg,Fe)[SiO 3 ] + (Mg,Fe)O transforma la γ-olivina en una mezcla de perovskita de silicato y ferropericlasa y viceversa. En la literatura, esta fase mineral del manto inferior también se denomina a menudo magnesiowüstita. [39] La perovskita de silicato puede formar hasta el 93% del manto inferior, [40] y la forma de hierro y magnesio, (Mg,Fe)SiO 3 , se considera el mineral más abundante en la Tierra, representando el 38% de su volumen. [41]

Si bien el hierro es el elemento más abundante en la Tierra, la mayor parte de este hierro se concentra en los núcleos interno y externo . [42] [43] La fracción de hierro que se encuentra en la corteza terrestre solo representa alrededor del 5% de la masa total de la corteza y, por lo tanto, es solo el cuarto elemento más abundante en esa capa (después del oxígeno , el silicio y el aluminio ). [44]
La mayor parte del hierro en la corteza se combina con varios otros elementos para formar muchos minerales de hierro . Una clase importante son los minerales de óxido de hierro como la hematita (Fe 2 O 3 ), la magnetita (Fe 3 O 4 ) y la siderita (FeCO 3 ), que son los principales minerales de hierro . Muchas rocas ígneas también contienen los minerales de sulfuro pirrotita y pentlandita . [45] [46] Durante la meteorización , el hierro tiende a lixiviarse de los depósitos de sulfuro como sulfato y de los depósitos de silicato como bicarbonato. Ambos se oxidan en solución acuosa y precipitan incluso en pH ligeramente elevado como óxido de hierro (III) . [47]

Los grandes depósitos de hierro son formaciones de hierro bandeado , un tipo de roca que consiste en capas delgadas repetidas de óxidos de hierro que se alternan con bandas de esquisto y sílex pobres en hierro . Las formaciones de hierro bandeado se formaron en el período comprendido entre hace 3.700 millones de años y hace 1.800 millones de años . [48] [49]
Los materiales que contienen óxidos de hierro (III) finamente molidos u óxido-hidróxidos, como el ocre , se han utilizado como pigmentos amarillos, rojos y marrones desde tiempos prehistóricos. También contribuyen al color de varias rocas y arcillas , incluidas formaciones geológicas enteras como las Painted Hills en Oregón y el Buntsandstein ("arenisca coloreada", Bunter británico ). [50] A través del Eisensandstein (una "arenisca de hierro" jurásica , por ejemplo de Donzdorf en Alemania) [51] y la piedra de Bath en el Reino Unido, los compuestos de hierro son responsables del color amarillento de muchos edificios y esculturas históricas. [52] El proverbial color rojo de la superficie de Marte se deriva de un regolito rico en óxido de hierro . [53]
Se encuentran cantidades significativas de hierro en el mineral de sulfuro de hierro pirita (FeS 2 ), pero es difícil extraer hierro de él y por lo tanto no se explota. [54] De hecho, el hierro es tan común que la producción generalmente se centra solo en minerales con cantidades muy altas de este mineral. [55]
Según el informe Metal Stocks in Society del Panel Internacional de Recursos , las reservas mundiales de hierro en uso en la sociedad son de 2.200 kg per cápita. Los países más desarrollados difieren en este aspecto de los países menos desarrollados (7.000–14.000 frente a 2.000 kg per cápita). [56]
La ciencia oceánica demostró el papel del hierro en los mares antiguos tanto en la biota marina como en el clima. [57]
El hierro muestra las propiedades químicas características de los metales de transición , a saber, la capacidad de formar estados de oxidación variables que difieren en pasos de uno y una química organometálica y de coordinación muy grande : de hecho, fue el descubrimiento de un compuesto de hierro, el ferroceno , lo que revolucionó este último campo en la década de 1950. [59] El hierro a veces se considera como un prototipo para todo el bloque de metales de transición, debido a su abundancia y al inmenso papel que ha desempeñado en el progreso tecnológico de la humanidad. [60] Sus 26 electrones están dispuestos en la configuración [Ar]3d 6 4s 2 , de los cuales los electrones 3d y 4s están relativamente cerca en energía, y por lo tanto se pueden ionizar varios electrones. [16]
El hierro forma compuestos principalmente en los estados de oxidación +2 ( hierro(II) , "ferroso") y +3 ( hierro(III) , "férrico"). El hierro también se presenta en estados de oxidación superiores , por ejemplo, el ferrato de potasio púrpura ( K2FeO4 ), que contiene hierro en su estado de oxidación +6. El anión [FeO4 ] – con hierro en su estado de oxidación +7, junto con un isómero peroxo de hierro(V), se ha detectado mediante espectroscopia infrarroja a 4 K después de la cocondensación de átomos de Fe eliminados por láser con una mezcla de O2 / Ar. [61] El hierro(IV) es un intermediario común en muchas reacciones de oxidación bioquímica. [62] [63] Numerosos compuestos de organohierro contienen estados de oxidación formales de +1, 0, −1 o incluso −2. Los estados de oxidación y otras propiedades de enlace a menudo se evalúan utilizando la técnica de espectroscopia Mössbauer . [64] Muchos compuestos de valencia mixta contienen centros de hierro (II) y hierro (III), como la magnetita y el azul de Prusia ( Fe 4 (Fe[CN] 6 ) 3 ). [63] Este último se utiliza como el "azul" tradicional en los planos . [65]
El hierro es el primero de los metales de transición que no puede alcanzar su estado de oxidación grupal de +8, aunque sus congéneres más pesados, el rutenio y el osmio, sí pueden, y el rutenio tiene más dificultades que el osmio. [10] El rutenio exhibe una química catiónica acuosa en sus estados de oxidación bajos similar a la del hierro, pero el osmio no, favoreciendo los estados de oxidación altos en los que forma complejos aniónicos. [10] En la segunda mitad de la serie de transición 3d, las similitudes verticales hacia abajo en los grupos compiten con las similitudes horizontales del hierro con sus vecinos cobalto y níquel en la tabla periódica, que también son ferromagnéticos a temperatura ambiente y comparten una química similar. Como tal, el hierro, el cobalto y el níquel a veces se agrupan juntos como la tríada del hierro . [60]
A diferencia de muchos otros metales, el hierro no forma amalgamas con el mercurio . Por ello, el mercurio se comercializa en frascos estandarizados de 76 libras (34 kg) hechos de hierro. [66]
El hierro es, con mucho, el elemento más reactivo de su grupo; es pirofórico cuando está finamente dividido y se disuelve fácilmente en ácidos diluidos, dando Fe 2+ . Sin embargo, no reacciona con ácido nítrico concentrado y otros ácidos oxidantes debido a la formación de una capa de óxido impermeable, que sin embargo puede reaccionar con ácido clorhídrico . [10] El hierro de alta pureza, llamado hierro electrolítico , se considera resistente al óxido, debido a su capa de óxido.
El hierro forma diversos compuestos de óxido e hidróxido ; los más comunes son el óxido de hierro (II, III) (Fe 3 O 4 ) y el óxido de hierro (III) (Fe 2 O 3 ). También existe el óxido de hierro (II) , aunque es inestable a temperatura ambiente. A pesar de sus nombres, en realidad son todos compuestos no estequiométricos cuyas composiciones pueden variar. [67] Estos óxidos son los principales minerales para la producción de hierro (véase el horno de vapor y el alto horno). También se utilizan en la producción de ferritas , medios de almacenamiento magnéticos útiles en computadoras y pigmentos. El sulfuro más conocido es la pirita de hierro (FeS 2 ), también conocida como oro de los tontos debido a su brillo dorado. [63] No es un compuesto de hierro (IV), sino que es en realidad un polisulfuro de hierro (II) que contiene Fe 2+ y S2−
2iones en una estructura distorsionada de cloruro de sodio . [67]

_chloride_hexahydrate.jpg/440px-Iron(III)_chloride_hexahydrate.jpg)
Los haluros ferrosos y férricos binarios son bien conocidos. Los haluros ferrosos surgen típicamente del tratamiento del metal de hierro con el ácido hidrohálico correspondiente para dar las sales hidratadas correspondientes. [63]
El hierro reacciona con flúor, cloro y bromo para dar los haluros férricos correspondientes, siendo el cloruro férrico el más común. [68]
El yoduro férrico es una excepción, siendo termodinámicamente inestable debido al poder oxidante del Fe 3+ y al alto poder reductor del I − : [68]
El yoduro férrico, un sólido negro, no es estable en condiciones ordinarias, pero se puede preparar mediante la reacción de pentacarbonilo de hierro con yodo y monóxido de carbono en presencia de hexano y luz a una temperatura de -20 °C, con oxígeno y agua excluidos. [68] Se sabe que los complejos de yoduro férrico con algunas bases blandas son compuestos estables. [69] [70]

Los potenciales de reducción estándar en solución acuosa ácida para algunos iones de hierro comunes se dan a continuación: [10]
El anión ferrato tetraédrico rojo-púrpura (VI) es un agente oxidante tan fuerte que oxida el amoníaco a nitrógeno (N 2 ) y el agua a oxígeno: [68]
El complejo hexacuoso violeta pálido [Fe(H 2 O) 6 ] 3+ es un ácido tal que por encima de pH 0 está completamente hidrolizado: [71]
-sulfate-heptahydrate-sample.jpg/440px-Iron(II)-sulfate-heptahydrate-sample.jpg)
A medida que el pH se eleva por encima de 0, se forman las especies hidrolizadas amarillas anteriores y, a medida que se eleva por encima de 2-3, precipita de la solución óxido de hierro(III) hidratado de color marrón rojizo. Aunque el Fe3 + tiene una configuración ad 5 , su espectro de absorción no es como el del Mn2 + con sus bandas d–d débiles y de espín prohibido, porque el Fe3 + tiene una carga positiva más alta y es más polarizante, lo que reduce la energía de sus absorciones de transferencia de carga de ligando a metal . Por lo tanto, todos los complejos anteriores tienen un color bastante intenso, con la única excepción del ion hexaquo, e incluso este tiene un espectro dominado por la transferencia de carga en la región cercana al ultravioleta. [71] Por otro lado, el ion hexaquo de hierro(II) verde pálido [Fe(H2O ) 6 ] 2+ no sufre una hidrólisis apreciable. No se desprende dióxido de carbono cuando se añaden aniones de carbonato , lo que en cambio da como resultado la precipitación de carbonato de hierro(II) blanco . El exceso de dióxido de carbono forma bicarbonato, ligeramente soluble, que se encuentra comúnmente en las aguas subterráneas, pero se oxida rápidamente en el aire para formar óxido de hierro (III) , que es responsable de los depósitos marrones presentes en una cantidad considerable de arroyos. [72]
Debido a su estructura electrónica, el hierro tiene una coordinación y química organometálica muy grande.

Se conocen muchos compuestos de coordinación de hierro. Un anión típico de seis coordenadas es el hexacloroferrato (III), [FeCl 6 ] 3− , que se encuentra en la sal mixta cloruro de tetrakis(metilamonio) hexacloroferrato (III) . [73] [74] Los complejos con múltiples ligandos bidentados tienen isómeros geométricos . Por ejemplo, el complejo trans - clorohidridobis(bis-1,2-(difenilfosfino)etano)hierro (II) se utiliza como material de partida para compuestos con la fracción Fe( dppe ) 2 . [75] [76] El ion ferrioxalato con tres ligandos oxalato muestra quiralidad helicoidal con sus dos geometrías no superponibles etiquetadas Λ (lambda) para el eje de tornillo zurdo y Δ (delta) para el eje de tornillo diestro, de acuerdo con las convenciones de la IUPAC. [71] El ferrioxalato de potasio se utiliza en actinometría química y, junto con su sal de sodio, se somete a fotorreducción aplicada en los procesos fotográficos de estilo antiguo. El dihidrato de oxalato de hierro (II) tiene una estructura polimérica con iones de oxalato coplanares que forman puentes entre los centros de hierro y el agua de cristalización que se encuentra formando las tapas de cada octaedro, como se ilustra a continuación. [77]

iron(III)_chloride.jpg/440px-Pentaaqua(thiocyanato)iron(III)_chloride.jpg)
Los complejos de hierro (III) son bastante similares a los de cromo (III), con la excepción de la preferencia del hierro (III) por ligandos donantes de O en lugar de ligandos donantes de N. Estos últimos tienden a ser bastante más inestables que los complejos de hierro (II) y a menudo se disocian en agua. Muchos complejos de Fe-O muestran colores intensos y se utilizan como pruebas para fenoles o enoles . Por ejemplo, en la prueba de cloruro férrico , utilizada para determinar la presencia de fenoles, el cloruro de hierro (III) reacciona con un fenol para formar un complejo de color violeta oscuro: [71]
Entre los complejos de haluro y pseudohaluro, los complejos de flúor de hierro(III) son los más estables, siendo el incoloro [FeF 5 (H 2 O)] 2− el más estable en solución acuosa. Los complejos de cloro son menos estables y favorecen la coordinación tetraédrica como en [FeCl 4 ] − ; [FeBr 4 ] − y [FeI 4 ] − se reducen fácilmente a hierro(II). El tiocianato es una prueba común para la presencia de hierro(III), ya que forma el rojo sangre [Fe(SCN)(H 2 O) 5 ] 2+ . Al igual que el manganeso(II), la mayoría de los complejos de hierro(III) son de alto espín, las excepciones son aquellos con ligandos que están altos en la serie espectroquímica, como el cianuro . Un ejemplo de un complejo de hierro(III) de bajo espín es [Fe(CN) 6 ] 3− . El hierro muestra una gran variedad de estados de espín electrónico , incluidos todos los valores posibles de número cuántico de espín para un elemento del bloque d, desde 0 (diamagnético) hasta 5 ⁄ 2 (5 electrones desapareados). Este valor es siempre la mitad del número de electrones desapareados. Los complejos con cero a dos electrones desapareados se consideran de espín bajo y aquellos con cuatro o cinco se consideran de espín alto. [67]
Los complejos de hierro (II) son menos estables que los complejos de hierro (III), pero la preferencia por los ligandos O -donadores es menos marcada, de modo que, por ejemplo, se conoce [Fe(NH 3 ) 6 ] 2+ , mientras que no se conoce [Fe(NH 3 ) 6 ] 3+ . Tienen una tendencia a oxidarse a hierro (III), pero esto puede moderarse con un pH bajo y los ligandos específicos utilizados. [72]

La química de organohierro es el estudio de los compuestos organometálicos de hierro, donde los átomos de carbono están unidos covalentemente al átomo de metal. Son muchos y variados, incluyendo complejos de cianuro , complejos de carbonilo , compuestos sándwich y semisándwich .

El azul de Prusia o "ferrocianuro férrico", Fe 4 [Fe(CN) 6 ] 3 , es un complejo de hierro-cianuro muy conocido y muy utilizado como pigmento y en otras aplicaciones. Su formación se puede utilizar como una prueba de química húmeda simple para distinguir entre soluciones acuosas de Fe 2+ y Fe 3+ a medida que reaccionan (respectivamente) con ferricianuro de potasio y ferrocianuro de potasio para formar azul de Prusia. [63]
Otro ejemplo antiguo de un compuesto de organohierro es el pentacarbonilo de hierro , Fe(CO) 5 , en el que un átomo de hierro neutro está unido a los átomos de carbono de cinco moléculas de monóxido de carbono . El compuesto se puede utilizar para hacer polvo de hierro carbonílico , una forma altamente reactiva de hierro metálico. La termólisis del pentacarbonilo de hierro da lugar a un complejo con un grupo de tres átomos de hierro en su núcleo. El reactivo de Collman, el tetracarbonilferrato de disodio , es un reactivo útil para la química orgánica; contiene hierro en el estado de oxidación -2. El dímero de dicarbonilo de ciclopentadieniliron contiene hierro en el raro estado de oxidación +1. [78]
Un hito en este campo fue el descubrimiento en 1951 del compuesto sándwich notablemente estable ferroceno Fe(C 5 H 5 ) 2 , por Pauson y Kealy [79] e independientemente por Miller y colegas, [80] cuya sorprendente estructura molecular fue determinada solo un año después por Woodward y Wilkinson [81] y Fischer . [82] El ferroceno sigue siendo una de las herramientas y modelos más importantes en esta clase. [83]
Como catalizadores se utilizan especies organometálicas centradas en el hierro . El complejo de Knölker , por ejemplo, es un catalizador de hidrogenación por transferencia para cetonas . [84]
Los compuestos de hierro que se producen en mayor escala en la industria son el sulfato de hierro (II) (FeSO 4 ·7 H 2 O ) y el cloruro de hierro (III) (FeCl 3 ). El primero es una de las fuentes de hierro (II) más fácilmente disponibles, pero es menos estable a la oxidación aérea que la sal de Mohr ( (NH 4 ) 2 Fe(SO 4 ) 2 ·6H 2 O ). Los compuestos de hierro (II) tienden a oxidarse a compuestos de hierro (III) en el aire. [63]
El hierro es uno de los elementos indudablemente conocidos en el mundo antiguo. [85] Se ha trabajado o forjado durante milenios. Sin embargo, los artefactos de hierro de gran antigüedad son mucho más raros que los objetos hechos de oro o plata debido a la facilidad con la que el hierro se corroe. [86] La tecnología se desarrolló lentamente, e incluso después del descubrimiento de la fundición pasaron muchos siglos hasta que el hierro reemplazó al bronce como el metal preferido para herramientas y armas.

GA Wainwright encontró en Gerzeh , Egipto, cuentas fabricadas con hierro meteórico en el año 3500 a. C. o antes . [87] Las cuentas contienen un 7,5 % de níquel, lo que es una señal de origen meteórico, ya que el hierro que se encuentra en la corteza terrestre generalmente solo tiene impurezas minúsculas de níquel.
El hierro meteórico era muy apreciado debido a su origen en los cielos y a menudo se usaba para forjar armas y herramientas. [87] Por ejemplo, se encontró una daga hecha de hierro meteórico en la tumba de Tutankamón , que contenía proporciones similares de hierro, cobalto y níquel a un meteorito descubierto en el área, depositado por una antigua lluvia de meteoritos. [88] [89] [90] Los artículos que probablemente fueron hechos de hierro por los egipcios datan de 3000 a 2500 a. C. [86]
El hierro meteorítico es comparativamente blando y dúctil y se forja fácilmente en frío, pero puede volverse quebradizo cuando se calienta debido al contenido de níquel . [91]

La primera producción de hierro comenzó en la Edad del Bronce Medio , pero pasaron varios siglos antes de que el hierro desplazara al bronce. Se hicieron muestras de hierro fundido de Asmar , Mesopotamia y Tall Chagar Bazaar en el norte de Siria en algún momento entre 3000 y 2700 a. C. [92] Los hititas establecieron un imperio en el centro-norte de Anatolia alrededor de 1600 a. C. Parecen ser los primeros en comprender la producción de hierro a partir de sus minerales y lo consideraban muy importante en su sociedad. [93] Los hititas comenzaron a fundir hierro entre 1500 y 1200 a. C. y la práctica se extendió al resto del Cercano Oriente después de que su imperio cayera en 1180 a. C. [92] El período posterior se llama Edad del Hierro .
Se han encontrado artefactos de hierro fundido en la India que datan de 1800 a 1200 a. C., [94] y en el Levante desde aproximadamente 1500 a. C. (lo que sugiere que la fundición se realizó en Anatolia o el Cáucaso ). [95] [96] Se han utilizado supuestas referencias (compárese con la historia de la metalurgia en el sur de Asia ) al hierro en los Vedas indios para afirmar un uso muy temprano del hierro en la India, respectivamente, para datar los textos como tales. El término rigveda ayas (metal) se refiere al cobre, mientras que el hierro, que se denomina śyāma ayas , literalmente "cobre negro", se menciona por primera vez en el Atharvaveda post-rigvédico . [97]
Algunas evidencias arqueológicas sugieren que el hierro se fundía en Zimbabwe y el sudeste de África ya en el siglo VIII a. C. [98] El trabajo del hierro se introdujo en Grecia a fines del siglo XI a. C., desde donde se extendió rápidamente por toda Europa. [99]

La difusión de la siderurgia en Europa central y occidental está asociada a la expansión celta . Según Plinio el Viejo , el uso del hierro era común en la época romana . [87] En las tierras de lo que ahora se considera China, el hierro aparece aproximadamente entre el 700 y el 500 a. C. [100] La fundición de hierro puede haberse introducido en China a través de Asia central. [101] La evidencia más temprana del uso de un alto horno en China data del siglo I d. C., [102] y los hornos de cubilote se usaban ya en el período de los Reinos Combatientes (403-221 a. C.). [103] El uso del alto horno y del cubilote siguió estando muy extendido durante las dinastías Tang y Song . [104]
Durante la Revolución Industrial en Gran Bretaña, Henry Cort comenzó a refinar el hierro, desde el arrabio hasta el hierro forjado (o hierro en barras), utilizando sistemas de producción innovadores. En 1783 patentó el proceso de pudling para refinar el mineral de hierro. Más tarde fue mejorado por otros, entre ellos Joseph Hall . [105]
El hierro fundido se produjo por primera vez en China durante el siglo V a. C., [106] pero apenas se utilizó en Europa hasta el período medieval. [107] [108] Los primeros artefactos de hierro fundido fueron descubiertos por arqueólogos en lo que ahora es el moderno condado de Luhe , Jiangsu en China. El hierro fundido se usaba en la antigua China para la guerra, la agricultura y la arquitectura. [109] Durante el período medieval , se encontraron medios en Europa para producir hierro forjado a partir de hierro fundido (en este contexto conocido como arrabio ) utilizando forjas de refinación . Para todos estos procesos, se necesitaba carbón vegetal como combustible. [110]

Los altos hornos medievales tenían unos 3 metros de alto y estaban hechos de ladrillos ignífugos; el aire forzado se suministraba normalmente mediante fuelles accionados manualmente. [108] Los altos hornos modernos han crecido mucho más, con hogares de catorce metros de diámetro que les permiten producir miles de toneladas de hierro cada día, pero funcionan esencialmente de la misma manera que en la época medieval. [110]
En 1709, Abraham Darby I estableció un alto horno alimentado con coque para producir hierro fundido, reemplazando al carbón vegetal, aunque siguió utilizando altos hornos. La consiguiente disponibilidad de hierro barato fue uno de los factores que llevaron a la Revolución Industrial . Hacia fines del siglo XVIII, el hierro fundido comenzó a reemplazar al hierro forjado para ciertos propósitos, porque era más barato. El contenido de carbono en el hierro no se implicó como la razón de las diferencias en las propiedades del hierro forjado, el hierro fundido y el acero hasta el siglo XVIII. [92]
Como el hierro se estaba volviendo más barato y abundante, también se convirtió en un material estructural importante después de la construcción del primer puente de hierro innovador en 1778. Este puente todavía se mantiene en pie hoy como un monumento al papel que jugó el hierro en la Revolución Industrial. Después de esto, el hierro se utilizó en rieles, barcos, buques, acueductos y edificios, así como en cilindros de hierro en máquinas de vapor . [110] Los ferrocarriles han sido fundamentales para la formación de la modernidad y las ideas de progreso [111] y varios idiomas se refieren a los ferrocarriles como caminos de hierro (por ejemplo, francés chemin de fer , alemán Eisenbahn , turco demiryolu , ruso железная дорога , chino, japonés y coreano鐵道, vietnamita đường sắt ).
El acero (con un contenido de carbono menor que el hierro fundido pero mayor que el hierro forjado) se producía por primera vez en la antigüedad mediante el uso de una forjadora . Los herreros de Luristán , en el oeste de Persia, ya fabricaban acero de buena calidad en el año 1000 a. C. [92] Luego, alrededor del 300 a. C. y el 500 d. C., se desarrollaron versiones mejoradas, el acero Wootz de la India y el acero de Damasco , respectivamente. Estos métodos eran especializados, por lo que el acero no se convirtió en un producto básico importante hasta la década de 1850. [112]
En el siglo XVII se idearon nuevos métodos para producirlo mediante la carburación de barras de hierro en el proceso de cementación . En la Revolución Industrial se idearon nuevos métodos para producir barras de hierro sin carbón, que luego se aplicaron para producir acero. A fines de la década de 1850, Henry Bessemer inventó un nuevo proceso de fabricación de acero que implicaba soplar aire a través de arrabio fundido para producir acero dulce. Esto hizo que el acero fuera mucho más económico, lo que llevó a que el hierro forjado ya no se produjera en grandes cantidades. [113]
En 1774, Antoine Lavoisier utilizó la reacción del vapor de agua con hierro metálico dentro de un tubo de hierro incandescente para producir hidrógeno en sus experimentos que llevaron a la demostración de la conservación de la masa , lo que fue fundamental para cambiar la química de una ciencia cualitativa a una cuantitativa. [114]
.jpg/440px-Eisernes_Kreuz_(1914).jpg)
El hierro desempeña un papel determinado en la mitología y ha encontrado diversos usos como metáfora y en el folclore . En Los trabajos y los días del poeta griego Hesíodo (líneas 109-201) se enumeran diferentes eras del hombre que llevan el nombre de metales como el oro, la plata, el bronce y el hierro para dar cuenta de las sucesivas eras de la humanidad. [115] La Edad del Hierro estaba estrechamente relacionada con Roma, y en Las metamorfosis de Ovidio
Las virtudes, desesperadas, abandonan la tierra y la depravación del hombre se vuelve universal y completa. El acero duro lo sustituyó.
— Ovidio, Metamorfosis , Libro I, Edad de hierro, línea 160 y siguientes.
Un ejemplo de la importancia del papel simbólico del hierro se puede encontrar en la Campaña Alemana de 1813. Federico Guillermo III encargó entonces la primera Cruz de Hierro como condecoración militar. La joyería de hierro de Berlín alcanzó su pico de producción entre 1813 y 1815, cuando la familia real prusiana instó a los ciudadanos a donar joyas de oro y plata para la financiación militar. La inscripción Ich gab Gold für Eisen (Di oro por hierro) también se utilizó en posteriores esfuerzos bélicos. [116]

Para algunos propósitos limitados cuando es necesario, el hierro puro se produce en el laboratorio en pequeñas cantidades reduciendo el óxido o hidróxido puro con hidrógeno, o formando pentacarbonilo de hierro y calentándolo a 250 °C para que se descomponga y forme polvo de hierro puro. [47] Otro método es la electrólisis del cloruro ferroso sobre un cátodo de hierro. [117]
En la actualidad, la producción industrial de hierro o acero consta de dos etapas principales. En la primera etapa, el mineral de hierro se reduce con coque en un alto horno y el metal fundido se separa de las impurezas gruesas, como los minerales de silicato . Esta etapa produce una aleación ( arrabio ) que contiene cantidades relativamente grandes de carbono. En la segunda etapa, la cantidad de carbono en el arrabio se reduce por oxidación para producir hierro forjado, acero o hierro fundido. [119] En esta etapa se pueden añadir otros metales para formar aceros aleados .
El alto horno se carga con minerales de hierro, generalmente hematita Fe2O3 o magnetita Fe3O4 , junto con coque ( carbón que se ha horneado por separado para eliminar los componentes volátiles) y fundente ( caliza o dolomita ) . Se insuflan "ráfagas" de aire precalentado a 900 °C (a veces enriquecido con oxígeno) a través de la mezcla, en cantidad suficiente para convertir el carbono en monóxido de carbono : [119]
Esta reacción eleva la temperatura a unos 2000 °C. El monóxido de carbono reduce el mineral de hierro a hierro metálico: [119]
Parte del hierro en la región inferior de alta temperatura del horno reacciona directamente con el coque: [119]
El fundente elimina los minerales silíceos del mineral, que de otro modo obstruirían el horno: el calor del horno descompone los carbonatos en óxido de calcio , que reacciona con cualquier exceso de sílice para formar una escoria compuesta de silicato de calcio CaSiO 3 u otros productos. A la temperatura del horno, el metal y la escoria están fundidos. Se acumulan en el fondo como dos capas líquidas inmiscibles (con la escoria en la parte superior), que luego se separan fácilmente. [119] La escoria se puede utilizar como material en la construcción de carreteras o para mejorar los suelos pobres en minerales para la agricultura . [108]
Por lo tanto, la fabricación de acero sigue siendo uno de los mayores contribuyentes industriales a las emisiones de CO 2 en el mundo. [120]
El arrabio producido mediante el proceso de alto horno contiene hasta un 4-5% de carbono (en masa), con pequeñas cantidades de otras impurezas como azufre, magnesio, fósforo y manganeso. Este alto nivel de carbono lo hace relativamente débil y quebradizo. Al reducir la cantidad de carbono a un 0,002-2,1% se produce acero , que puede ser hasta 1000 veces más duro que el hierro puro. Se puede fabricar una gran variedad de artículos de acero mediante trabajo en frío , laminado en caliente , forjado , mecanizado , etc. Al eliminar las impurezas del arrabio, pero dejando un 2-4% de carbono, se obtiene el hierro fundido , que se moldea en fundiciones para fabricar artículos como estufas, tuberías, radiadores, farolas y rieles. [119]
Los productos de acero suelen someterse a diversos tratamientos térmicos después de ser forjados para darles forma. El recocido consiste en calentarlos a 700–800 °C durante varias horas y luego enfriarlos gradualmente. Esto hace que el acero sea más blando y más trabajable. [122]
Debido a las preocupaciones ambientales, se han desarrollado métodos alternativos para procesar el hierro. La " reducción directa del hierro " reduce el mineral de hierro a un trozo ferroso llamado hierro "esponjoso" o hierro "directo" que es adecuado para la fabricación de acero. [108] Dos reacciones principales comprenden el proceso de reducción directa:
El gas natural se oxida parcialmente (con calor y un catalizador): [108]
Luego, el mineral de hierro se trata con estos gases en un horno, produciendo hierro esponjado sólido: [108]
La sílice se elimina añadiendo un fundente de piedra caliza como se describió anteriormente. [108]
La ignición de una mezcla de polvo de aluminio y óxido de hierro produce hierro metálico a través de la reacción de termita :
Alternativamente, el arrabio se puede transformar en acero (con hasta un 2% de carbono) o hierro forjado (hierro comercialmente puro). Se han utilizado varios procesos para esto, incluidas las forjas de refinación , los hornos de pudling , los convertidores Bessemer , los hornos de solera abierta , los hornos de oxígeno básico y los hornos de arco eléctrico . En todos los casos, el objetivo es oxidar parte o la totalidad del carbono, junto con otras impurezas. Por otro lado, se pueden agregar otros metales para hacer aceros aleados. [110]
La electrólisis de óxido fundido (MOE) utiliza la electrólisis del óxido de hierro fundido para producir hierro metálico. Se estudia en experimentos a escala de laboratorio y se propone como un método para la producción industrial de hierro que no tiene emisiones directas de dióxido de carbono. Utiliza un cátodo de hierro líquido, un ánodo formado a partir de una aleación de cromo, aluminio y hierro, [123] y el electrolito es una mezcla de óxidos metálicos fundidos en los que se disuelve el mineral de hierro. La corriente mantiene el electrolito fundido y reduce el óxido de hierro. Se produce gas oxígeno además del hierro líquido. Las únicas emisiones de dióxido de carbono provienen de la electricidad generada por combustibles fósiles que se utiliza para calentar y reducir el metal. [124] [125] [126]
El hierro es el metal más utilizado de todos, y representa más del 90% de la producción mundial de metales. Su bajo coste y su alta resistencia hacen que a menudo sea el material de elección para soportar tensiones o transmitir fuerzas, como en la construcción de maquinaria y máquinas herramienta , rieles , automóviles , cascos de barcos , barras de refuerzo de hormigón y la estructura portante de los edificios. Dado que el hierro puro es bastante blando, lo más habitual es combinarlo con elementos de aleación para fabricar acero. [129]
Las propiedades mecánicas del hierro y sus aleaciones son extremadamente importantes para sus aplicaciones estructurales. Dichas propiedades pueden evaluarse de diversas maneras, entre ellas, la prueba Brinell , la prueba Rockwell y la prueba de dureza Vickers .
Las propiedades del hierro puro se utilizan a menudo para calibrar mediciones o comparar pruebas. [128] [130] Sin embargo, las propiedades mecánicas del hierro se ven afectadas significativamente por la pureza de la muestra: los cristales individuales de hierro puro son en realidad más blandos que el aluminio, [127] y el hierro más puro producido industrialmente (99,99%) tiene una dureza de 20-30 Brinell. [131] El hierro puro (99,9% ~ 99,999%), especialmente llamado hierro electrolítico , se produce industrialmente mediante refinación electrolítica .
Un aumento en el contenido de carbono provocará un aumento significativo en la dureza y la resistencia a la tracción del hierro. La dureza máxima de 65 R c se logra con un contenido de carbono del 0,6 %, aunque la aleación tiene una baja resistencia a la tracción. [132] Debido a la suavidad del hierro, es mucho más fácil trabajarlo que sus congéneres más pesados, el rutenio y el osmio . [16]

El hierro α es un metal bastante blando que puede disolver solo una pequeña concentración de carbono (no más del 0,021 % en masa a 910 °C). [133] La austenita (hierro γ) es igualmente blanda y metálica, pero puede disolver considerablemente más carbono (hasta un 2,04 % en masa a 1146 °C). Esta forma de hierro se utiliza en el tipo de acero inoxidable que se utiliza para fabricar cubiertos y equipos hospitalarios y de servicio de alimentos. [20]
El hierro disponible comercialmente se clasifica en función de su pureza y la abundancia de aditivos. El arrabio tiene entre un 3,5 y un 4,5 % de carbono [134] y contiene cantidades variables de contaminantes como azufre , silicio y fósforo . El arrabio no es un producto comercializable, sino más bien un paso intermedio en la producción de hierro fundido y acero. La reducción de contaminantes en el arrabio que afectan negativamente a las propiedades del material, como el azufre y el fósforo, produce hierro fundido que contiene entre un 2 y un 4 % de carbono, un 1 y un 6 % de silicio y pequeñas cantidades de manganeso [119] . El arrabio tiene un punto de fusión en el rango de 1420 a 1470 K, que es más bajo que cualquiera de sus dos componentes principales, y lo convierte en el primer producto que se funde cuando el carbono y el hierro se calientan juntos [10] . Sus propiedades mecánicas varían mucho y dependen de la forma que adopte el carbono en la aleación [16] .
Los hierros fundidos "blancos" contienen su carbono en forma de cementita o carburo de hierro (Fe 3 C). [16] Este compuesto duro y quebradizo domina las propiedades mecánicas de los hierros fundidos blancos, volviéndolos duros, pero poco resistentes a los golpes. La superficie rota de un hierro fundido blanco está llena de facetas finas de carburo de hierro roto, un material muy pálido, plateado y brillante, de ahí la denominación. Enfriar una mezcla de hierro con 0,8% de carbono lentamente por debajo de 723 °C a temperatura ambiente da como resultado capas separadas y alternas de cementita y hierro α, que es blando y maleable y se llama perlita por su apariencia. El enfriamiento rápido, por otro lado, no permite tiempo para esta separación y crea martensita dura y quebradiza . Luego, el acero se puede templar recalentándolo a una temperatura intermedia, cambiando las proporciones de perlita y martensita. El producto final con un contenido de carbono inferior al 0,8 % es una mezcla de perlita-αFe, y el producto final con un contenido de carbono superior al 0,8 % es una mezcla de perlita-cementita. [16]
En el hierro gris, el carbono existe como escamas finas y separadas de grafito , y también hace que el material sea quebradizo debido a las escamas de grafito con bordes afilados que producen sitios de concentración de tensión dentro del material. [135] Una variante más nueva del hierro gris, conocida como hierro dúctil , se trata especialmente con trazas de magnesio para alterar la forma del grafito a esferoides o nódulos, lo que reduce las concentraciones de tensión y aumenta enormemente la tenacidad y la resistencia del material. [135]
El hierro forjado contiene menos de 0,25% de carbono pero grandes cantidades de escoria que le dan una característica fibrosa. [134] El hierro forjado es más resistente a la corrosión que el acero. Ha sido reemplazado casi por completo por el acero dulce , que se corroe más fácilmente que el hierro forjado, pero es más barato y más disponible. El acero al carbono contiene 2,0% de carbono o menos, [136] con pequeñas cantidades de manganeso , azufre , fósforo y silicio. Los aceros aleados contienen cantidades variables de carbono, así como otros metales, como cromo , vanadio , molibdeno , níquel, tungsteno , etc. Su contenido de aleación aumenta su costo, por lo que generalmente solo se emplean para usos especializados. Sin embargo, un acero de aleación común es el acero inoxidable . Los recientes avances en la metalurgia ferrosa han producido una gama cada vez mayor de aceros microaleados, también denominados " HSLA " o aceros de baja aleación y alta resistencia, que contienen pequeñas adiciones para producir altas resistencias y, a menudo, una tenacidad espectacular a un coste mínimo. [136] [137] [138]
Las aleaciones con composiciones elementales de alta pureza (como las aleaciones de hierro electrolítico ) tienen propiedades específicamente mejoradas, como ductilidad , resistencia a la tracción , tenacidad , resistencia a la fatiga , resistencia al calor y resistencia a la corrosión.
Además de las aplicaciones tradicionales, el hierro también se utiliza para la protección contra la radiación ionizante. Aunque es más ligero que otro material de protección tradicional, el plomo , es mucho más resistente mecánicamente. [139]
La principal desventaja del hierro y del acero es que el hierro puro, y la mayoría de sus aleaciones, sufren mucho de oxidación si no se protegen de alguna manera, un costo que asciende a más del 1% de la economía mundial. [140] La pintura , la galvanización , la pasivación , el recubrimiento plástico y el pavonado se utilizan para proteger el hierro de la oxidación excluyendo el agua y el oxígeno o mediante protección catódica . El mecanismo de oxidación del hierro es el siguiente: [140]
El electrolito suele ser sulfato de hierro (II) en las zonas urbanas (que se forma cuando el dióxido de azufre atmosférico ataca al hierro) y partículas de sal en la atmósfera de las zonas costeras. [140]
Debido a que el Fe es económico y no tóxico, se ha dedicado mucho esfuerzo al desarrollo de catalizadores y reactivos basados en Fe . Sin embargo, el hierro es menos común como catalizador en procesos comerciales que los metales más caros. [141] En biología, las enzimas que contienen Fe son omnipresentes. [142]
Los catalizadores de hierro se utilizan tradicionalmente en el proceso Haber-Bosch para la producción de amoníaco y en el proceso Fischer-Tropsch para la conversión de monóxido de carbono en hidrocarburos para combustibles y lubricantes. [143] El hierro en polvo en un medio ácido se utiliza en la reducción de Bechamp , la conversión de nitrobenceno en anilina . [144]
El óxido de hierro (III) mezclado con polvo de aluminio se puede encender para crear una reacción de termita , que se utiliza para soldar piezas de hierro de gran tamaño (como rieles ) y purificar minerales. El óxido de hierro (III) y el oxihidróxido se utilizan como pigmentos rojizos y ocres .
El cloruro de hierro (III) se utiliza en la purificación del agua y el tratamiento de aguas residuales , en el teñido de telas, como agente colorante en pinturas, como aditivo en alimentos para animales y como agente de grabado para el cobre en la fabricación de placas de circuitos impresos . [145] También se puede disolver en alcohol para formar tintura de hierro, que se utiliza como medicamento para detener el sangrado en los canarios . [146]
El sulfato de hierro (II) se utiliza como precursor de otros compuestos de hierro. También se utiliza para reducir el cromato en el cemento. Se utiliza para fortificar los alimentos y tratar la anemia por deficiencia de hierro . El sulfato de hierro (III) se utiliza para sedimentar partículas diminutas de aguas residuales en el agua de los tanques. El cloruro de hierro (II) se utiliza como agente floculante reductor, en la formación de complejos de hierro y óxidos de hierro magnéticos, y como agente reductor en la síntesis orgánica. [145]
El nitroprusiato de sodio es un fármaco que se utiliza como vasodilatador . Está incluido en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [147]
Iron is required for life.[9][148][149] The iron–sulfur clusters are pervasive and include nitrogenase, the enzymes responsible for biological nitrogen fixation. Iron-containing proteins participate in transport, storage and use of oxygen.[9] Iron proteins are involved in electron transfer.[150]

Examples of iron-containing proteins in higher organisms include hemoglobin, cytochrome (see high-valent iron), and catalase.[9][151] The average adult human contains about 0.005% body weight of iron, or about four grams, of which three quarters is in hemoglobin—a level that remains constant despite only about one milligram of iron being absorbed each day,[150] because the human body recycles its hemoglobin for the iron content.[152]
Microbial growth may be assisted by oxidation of iron(II) or by reduction of iron(III).[153]
Iron acquisition poses a problem for aerobic organisms because ferric iron is poorly soluble near neutral pH. Thus, these organisms have developed means to absorb iron as complexes, sometimes taking up ferrous iron before oxidising it back to ferric iron.[9] In particular, bacteria have evolved very high-affinity sequestering agents called siderophores.[154][155][156]
After uptake in human cells, iron storage is precisely regulated.[9][157] A major component of this regulation is the protein transferrin, which binds iron ions absorbed from the duodenum and carries it in the blood to cells.[9][158] Transferrin contains Fe3+ in the middle of a distorted octahedron, bonded to one nitrogen, three oxygens and a chelating carbonate anion that traps the Fe3+ ion: it has such a high stability constant that it is very effective at taking up Fe3+ ions even from the most stable complexes. At the bone marrow, transferrin is reduced from Fe3+ to Fe2+ and stored as ferritin to be incorporated into hemoglobin.[150]
The most commonly known and studied bioinorganic iron compounds (biological iron molecules) are the heme proteins: examples are hemoglobin, myoglobin, and cytochrome P450.[9] These compounds participate in transporting gases, building enzymes, and transferring electrons.[150] Metalloproteins are a group of proteins with metal ion cofactors. Some examples of iron metalloproteins are ferritin and rubredoxin.[150] Many enzymes vital to life contain iron, such as catalase,[159] lipoxygenases,[160] and IRE-BP.[161]
Hemoglobin is an oxygen carrier that occurs in red blood cells and contributes their color, transporting oxygen in the arteries from the lungs to the muscles where it is transferred to myoglobin, which stores it until it is needed for the metabolic oxidation of glucose, generating energy.[9] Here the hemoglobin binds to carbon dioxide, produced when glucose is oxidized, which is transported through the veins by hemoglobin (predominantly as bicarbonate anions) back to the lungs where it is exhaled.[150] In hemoglobin, the iron is in one of four heme groups and has six possible coordination sites; four are occupied by nitrogen atoms in a porphyrin ring, the fifth by an imidazole nitrogen in a histidine residue of one of the protein chains attached to the heme group, and the sixth is reserved for the oxygen molecule it can reversibly bind to.[150] When hemoglobin is not attached to oxygen (and is then called deoxyhemoglobin), the Fe2+ ion at the center of the heme group (in the hydrophobic protein interior) is in a high-spin configuration. It is thus too large to fit inside the porphyrin ring, which bends instead into a dome with the Fe2+ ion about 55 picometers above it. In this configuration, the sixth coordination site reserved for the oxygen is blocked by another histidine residue.[150]
When deoxyhemoglobin picks up an oxygen molecule, this histidine residue moves away and returns once the oxygen is securely attached to form a hydrogen bond with it. This results in the Fe2+ ion switching to a low-spin configuration, resulting in a 20% decrease in ionic radius so that now it can fit into the porphyrin ring, which becomes planar.[150] Additionally, this hydrogen bonding results in the tilting of the oxygen molecule, resulting in a Fe–O–O bond angle of around 120° that avoids the formation of Fe–O–Fe or Fe–O2–Fe bridges that would lead to electron transfer, the oxidation of Fe2+ to Fe3+, and the destruction of hemoglobin. This results in a movement of all the protein chains that leads to the other subunits of hemoglobin changing shape to a form with larger oxygen affinity. Thus, when deoxyhemoglobin takes up oxygen, its affinity for more oxygen increases, and vice versa.[150] Myoglobin, on the other hand, contains only one heme group and hence this cooperative effect cannot occur. Thus, while hemoglobin is almost saturated with oxygen in the high partial pressures of oxygen found in the lungs, its affinity for oxygen is much lower than that of myoglobin, which oxygenates even at low partial pressures of oxygen found in muscle tissue.[150] As described by the Bohr effect (named after Christian Bohr, the father of Niels Bohr), the oxygen affinity of hemoglobin diminishes in the presence of carbon dioxide.[150]

Carbon monoxide and phosphorus trifluoride are poisonous to humans because they bind to hemoglobin similarly to oxygen, but with much more strength, so that oxygen can no longer be transported throughout the body. Hemoglobin bound to carbon monoxide is known as carboxyhemoglobin. This effect also plays a minor role in the toxicity of cyanide, but there the major effect is by far its interference with the proper functioning of the electron transport protein cytochrome a.[150] The cytochrome proteins also involve heme groups and are involved in the metabolic oxidation of glucose by oxygen. The sixth coordination site is then occupied by either another imidazole nitrogen or a methionine sulfur, so that these proteins are largely inert to oxygen—with the exception of cytochrome a, which bonds directly to oxygen and thus is very easily poisoned by cyanide.[150] Here, the electron transfer takes place as the iron remains in low spin but changes between the +2 and +3 oxidation states. Since the reduction potential of each step is slightly greater than the previous one, the energy is released step-by-step and can thus be stored in adenosine triphosphate. Cytochrome a is slightly distinct, as it occurs at the mitochondrial membrane, binds directly to oxygen, and transports protons as well as electrons, as follows:[150]
Although the heme proteins are the most important class of iron-containing proteins, the iron–sulfur proteins are also very important, being involved in electron transfer, which is possible since iron can exist stably in either the +2 or +3 oxidation states. These have one, two, four, or eight iron atoms that are each approximately tetrahedrally coordinated to four sulfur atoms; because of this tetrahedral coordination, they always have high-spin iron. The simplest of such compounds is rubredoxin, which has only one iron atom coordinated to four sulfur atoms from cysteine residues in the surrounding peptide chains. Another important class of iron–sulfur proteins is the ferredoxins, which have multiple iron atoms. Transferrin does not belong to either of these classes.[150]
The ability of sea mussels to maintain their grip on rocks in the ocean is facilitated by their use of organometallic iron-based bonds in their protein-rich cuticles. Based on synthetic replicas, the presence of iron in these structures increased elastic modulus 770 times, tensile strength 58 times, and toughness 92 times. The amount of stress required to permanently damage them increased 76 times.[163]
Iron is pervasive, but particularly rich sources of dietary iron include red meat, oysters, beans, poultry, fish, leaf vegetables, watercress, tofu, and blackstrap molasses.[9] Bread and breakfast cereals are sometimes specifically fortified with iron.[9][164]
Iron provided by dietary supplements is often found as iron(II) fumarate, although iron(II) sulfate is cheaper and is absorbed equally well.[145] Elemental iron, or reduced iron, despite being absorbed at only one-third to two-thirds the efficiency (relative to iron sulfate),[165] is often added to foods such as breakfast cereals or enriched wheat flour. Iron is most available to the body when chelated to amino acids[166] and is also available for use as a common iron supplement. Glycine, the least expensive amino acid, is most often used to produce iron glycinate supplements.[167]
The U.S. Institute of Medicine (IOM) updated Estimated Average Requirements (EARs) and Recommended Dietary Allowances (RDAs) for iron in 2001.[9] The current EAR for iron for women ages 14–18 is 7.9 mg/day, 8.1 mg/day for ages 19–50 and 5.0 mg/day thereafter (postmenopause). For men, the EAR is 6.0 mg/day for ages 19 and up. The RDA is 15.0 mg/day for women ages 15–18, 18.0 mg/day for ages 19–50 and 8.0 mg/day thereafter. For men, 8.0 mg/day for ages 19 and up. RDAs are higher than EARs so as to identify amounts that will cover people with higher-than-average requirements. RDA for pregnancy is 27 mg/day and, for lactation, 9 mg/day.[9] For children ages 1–3 years 7 mg/day, 10 mg/day for ages 4–8 and 8 mg/day for ages 9–13. As for safety, the IOM also sets Tolerable upper intake levels (ULs) for vitamins and minerals when evidence is sufficient. In the case of iron, the UL is set at 45 mg/day. Collectively the EARs, RDAs and ULs are referred to as Dietary Reference Intakes.[168]
The European Food Safety Authority (EFSA) refers to the collective set of information as Dietary Reference Values, with Population Reference Intake (PRI) instead of RDA, and Average Requirement instead of EAR. AI and UL are defined the same as in the United States. For women the PRI is 13 mg/day ages 15–17 years, 16 mg/day for women ages 18 and up who are premenopausal and 11 mg/day postmenopausal. For pregnancy and lactation, 16 mg/day. For men the PRI is 11 mg/day ages 15 and older. For children ages 1 to 14, the PRI increases from 7 to 11 mg/day. The PRIs are higher than the U.S. RDAs, with the exception of pregnancy.[169] The EFSA reviewed the same safety question did not establish a UL.[170]
Infants may require iron supplements if they are bottle-fed cow's milk.[171] Frequent blood donors are at risk of low iron levels and are often advised to supplement their iron intake.[172]
For U.S. food and dietary supplement labeling purposes, the amount in a serving is expressed as a percent of Daily Value (%DV). For iron labeling purposes, 100% of the Daily Value was 18 mg, and as of May 27, 2016[update] remained unchanged at 18 mg.[173][174] A table of the old and new adult daily values is provided at Reference Daily Intake.
Iron deficiency is the most common nutritional deficiency in the world.[9][175][176][177] When loss of iron is not adequately compensated by adequate dietary iron intake, a state of latent iron deficiency occurs, which over time leads to iron-deficiency anemia if left untreated, which is characterised by an insufficient number of red blood cells and an insufficient amount of hemoglobin.[178] Children, pre-menopausal women (women of child-bearing age), and people with poor diet are most susceptible to the disease. Most cases of iron-deficiency anemia are mild, but if not treated can cause problems like fast or irregular heartbeat, complications during pregnancy, and delayed growth in infants and children.[179]
The brain is resistant to acute iron deficiency due to the slow transport of iron through the blood brain barrier.[180] Acute fluctuations in iron status (marked by serum ferritin levels) do not reflect brain iron status, but prolonged nutritional iron deficiency is suspected to reduce brain iron concentrations over time.[181][182] In the brain, iron plays a role in oxygen transport, myelin synthesis, mitochondrial respiration, and as a cofactor for neurotransmitter synthesis and metabolism.[183] Animal models of nutritional iron deficiency report biomolecular changes resembling those seen in Parkinson's and Huntington's disease.[184][185] However, age-related accumulation of iron in the brain has also been linked to the development of Parkinson's.[186]
Iron uptake is tightly regulated by the human body, which has no regulated physiological means of excreting iron. Only small amounts of iron are lost daily due to mucosal and skin epithelial cell sloughing, so control of iron levels is primarily accomplished by regulating uptake.[187] Regulation of iron uptake is impaired in some people as a result of a genetic defect that maps to the HLA-H gene region on chromosome 6 and leads to abnormally low levels of hepcidin, a key regulator of the entry of iron into the circulatory system in mammals.[188] In these people, excessive iron intake can result in iron overload disorders, known medically as hemochromatosis.[9] Many people have an undiagnosed genetic susceptibility to iron overload, and are not aware of a family history of the problem. For this reason, people should not take iron supplements unless they suffer from iron deficiency and have consulted a doctor. Hemochromatosis is estimated to be the cause of 0.3–0.8% of all metabolic diseases of Caucasians.[189]
Overdoses of ingested iron can cause excessive levels of free iron in the blood. High blood levels of free ferrous iron react with peroxides to produce highly reactive free radicals that can damage DNA, proteins, lipids, and other cellular components. Iron toxicity occurs when the cell contains free iron, which generally occurs when iron levels exceed the availability of transferrin to bind the iron. Damage to the cells of the gastrointestinal tract can also prevent them from regulating iron absorption, leading to further increases in blood levels. Iron typically damages cells in the heart, liver and elsewhere, causing adverse effects that include coma, metabolic acidosis, shock, liver failure, coagulopathy, long-term organ damage, and even death.[190] Humans experience iron toxicity when the iron exceeds 20 milligrams for every kilogram of body mass; 60 milligrams per kilogram is considered a lethal dose.[191] Overconsumption of iron, often the result of children eating large quantities of ferrous sulfate tablets intended for adult consumption, is one of the most common toxicological causes of death in children under six.[191] The Dietary Reference Intake (DRI) sets the Tolerable Upper Intake Level (UL) for adults at 45 mg/day. For children under fourteen years old the UL is 40 mg/day.[192]
The medical management of iron toxicity is complicated, and can include use of a specific chelating agent called deferoxamine to bind and expel excess iron from the body.[190][193][194]
Some research has suggested that low thalamic iron levels may play a role in the pathophysiology of ADHD.[195] Some researchers have found that iron supplementation can be effective especially in the inattentive subtype of the disorder.[196]
Some researchers in the 2000s suggested a link between low levels of iron in the blood and ADHD. A 2012 study found no such correlation.[197]
The role of iron in cancer defense can be described as a "double-edged sword" because of its pervasive presence in non-pathological processes.[198] People having chemotherapy may develop iron deficiency and anemia, for which intravenous iron therapy is used to restore iron levels.[199] Iron overload, which may occur from high consumption of red meat,[9] may initiate tumor growth and increase susceptibility to cancer onset,[199] particularly for colorectal cancer.[9]
Iron plays an essential role in marine systems and can act as a limiting nutrient for planktonic activity.[200] Because of this, too much of a decrease in iron may lead to a decrease in growth rates in phytoplanktonic organisms such as diatoms.[201] Iron can also be oxidized by marine microbes under conditions that are high in iron and low in oxygen.[202]
Iron can enter marine systems through adjoining rivers and directly from the atmosphere. Once iron enters the ocean, it can be distributed throughout the water column through ocean mixing and through recycling on the cellular level.[203] In the arctic, sea ice plays a major role in the store and distribution of iron in the ocean, depleting oceanic iron as it freezes in the winter and releasing it back into the water when thawing occurs in the summer.[204] The iron cycle can fluctuate the forms of iron from aqueous to particle forms altering the availability of iron to primary producers.[205] Increased light and warmth increases the amount of iron that is in forms that are usable by primary producers.[206]
the blade's composition of iron, nickel and cobalt was an approximate match for a meteorite that landed in northern Egypt. The result "strongly suggests an extraterrestrial origin"
earliest blast furnace discovered in China from about the first century AD