Los complejos de dioxígeno son compuestos de coordinación que contienen O 2 como ligando . [1] [2] El estudio de estos compuestos está inspirado en las proteínas transportadoras de oxígeno como la mioglobina , la hemoglobina , la hemeritrina y la hemocianina . [3] Varios metales de transición forman complejos con O 2 y muchos de estos complejos se forman de forma reversible. [4] La unión de O 2 es el primer paso en muchos fenómenos importantes, como la respiración celular , la corrosión y la química industrial. El primer complejo de oxígeno sintético se demostró en 1938 con el complejo de cobalto (II) unido de forma reversible a O 2. [5 ]
El O 2 se une a un único centro metálico ya sea "por el extremo" ( η 1 - ) o "por el lado" ( η 2 - ). La unión y las estructuras de estos compuestos se evalúan habitualmente mediante cristalografía de rayos X de monocristal , centrándose tanto en la geometría general como en las distancias O–O, que revelan el orden de enlace del ligando O 2 .

Los aductos de O 2 derivados de complejos de cobalto (II) y hierro (II) de porfirina (y ligandos macrocíclicos aniónicos relacionados) exhiben este modo de enlace. La mioglobina y la hemoglobina son ejemplos famosos, y se han descrito muchos análogos sintéticos que se comportan de manera similar. La unión de O 2 se describe generalmente como un proceso por transferencia de electrones desde el centro de metal (II) para dar superóxido ( O−
2) complejos de centros de metal (III). Como lo muestran los mecanismos del citocromo P450 y la hidroxilasa dependiente de alfa-cetoglutarato , la unión Fe- η 1 -O 2 favorece la formación de centros oxo Fe (IV). El O 2 puede unirse a un metal de una unidad bimetálica a través de los mismos modos discutidos anteriormente para los complejos mononucleares. Un ejemplo bien conocido es el sitio activo de la proteína hemeritrina , que presenta un carboxilato de dihierro que se une al O 2 en un centro Fe. Los complejos dinucleares también pueden cooperar en la unión, aunque el ataque inicial del O 2 probablemente ocurre en un solo metal.
El enlace η 2 es el motivo más común que se observa en la química de coordinación del dioxígeno. Estos complejos se pueden generar tratando complejos metálicos de baja valencia con oxígeno. Por ejemplo, el complejo de Vaska se une reversiblemente al O 2 (Ph = C 6 H 5 ):
La conversión se describe como un proceso redox 2 e − : Ir(I) se convierte en Ir(III) a medida que el dioxígeno se convierte en peróxido . Dado que el O 2 tiene un estado fundamental triplete y el complejo de Vaska es un singlete, la reacción es más lenta que cuando se utiliza oxígeno singlete . [7] Las propiedades magnéticas de algunos complejos η 2 -O 2 muestran que el ligando, de hecho, es superóxido, no peróxido. [8]
La mayoría de los complejos de η 2 -O 2 se generan utilizando peróxido de hidrógeno , no a partir de O 2 . El cromato ([CrO 4 )] 2− ) se puede convertir, por ejemplo, en tetraperóxido [Cr(O 2 ) 4 ] 2− . La reacción del peróxido de hidrógeno con titanio(IV) acuoso da lugar a un complejo de peróxido de color brillante que es una prueba útil tanto para el titanio como para el peróxido de hidrógeno. [9]

Estos modos de unión incluyen μ 2 - η 2 , η 2 -, μ 2 - η 1 , η 1 - y μ 2 - η 1 , η 2 -. Dependiendo del grado de transferencia de electrones desde la unidad dimetálica, estos ligandos O 2 pueden describirse nuevamente como peroxo o superoxo. La hemocianina es un transportador de O 2 que utiliza un motivo de unión de O2 puente. Presenta un par de centros de cobre . [10]

.
La salcomina , el complejo de cobalto (II) del ligando salen, es el primer portador sintético de O 2 . [12] Los derivados solvatados del complejo sólido se unen a 0,5 equivalentes de O 2 :
Se observan reacciones de transferencia de electrones reversibles en algunos complejos dinucleares de O 2 . [13]
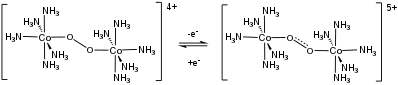
Los complejos de dioxígeno son los precursores de otras familias de ligandos oxigenados. Los compuestos oxo metálicos surgen de la ruptura del enlace O–O después de la formación de complejos. Los complejos hidroperoxo se generan en el curso de la reducción de dioxígeno por metales. La reducción de O 2 por catalizadores metálicos es una semirreacción clave en las pilas de combustible .
Las oxidaciones catalizadas por metales con O2 se producen a través de la intermediación de complejos de dioxígeno, aunque los oxidantes reales suelen ser derivados oxo. La unión reversible de O2 a complejos metálicos se ha utilizado como medio para purificar el oxígeno del aire, pero la destilación criogénica del aire líquido sigue siendo la tecnología dominante.