

En química orgánica , un carboxilato es la base conjugada de un ácido carboxílico , RCOO − (o RCO−2) Es un anión , un ion con carga negativa .
Las sales de carboxilato son sales que tienen la fórmula general M(RCOO) n , donde M es un metal y n es 1, 2,.... Los ésteres de carboxilato tienen la fórmula general RCOOR′ (también escrita como RCO 2 R′ ), donde R y R′ son grupos orgánicos.
Los iones carboxilato se pueden formar por desprotonación de ácidos carboxílicos. Estos ácidos suelen tener un p K a inferior a 5, lo que significa que pueden ser desprotonados por muchas bases, como el hidróxido de sodio o el bicarbonato de sodio . [1] : 271–2
Los ácidos carboxílicos se disocian fácilmente en un anión carboxilato y un ion hidrógeno cargado positivamente (protón), mucho más fácilmente que los alcoholes (en un ion alcóxido y un protón), porque el ion carboxilato se estabiliza por resonancia . La carga negativa que queda después de la desprotonación del grupo carboxilo se deslocaliza entre los dos átomos de oxígeno electronegativos en una estructura de resonancia. Si el grupo R es un grupo que atrae electrones (como –CF 3 ), la basicidad del carboxilato se debilitará aún más. [1] : 264–5
Esta deslocalización del electrón significa que ambos átomos de oxígeno tienen una carga negativa menos fuerte: el protón positivo es atraído menos fuertemente hacia el grupo carboxilato una vez que lo ha dejado; por lo tanto, el ion carboxilato es más estable y menos básico como resultado de la estabilización por resonancia de la carga negativa. Por el contrario, un ion alcóxido , una vez formado, tendría una fuerte carga negativa localizada en su único átomo de oxígeno, que atraería fuertemente a cualquier protón cercano (de hecho, los alcóxidos son bases muy fuertes). Debido a la estabilización por resonancia, los ácidos carboxílicos tienen valores p K a mucho más bajos (y por lo tanto son ácidos más fuertes) que los alcoholes . Por ejemplo, el valor p K a del ácido acético es 4,8, mientras que el etanol tiene un p K a de 16. Por lo tanto, el ácido acético es un ácido mucho más fuerte que el etanol. Esto a su vez significa que para soluciones equimolares de un ácido carboxílico o un alcohol en agua, el ácido carboxílico tendría un pH mucho más bajo . [1] : 263–7
Las sales de ácidos carboxílicos con un átomo de hidrógeno en la posición alfa junto al grupo carboxilato se pueden convertir en dianiones con bases fuertes como la diisopropilamida de litio . Estas reaccionan con haluros de alquilo para dar derivados: [1] : 474
Los iones carboxilato son buenos nucleófilos . Reaccionan con haluros de alquilo para formar ésteres . La siguiente reacción muestra el mecanismo de reacción. [1] : 398–9
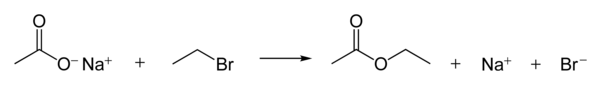
La nucleofilia de los iones carboxilato es mucho más débil que la de los iones hidróxido y alcóxido , pero más fuerte que la de los aniones haluro (en un disolvente aprótico polar , aunque existen otros efectos como la solubilidad del ion).
A diferencia de la reducción del éster, la reducción del carboxilato es diferente, debido a la falta del grupo saliente y al átomo de carbono relativamente rico en electrones (debido a la carga negativa de los átomos de oxígeno). Con una pequeña cantidad de ácido, la reacción ocurre con hidruro de litio y aluminio cambiando el LAH en el ácido de Lewis AlH 3 en el proceso, convirtiendo el oxianión en 4 enlaces Al–O. [1] : 1212
Esta lista es para los casos en los que existe un artículo independiente para el anión o sus derivados. Todos los demás ácidos orgánicos deben encontrarse en su ácido carboxílico original.