El butanol (también llamado alcohol butílico ) es un alcohol de cuatro carbonos con una fórmula de C4H9OH , que se presenta en cinco estructuras isoméricas (cuatro isómeros estructurales), desde un alcohol primario de cadena lineal hasta un alcohol terciario de cadena ramificada; [ 1] todos son un grupo butilo o isobutilo unido a un grupo hidroxilo (a veces representado como BuOH , sec -BuOH , i-BuOH y t -BuOH ). Estos son 1-butanol , dos estereoisómeros de alcohol sec -butílico , isobutanol y alcohol terc -butílico . El butanol se utiliza principalmente como disolvente y como intermediario en la síntesis química , y puede utilizarse como combustible . El butanol producido biológicamente se denomina biobutanol , que puede ser n -butanol o isobutanol.
El término butanol sin modificar se refiere generalmente al isómero de cadena lineal con el grupo funcional alcohol en el carbono terminal, que también se conoce como 1-butanol . El isómero de cadena lineal con el alcohol en un carbono interno es alcohol sec -butílico o 2-butanol . El isómero ramificado con el alcohol en un carbono terminal es isobutanol o 2-metil-1-propanol, y el isómero ramificado con el alcohol en el carbono interno es alcohol terc -butílico o 2-metil-2-propanol.
Los isómeros del butanol tienen diferentes puntos de fusión y ebullición. El 1-butanol y el isobutanol tienen una solubilidad limitada, el alcohol sec -butílico tiene una solubilidad sustancialmente mayor, mientras que el alcohol terc -butílico es miscible con agua. El grupo hidroxilo hace que la molécula sea polar, lo que promueve la solubilidad en agua, mientras que la cadena de hidrocarburos más larga mitiga la polaridad y reduce la solubilidad.
El butanol exhibe un bajo orden de toxicidad en experimentos de dosis única con animales de laboratorio [2] [3] y se considera lo suficientemente seguro para su uso en cosméticos. La sobreexposición breve y repetida con la piel puede resultar en depresión del sistema nervioso central , como con otros alcoholes de cadena corta . La exposición también puede causar irritación ocular grave e irritación cutánea moderada. Los principales peligros son la exposición prolongada a los vapores del alcohol. En casos extremos, esto incluye la supresión del sistema nervioso central e incluso la muerte. En la mayoría de las circunstancias, el butanol se metaboliza rápidamente a dióxido de carbono . No se ha demostrado que dañe el ADN o cause cáncer .
El butanol se utiliza como disolvente en una amplia variedad de procesos químicos y textiles, en síntesis orgánica y como intermediario químico. También se utiliza como diluyente de pintura y disolvente en otras aplicaciones de revestimiento en las que es preferible un disolvente latente de evaporación relativamente lenta, como en el caso de las lacas y los esmaltes de curado a temperatura ambiente. También se utiliza como componente de líquidos hidráulicos y de frenos . [4]
Desde el siglo XX se utiliza una solución de butanol al 50% en agua para retardar el secado del yeso fresco en las pinturas al fresco . La solución se suele rociar sobre el yeso húmedo después de haberlo alisado con llana y amplía el período de trabajo durante el cual se pueden pintar frescos hasta 18 horas. [5]
El butanol se utiliza en la síntesis de 2-butoxietanol . Una de las principales aplicaciones del butanol es como reactivo con ácido acrílico para producir acrilato de butilo , un ingrediente principal de la pintura acrílica a base de agua. [6]
También se utiliza como base para perfumes , pero por sí solo tiene un aroma altamente alcohólico.
Las sales de butanol son intermediarios químicos; por ejemplo, las sales de metales alcalinos de terc -butanol son terc -butóxidos .
El 2-metil-2-butanol es un depresor del sistema nervioso central que, tras su ingestión, tiene un efecto similar al del etanol. Se han documentado casos que demuestran su potencial de abuso. [7]
El butanol ( n -butanol o isobutanol) es un biocombustible potencial ( combustible de butanol ). [8] El butanol al 85 por ciento de concentración se puede utilizar en automóviles diseñados para gasolina (gasolina) sin ningún cambio en el motor (a diferencia del etanol al 85 por ciento), y contiene más energía para un volumen dado que el etanol y casi tanta como la gasolina, y un vehículo que use butanol devolvería un consumo de combustible más comparable al de la gasolina que al del etanol. El butanol también se puede agregar al combustible diésel para reducir las emisiones de hollín. [9] Los microorganismos fotoautotróficos, como las cianobacterias, se pueden diseñar para producir 1-butanol indirectamente a partir de CO2 y agua. [10]
Los butanoles normalmente están presentes en el alcohol fusel .
Desde la década de 1950, la mayor parte del butanol en los Estados Unidos se produce comercialmente a partir de combustibles fósiles . El proceso más común comienza con propeno (propileno), que se somete a una reacción de hidroformilación para formar butanal , que luego se reduce con hidrógeno a 1-butanol y/o 2-butanol. El terc -butanol se deriva del isobutano como un coproducto de la producción de óxido de propileno .
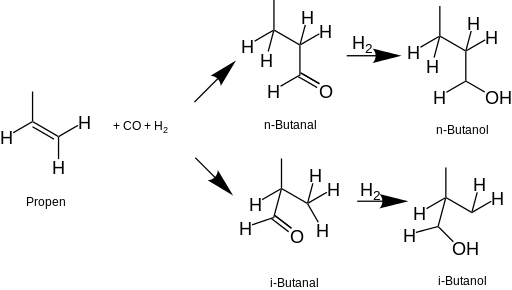
El butanol también se puede producir mediante la fermentación de biomasa por bacterias. Antes de la década de 1950, se utilizaba Clostridium acetobutylicum en la fermentación industrial para producir n -butanol.