
En química , un ion boranilo es un catión inorgánico con la fórmula química BR+
2, donde R representa un sustituyente no específico. Al ser deficientes en electrones, los iones de boranilio forman aductos con bases de Lewis . Los iones de boranilio tienen nombres históricos que dependen del número de ligandos coordinados: [1]
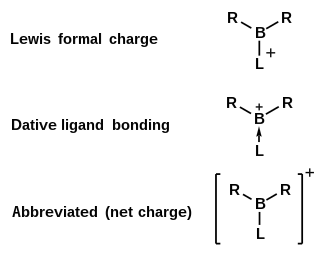
Un ion de borenio es un catión inorgánico con la fórmula química [BR
2[Yo]+
En esta clase de moléculas, el centro de boro deficiente en electrones tiene dos electrones de valencia involucrados en la unión sigma con dos ligandos, mientras que el tercer ligando es un donante de dos electrones de modo que la carga total del complejo es +1. [1] Dependiendo de la naturaleza de los ligandos alrededor del boro central, esta carga positiva puede estar localizada en el centro de boro o deslocalizada en toda la molécula. [3] Los iones de borenio se pueden producir de varias maneras diferentes y son de interés para aplicaciones en síntesis orgánica y catálisis . [2]
Los métodos sintéticos para preparar iones de borenio incluyen la abstracción de haluros, la disociación nucleofílica y la adición prótica a aminoboranos.

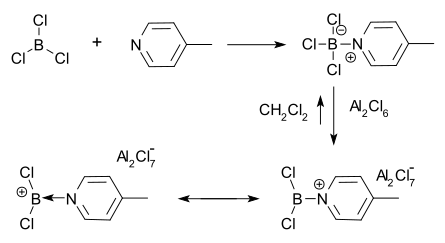
Los iones de borenio se pueden formar a partir de aductos de ácido-base de Lewis tetracoordinados de haluros de boro. En este método, la abstracción del haluro por un ácido de Lewis como AlCl 3 da como resultado un catión de borenio y un anión AlCl 4 − . [1] [5] El primer ion de borenio que se aisló y caracterizó fue realizado por Ryschkewitsch y Wiggins en 1970 utilizando este método. [4] Encontraron que el cloruro de aluminio se disolvía en diclorometano en presencia del aducto de 4-metilpiridina y BCl 3 . Luego se dedujo una carga positiva en el boro a partir de la espectroscopia de RMN de protones .
De manera similar al método de abstracción de haluro, los iones de borenio se pueden producir mediante la abstracción de un hidruro de un complejo de boro tetracoordinado. [6]

El desplazamiento de un ligando de un haluro de boro tricoordinado neutro por un donante neutro como la piridina da como resultado la generación de un catión de borenio. [1] Para que esta reacción produzca el catión de borenio deseado, el ligando debe ser un buen grupo saliente y el donante neutro debe tener suficiente volumen estérico para que la disociación nucleofílica se favorezca sobre la formación de un aducto ácido-base de Lewis con el material de partida neutro BR 3 , como lo demuestran los experimentos de competencia. [7]
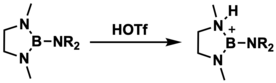
Los aminoboranos pueden ser protonados por diversos ácidos para formar iones de borenio. Este método sintético fue desarrollado en 1983 por Narula y Noth, quienes utilizaron ácido tríflico para protonar 1,3-dimetil-2-(dimetilamino)-1,3,2-diazaborolidina; sin embargo, no pudieron cristalizar ni caracterizar estructuralmente este catión en particular. [7]
La protonación de oxazaborolidinas no ácidas de Lewis da como resultado la generación de iones de borenio que pueden usarse como catalizadores enantioselectivos de Diels-Alder . Estas especies de borenio N-protonadas se han caracterizado por RMN . [8]
Los iones de borenio también se pueden producir a través de otros métodos, como la adición de una base a un ion de boro dicoordinado o por metátesis con sales con aniones débilmente coordinados como Ag[Al[OC(CF 3 ) 3 ] 4 ] o Li[Al[OC(CF 3 ) 3 ] 4 ]. [1] [9]
Se han caracterizado estructuralmente varios iones de borenio mediante cristalografía de rayos X. Las estructuras de los iones de borenio generalmente tienen dos enlaces cortos y un enlace más largo, que es característico de un enlace dativo . La naturaleza deficiente en electrones del centro de boro de muchos iones de borenio ha sido confirmada por estudios computacionales y experimentales. Un tratamiento de análisis de población natural de muchos iones de borenio muestra que el centro de boro efectivamente tiene una carga positiva significativa. Por ejemplo, el catión BH 2 NH 3 + tiene una carga natural de +0,687 en el boro. [10]
Dependiendo de la naturaleza de los ligandos alrededor del boro central, esta carga positiva puede estar localizada en el centro del boro o deslocalizada a lo largo de toda la molécula. En algunos casos, los ligandos pi-donadores dispuestos en el plano del orbital p vacío del boro pueden actuar para estabilizar la deficiencia electrónica del boro. Los cálculos de la teoría funcional de la densidad (DFT) de iones de borenio aislables muestran que el boro fuertemente ácido de Lewis puede estabilizarse mediante la pi-donación a partir de sustituyentes aromáticos como la piridina. [6]
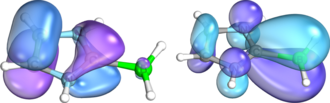
Los carbenos N-heterocíclicos (NHC) también se pueden utilizar para estabilizar los iones de borenio a través de la conjugación pi, aunque actúan como donantes pi más débiles que los donantes N neutros. [12] La energía de interacción entre un fragmento BH 2 + y varios NHC se ha calculado utilizando el método de estado de transición extendido para el análisis de descomposición de energía combinado con la teoría de orbitales naturales para valencia química (NOCV). Este análisis mostró un efecto neto donador pi del ligando NHC; en este caso, la carga positiva está deslocalizada sobre todo el sistema pi en lugar de estar localizada en el boro. [11]
En otros casos, se ha observado que el ligando dativo se desvía del plano BR 3 debido al amontonamiento estérico. Esta geometría no plana conduce a una reducción de la donación de pi al centro de boro, lo que lo hace aún más deficiente en electrones. [1] Se ha descubierto que una mayor localización de la carga en el boro aumenta la acidez de Lewis del borocatión. Muchos investigadores en este campo han utilizado el método de Gutmann-Beckett para comparar las acideces de Lewis de estos cationes. [12]
Las estructuras cristalinas tempranas de los cationes de borenio indican que el anión correspondiente no es coordinante. [7] Estudios posteriores han demostrado que la reactividad de los borocationes está muy ligada a la identidad de su contraión. En aplicaciones catalíticas, los aniones de coordinación débil han permitido los catalizadores de borenio más activos. Un contraión de uso común para los cationes de borenio es el tetrakis(pentafluorofenil)borato, B(C 6 F 5 ) 4 − ; sin embargo, también son posibles otros contraiones como AlCl 4 − , haluros y triflato. [1] [12] La viabilidad sintética de un ion de borenio a menudo está determinada por su reactividad en relación con su contraión. Los haluros a menudo no pueden estabilizar los iones de borenio, prefiriendo en cambio coordinarse con el centro de boro para formar una especie tetracoordinada. Muthaiah y colaboradores realizaron en 2013 una evaluación sistemática de los efectos de los contraiones en la viabilidad sintética de los iones NHC-diclorroborenio. [13]
Los iones de boro son altamente ácidos de Lewis . Su acidez de Lewis del átomo de boro está determinada por los efectos electrónicos y estéricos de sus ligandos.
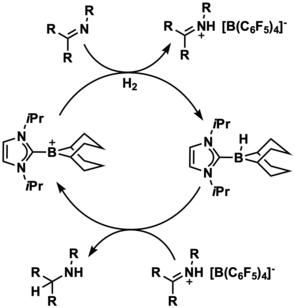
Se ha demostrado que los iones de borenio estabilizados con carbeno N-heterocíclico (NHC) son potentes catalizadores de activación e hidrogenación de H2 sin metales. A diferencia de los boranos neutros que se utilizan normalmente en la química de pares de Lewis frustrados (FLP) de este tipo, los iones de borenio son inherentemente electrofílicos y no requieren ligandos atractores de electrones para realizar estas activaciones de moléculas pequeñas. Debido a que los sustituyentes atractores de electrones pueden obstaculizar el suministro de hidruro durante la catálisis de hidrogenación, los iones de borenio pueden ser catalizadores más potentes que las especies de boro neutro porque son donantes de hidruro eficaces. De hecho, en 2012, Stephan y sus colaboradores pudieron desarrollar un sistema FLP basado en borenio capaz de activar H2 de forma estequiométrica en presencia de fosfina . [14]
En 2015, Devillard et al. sintetizaron un FLP intramolecular con puente de naftilo que contiene borenio capaz de activar H 2 con hidrogenólisis concomitante de un ligando mesitilo. Un análisis de teoría de perturbación de segundo orden de los orbitales de enlace natural (NBO) del intermediario en esta reacción involucrada con la activación de H 2 mostró una interacción de 281,8 kcal/mol entre el enlace sigma de H 2 y el orbital 2p del boro catiónico. [15]
Los iones de borenio también se han utilizado catalíticamente para diversas hidrogenaciones. Stephan y sus colaboradores pudieron utilizar un catalizador de iones de borenio para activar H2 catalíticamente para su uso en la hidrogenación de iminas . [14] Se utilizó un ion de borenio estabilizado con NHC similar para catalizar la reducción enantioselectiva de cetiminas. En este ejemplo, se logró la enantioselectividad mediante el uso de un ligando NHC quiral . [16]
Se ha demostrado que las propiedades estéricas y electrónicas del ligando NHC utilizado en estos catalizadores de borenio son de gran importancia para la actividad catalítica: los NHC que eran demasiado voluminosos impedían el suministro de hidruro intermolecular y los ligandos que donaban muchos electrones debilitaban la capacidad del catión de borenio para actuar como un ácido de Lewis. [12]
Los iones de borenio se han utilizado como catalizadores enantioselectivos libres de metales para una serie de transformaciones orgánicas. Un ejemplo temprano de ello es la reducción de Corey-Itsuno . Un mecanismo propuesto para esta reducción enantioselectiva implica la generación in situ de una especie similar al borenio utilizando BH3 como ácido de Lewis. [17]
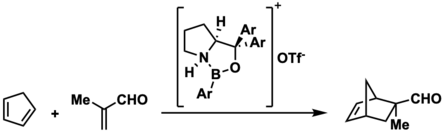
El trabajo posterior sobre los iones de borenio generados a partir de oxazaborolidinas neutras ha ampliado el alcance de sus aplicaciones. En 2002, EJ Corey y colaboradores informaron que la N-protonación de oxazaborolidinas ácidas no de Lewis da como resultado la generación de iones de borenio que pueden catalizar la reacción enantioselectiva de Diels-Alder de 1,3-dienos con 2-metacroleína o 2-bromoacroleína. Este ion de borenio en particular podría generarse in situ protonando una oxazaborolidina neutra con ácido tríflico. Corey y colaboradores sugieren que la estereoselectividad de esta reacción es el resultado de la asociación aldehído-catalizador en el estado de pretransición que gobierna la estereoselectividad. [8] El uso de iones de borenio como catalizadores de Diels-Alder se ha extendido aún más al uso de líquidos iónicos de borenio como catalizadores para la reacción de Diels-Alder por Matuszek et al. en 2017. [18]
Los iones de borenio también se han implicado como intermediarios en reacciones de borilación aromática electrofílica . [2] En muchos ejemplos de esta reacción, se utiliza un catalizador para activar un borano, produciendo un ion de borenio altamente reactivo. La formación de esta especie altamente electrofílica impulsa la formación del intermediario de Wheland , un paso clave en el mecanismo de adición aromática electrofílica. En 2013, Stahl et al. utilizaron un catalizador de tiolato de rutenio (II) para generar iones de borenio capaces de efectuar la borilación directa de heterociclos que contienen nitrógeno. [19]
En 2017, Oestreich y sus colaboradores desarrollaron un método sin metales para lograr esta transformación. En su trabajo, se utilizó B(C 6 H 5 ) 3 para activar el catecolborano, lo que generó un ion de borenio capaz de borilar varios heterociclos ricos en electrones . [20]
La electrofilicidad de los iones de borenio puede impulsar la transhidroboración de alquinos . En 2016, McGough et al. pudieron lograr con éxito la transhidroboración sin metales con una variedad de sustratos de arilacetileno utilizando un electrófilo de iones de borenio y B(C 6 F 5 ) 3 como catalizador. [21]

Se ha demostrado que los iones de borenio forman líquidos iónicos capaces de catalizar la polimerización de polialfaolefinas (PAO). Si bien aún no ha sido ampliamente adoptada por la industria, esta tecnología podría proporcionar una alternativa al uso de BF3 , un gas tóxico y corrosivo, en la síntesis industrial de PAO. [22]
Los iones de borinio tienen la fórmula [BX 2 ] + , [23] donde X − es normalmente una amida voluminosa (R 2 N − ). Tienen geometría lineal en boro y están coordinativamente insaturados.
Los iones de boronio tienen la fórmula [L 2 BR 2 ] + (L = base de Lewis ). Los iones de boronio son tetraédricos y están saturados de manera coordinada.
Un ejemplo bien conocido es [(H 3 N) 2 BH 2 ] + . La reacción del diborano con amoníaco produce principalmente [H 2 B(NH 3 ) 2 ] + [BH 4 ] − (tetrahidroborato de diamoniodihidroboronio). [24] [25]
Otros cationes de boro no clásicos son los di- y tricationes de boro mononucleares con fórmula [L 3 BX] 2+ y [L 4 B] 3+ , respectivamente. [26]
Otros cationes de boro reportados son dibora-dicaciones (dicaciones de bis(borenio)), algunos ejemplos se muestran a continuación. [27] [28]