El dióxido de carbono es un compuesto químico con la fórmula química CO2 . Está formado por moléculas que tienen cada una un átomo de carbono unido mediante un doble enlace covalente a dos átomos de oxígeno . Se encuentra en estado gaseoso a temperatura ambiente y, como fuente de carbono disponible en el ciclo del carbono , el CO2 atmosférico es la principal fuente de carbono para la vida en la Tierra. En el aire, el dióxido de carbono es transparente a la luz visible, pero absorbe la radiación infrarroja , actuando como un gas de efecto invernadero . El dióxido de carbono es soluble en agua y se encuentra en aguas subterráneas , lagos , casquetes polares y agua de mar . Cuando el dióxido de carbono se disuelve en agua, forma carbonato y principalmente bicarbonato ( HCO3) .−3), lo que provoca la acidificación de los océanos a medida que aumentan los niveles de CO 2 atmosférico . [9]
Es un gas traza en la atmósfera de la Tierra a 421 partes por millón (ppm) [a] , o aproximadamente el 0,04% (a mayo de 2022) habiendo aumentado desde los niveles preindustriales de 280 ppm o aproximadamente el 0,025%. [11] [12] La quema de combustibles fósiles es la causa principal de estas mayores concentraciones de CO 2 y también la causa principal del cambio climático . [13]
Su concentración en la atmósfera preindustrial de la Tierra desde finales del Precámbrico estaba regulada por organismos y fenómenos geológicos. Las plantas , las algas y las cianobacterias utilizan la energía de la luz solar para sintetizar carbohidratos a partir de dióxido de carbono y agua en un proceso llamado fotosíntesis , que produce oxígeno como producto de desecho. [14] A su vez, el oxígeno es consumido y el CO 2 es liberado como desecho por todos los organismos aeróbicos cuando metabolizan compuestos orgánicos para producir energía por respiración . [15] El CO 2 se libera de los materiales orgánicos cuando se descomponen o se queman, como en los incendios forestales.
El dióxido de carbono es un 53% más denso que el aire seco, pero tiene una larga vida y se mezcla completamente en la atmósfera. Aproximadamente la mitad del exceso de emisiones de CO2 a la atmósfera son absorbidas por los sumideros de carbono terrestres y oceánicos . [16] Estos sumideros pueden saturarse y son volátiles, ya que la descomposición y los incendios forestales dan como resultado que el CO2 se libere nuevamente a la atmósfera. [17] El CO2 finalmente se secuestra (se almacena a largo plazo) en rocas y depósitos orgánicos como carbón , petróleo y gas natural . El CO2 secuestrado se libera a la atmósfera a través de la quema de combustibles fósiles o de forma natural por volcanes , fuentes termales , géiseres y cuando las rocas carbonatadas se disuelven en agua o reaccionan con ácidos.
El CO2 es un material industrial versátil, utilizado, por ejemplo, como gas inerte en soldaduras y extintores de incendios , como gas presurizador en pistolas de aire y recuperación de petróleo, y como disolvente de fluido supercrítico en descafeinización y secado supercrítico . [18] Es un subproducto de la fermentación de azúcares en la elaboración de pan , cerveza y vino , y se añade a bebidas carbonatadas como el agua carbonatada y la cerveza para generar efervescencia. Tiene un olor fuerte y ácido y genera el sabor del agua carbonatada en la boca, pero en concentraciones normales es inodoro. [1]
El dióxido de carbono no se puede licuar a presión atmosférica. El dióxido de carbono a baja temperatura se utiliza comercialmente en su forma sólida, comúnmente conocida como " hielo seco ". La transición de fase sólida a gas ocurre a 194,7 Kelvin y se denomina sublimación .
La simetría de una molécula de dióxido de carbono es lineal y centrosimétrica en su geometría de equilibrio. La longitud del enlace carbono-oxígeno en el dióxido de carbono es de 116,3 pm , notablemente más corta que la longitud de aproximadamente 140 pm de un enlace C-O simple típico, y más corta que la de la mayoría de los otros grupos funcionales C-O con enlaces múltiples, como los carbonilos . [19] Dado que es centrosimétrica, la molécula no tiene momento dipolar eléctrico .

Como molécula triatómica lineal, el CO2 tiene cuatro modos vibracionales , como se muestra en el diagrama. En los modos de estiramiento simétrico y antisimétrico, los átomos se mueven a lo largo del eje de la molécula. Hay dos modos de flexión, que son degenerados , lo que significa que tienen la misma frecuencia y la misma energía, debido a la simetría de la molécula. Cuando una molécula toca una superficie o toca otra molécula, los dos modos de flexión pueden diferir en frecuencia porque la interacción es diferente para los dos modos. Algunos de los modos vibracionales se observan en el espectro infrarrojo (IR) : el modo de estiramiento antisimétrico en el número de onda 2349 cm −1 (longitud de onda 4,25 μm) y el par degenerado de modos de flexión en 667 cm −1 (longitud de onda 15 μm). El modo de estiramiento simétrico no crea un dipolo eléctrico, por lo que no se observa en la espectroscopia IR, pero se detecta en la espectroscopia Raman a 1388 cm −1 (longitud de onda 7,2 μm). [20]
En la fase gaseosa, las moléculas de dióxido de carbono experimentan movimientos vibratorios significativos y no mantienen una estructura fija. Sin embargo, en un experimento de obtención de imágenes de explosión de Coulomb , se puede deducir una imagen instantánea de la estructura molecular. Se ha realizado un experimento de este tipo [21] para el dióxido de carbono. El resultado de este experimento, y la conclusión de los cálculos teóricos [22] basados en una superficie de energía potencial ab initio de la molécula, es que ninguna de las moléculas en la fase gaseosa es exactamente lineal. Este resultado contra-intuitivo se debe trivialmente al hecho de que el elemento de volumen del movimiento nuclear se desvanece para las geometrías lineales. [22] Esto es así para todas las moléculas excepto las moléculas diatómicas .
El dióxido de carbono es soluble en agua, en la que forma reversiblemente H 2 CO 3 (ácido carbónico), que es un ácido débil , porque su ionización en agua es incompleta.
La constante de equilibrio de hidratación del ácido carbónico es, a 25 °C:
Por lo tanto, la mayor parte del dióxido de carbono no se convierte en ácido carbónico, sino que permanece como moléculas de CO2 , sin afectar el pH.
Las concentraciones relativas de CO 2 , H 2 CO 3 y las formas desprotonadas HCO−3( bicarbonato ) y CO2−3( carbonato ) depende del pH . Como se muestra en un diagrama de Bjerrum , en agua neutra o ligeramente alcalina (pH > 6,5), predomina la forma bicarbonato (>50%) convirtiéndose en la más prevalente (>95%) al pH del agua de mar. En agua muy alcalina (pH > 10,4), la forma predominante (>50%) es el carbonato. Los océanos, al ser ligeramente alcalinos con un pH típico de 8,2 a 8,5, contienen alrededor de 120 mg de bicarbonato por litro.
Al ser diprótico , el ácido carbónico tiene dos constantes de disociación ácida , la primera para la disociación en el ion bicarbonato (también llamado hidrogenocarbonato) ( HCO−3):
Esta es la verdadera primera constante de disociación ácida, definida como
donde el denominador incluye solo H 2 CO 3 unido covalentemente y no incluye CO 2 hidratado (ac). El valor mucho más pequeño y frecuentemente citado cerca de 4,16 × 10 −7 (o pK a1 = 6,38) es un valor aparente calculado sobre la suposición (incorrecta) de que todo el CO 2 disuelto está presente como ácido carbónico, de modo que
Dado que la mayor parte del CO 2 disuelto permanece como moléculas de CO 2 , K a1 (aparente) tiene un denominador mucho mayor y un valor mucho menor que el K a1 verdadero . [23]
El ion bicarbonato es una especie anfótera que puede actuar como ácido o como base, dependiendo del pH de la solución. A pH alto, se disocia significativamente en el ion carbonato ( CO2−3):
En los organismos, la producción de ácido carbónico está catalizada por la enzima conocida como anhidrasa carbónica .
Además de alterar su acidez, la presencia de dióxido de carbono en el agua también afecta sus propiedades eléctricas.
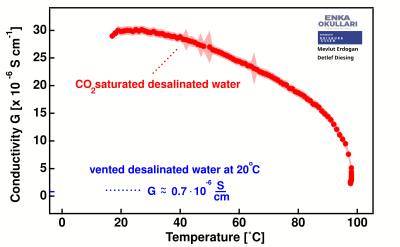
Cuando el dióxido de carbono se disuelve en agua desalinizada, la conductividad eléctrica aumenta significativamente desde menos de 1 μS/cm hasta casi 30 μS/cm. Al calentarse, el agua comienza a perder gradualmente la conductividad inducida por la presencia de , especialmente notable a temperaturas superiores a los 30 °C.
La dependencia de la temperatura de la conductividad eléctrica del agua completamente desionizada sin saturación es comparativamente baja en relación con estos datos.
El CO 2 es un electrófilo potente que tiene una reactividad electrófila comparable a la del benzaldehído o a los compuestos carbonílicos α,β-insaturados fuertemente electrófilos . Sin embargo, a diferencia de los electrófilos de reactividad similar, las reacciones de los nucleófilos con el CO 2 son termodinámicamente menos favorecidas y a menudo se descubre que son altamente reversibles. [24] La reacción reversible del dióxido de carbono con aminas para formar carbamatos se utiliza en depuradores de CO 2 y se ha sugerido como un posible punto de partida para la captura y almacenamiento de carbono mediante el tratamiento de gases de amina . Solo los nucleófilos muy fuertes, como los carbaniones proporcionados por los reactivos de Grignard y los compuestos de organolitio, reaccionan con el CO 2 para dar carboxilatos :
En los complejos metálicos de dióxido de carbono , el CO2 actúa como ligando , lo que puede facilitar la conversión de CO2 en otras sustancias químicas. [25]
La reducción de CO 2 a CO es normalmente una reacción difícil y lenta:
El potencial redox para esta reacción cerca de un pH de 7 es de aproximadamente -0,53 V en comparación con el electrodo de hidrógeno estándar . La enzima que contiene níquel, la deshidrogenasa de monóxido de carbono, cataliza este proceso. [26]
Los fotoautótrofos (es decir, plantas y cianobacterias ) utilizan la energía contenida en la luz solar para fotosintetizar azúcares simples a partir del CO2 absorbido del aire y el agua:

El dióxido de carbono es incoloro. En concentraciones bajas, el gas es inodoro; sin embargo, en concentraciones suficientemente altas, tiene un olor ácido y penetrante. [1] A temperatura y presión estándar , la densidad del dióxido de carbono es de alrededor de 1,98 kg/m 3 , aproximadamente 1,53 veces la del aire . [27]
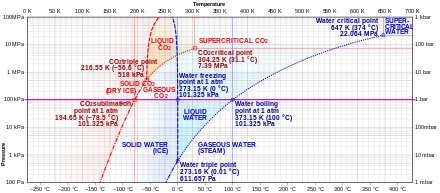
El dióxido de carbono no tiene estado líquido a presiones inferiores a 0,51795(10) MPa [2] (5,11177(99) atm ). A una presión de 1 atm (0,101325 MPa), el gas se deposita directamente en un sólido a temperaturas inferiores a 194,6855(30) K [2] (−78,4645(30) °C) y el sólido sublima directamente en un gas por encima de esta temperatura. En su estado sólido, el dióxido de carbono se denomina comúnmente hielo seco .

El dióxido de carbono líquido se forma solo a presiones superiores a 0,51795(10) MPa [2] (5,11177(99) atm); el punto triple del dióxido de carbono es 216,592(3) K [2] (−56,558(3) °C) a 0,51795(10) MPa [2] (5,11177(99) atm) (véase el diagrama de fases). El punto crítico es 304,128(15) K [2] (30,978(15) °C) a 7,3773(30) MPa [2] (72,808(30) atm). Otra forma de dióxido de carbono sólido observada a alta presión es un sólido amorfo similar al vidrio. [28] Esta forma de vidrio, llamada carbonia , se produce al sobreenfriar CO2 calentado a presiones extremas (40–48 GPa , o aproximadamente 400.000 atmósferas) en un yunque de diamante . Este descubrimiento confirmó la teoría de que el dióxido de carbono podría existir en un estado vítreo similar a otros miembros de su familia elemental, como el dióxido de silicio (vidrio de sílice) y el dióxido de germanio . Sin embargo, a diferencia de los vidrios de sílice y germania, el vidrio carbonia no es estable a presiones normales y se revierte al gas cuando se libera la presión.
A temperaturas y presiones superiores al punto crítico, el dióxido de carbono se comporta como un fluido supercrítico conocido como dióxido de carbono supercrítico .
Tabla de propiedades térmicas y físicas del dióxido de carbono líquido saturado: [29] [30]
Tabla de propiedades térmicas y físicas del dióxido de carbono (CO 2 ) a presión atmosférica: [29] [30]
El dióxido de carbono es un producto final de la respiración celular en los organismos que obtienen energía descomponiendo azúcares, grasas y aminoácidos con oxígeno como parte de su metabolismo . Esto incluye a todas las plantas, algas y animales y hongos y bacterias aeróbicas . En los vertebrados , el dióxido de carbono viaja en la sangre desde los tejidos del cuerpo hasta la piel (p. ej., anfibios ) o las branquias (p. ej., peces ), desde donde se disuelve en el agua, o hasta los pulmones desde donde se exhala. Durante la fotosíntesis activa, las plantas pueden absorber más dióxido de carbono de la atmósfera del que liberan en la respiración.

La fijación del carbono es un proceso bioquímico por el cual las plantas, algas y cianobacterias incorporan el dióxido de carbono atmosférico a moléculas orgánicas ricas en energía, como la glucosa , creando así su propio alimento mediante la fotosíntesis. La fotosíntesis utiliza el dióxido de carbono y el agua para producir azúcares a partir de los cuales se pueden construir otros compuestos orgánicos , y se produce oxígeno como subproducto.
La ribulosa-1,5-bisfosfato carboxilasa oxigenasa , comúnmente abreviada como RuBisCO, es la enzima involucrada en el primer paso principal de la fijación de carbono, la producción de dos moléculas de 3-fosfoglicerato a partir de CO2 y ribulosa bisfosfato , como se muestra en el diagrama de la izquierda.
Se cree que RuBisCO es la proteína más abundante en la Tierra. [31]
Los fotótrofos utilizan los productos de su fotosíntesis como fuentes de alimento interno y como materia prima para la biosíntesis de moléculas orgánicas más complejas, como polisacáridos , ácidos nucleicos y proteínas. Estos se utilizan para su propio crecimiento y también como base de las cadenas y redes alimentarias que alimentan a otros organismos, incluidos animales como nosotros. Algunos fotótrofos importantes, los cocolitóforos, sintetizan escamas duras de carbonato de calcio . [32] Una especie de cocolitóforo de importancia mundial es Emiliania huxleyi , cuyas escamas de calcita han formado la base de muchas rocas sedimentarias como la caliza , donde lo que anteriormente era carbono atmosférico puede permanecer fijado durante escalas de tiempo geológicas.
Las plantas pueden crecer hasta un 50% más rápido en concentraciones de 1.000 ppm de CO2 en comparación con las condiciones ambientales, aunque esto supone que no hay cambios en el clima ni limitaciones en otros nutrientes. [33] Los niveles elevados de CO2 provocan un mayor crecimiento que se refleja en el rendimiento cosechable de los cultivos, y el trigo, el arroz y la soja mostraron aumentos en el rendimiento de entre el 12 y el 14% en condiciones de CO2 elevado en experimentos FACE. [34] [35]
El aumento de las concentraciones atmosféricas de CO2 da como resultado un menor desarrollo de estomas en las plantas [36], lo que conduce a un menor uso del agua y a una mayor eficiencia en su uso . [37] Los estudios que utilizan FACE han demostrado que el enriquecimiento con CO2 conduce a una disminución de las concentraciones de micronutrientes en las plantas de cultivo. [38] Esto puede tener efectos secundarios en otras partes de los ecosistemas , ya que los herbívoros necesitarán comer más alimentos para obtener la misma cantidad de proteínas. [39]
La concentración de metabolitos secundarios como fenilpropanoides y flavonoides también puede alterarse en plantas expuestas a altas concentraciones de CO 2 . [40] [41]
Las plantas también emiten CO2 durante la respiración, por lo que la mayoría de las plantas y algas, que utilizan la fotosíntesis de C3 , solo son absorbentes netos durante el día. Aunque un bosque en crecimiento absorberá muchas toneladas de CO2 cada año, un bosque maduro producirá tanto CO2 a partir de la respiración y la descomposición de especímenes muertos (por ejemplo, ramas caídas) como el que se utiliza en la fotosíntesis en las plantas en crecimiento. [42] Contrariamente a la opinión de larga data de que son neutrales en carbono, los bosques maduros pueden seguir acumulando carbono [43] y seguir siendo valiosos sumideros de carbono , lo que ayuda a mantener el equilibrio de carbono de la atmósfera de la Tierra. Además, y de manera crucial para la vida en la Tierra, la fotosíntesis del fitoplancton consume CO2 disuelto en el océano superior y, por lo tanto, promueve la absorción de CO2 de la atmósfera. [44]

El contenido de dióxido de carbono en el aire fresco (promediado entre el nivel del mar y el nivel de 10 kPa, es decir, aproximadamente 30 km (19 mi) de altitud) varía entre 0,036% (360 ppm) y 0,041% (412 ppm), dependiendo de la ubicación. [46]
El CO 2 es un gas asfixiante y no está clasificado como tóxico o dañino de acuerdo con las normas del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos de la Comisión Económica de las Naciones Unidas para Europa utilizando las Directrices de la OCDE para el Ensayo de Productos Químicos . En concentraciones de hasta el 1% (10.000 ppm), hará que algunas personas se sientan somnolientas y dará a los pulmones una sensación de congestión. [45] Las concentraciones del 7% al 10% (70.000 a 100.000 ppm) pueden causar asfixia, incluso en presencia de suficiente oxígeno, manifestándose como mareos, dolor de cabeza, disfunción visual y auditiva y pérdida del conocimiento en unos pocos minutos a una hora. [47] Los efectos fisiológicos de la exposición aguda al dióxido de carbono se agrupan bajo el término hipercapnia , un subconjunto de la asfixia .
Debido a que es más pesado que el aire, en lugares donde el gas se filtra desde el suelo (debido a la actividad volcánica o geotérmica subterránea) en concentraciones relativamente altas, sin los efectos de dispersión del viento, puede acumularse en lugares protegidos o en bolsas por debajo del nivel medio del suelo, lo que provoca la asfixia de los animales que se encuentran allí. Los carroñeros atraídos por los cadáveres también mueren. Han muerto niños de la misma forma cerca de la ciudad de Goma por las emisiones de CO2 del cercano volcán Nyiragongo . [48] El término swahili para este fenómeno es mazuku .

La adaptación a concentraciones mayores de CO 2 ocurre en los humanos, incluyendo respiración modificada y producción de bicarbonato en los riñones, con el fin de equilibrar los efectos de la acidificación de la sangre ( acidosis ). Varios estudios sugirieron que concentraciones inspiradas del 2,0 por ciento podrían usarse para espacios aéreos cerrados (por ejemplo, un submarino ) ya que la adaptación es fisiológica y reversible, ya que el deterioro en el rendimiento o en la actividad física normal no ocurre en este nivel de exposición durante cinco días. [49] [50] Sin embargo, otros estudios muestran una disminución en la función cognitiva incluso a niveles mucho más bajos. [51] [52] Además, con acidosis respiratoria en curso , los mecanismos de adaptación o compensación no podrán revertir la condición.
Existen pocos estudios sobre los efectos en la salud de la exposición continua a largo plazo al CO2 en seres humanos y animales a niveles inferiores al 1%. En Estados Unidos, los límites de exposición ocupacional al CO2 se han establecido en el 0,5% (5000 ppm) durante un período de ocho horas. [ 53] Con esta concentración de CO2 , la tripulación de la Estación Espacial Internacional experimentó dolores de cabeza, letargo, lentitud mental, irritación emocional y alteración del sueño. [54] Estudios en animales al 0,5% de CO2 han demostrado calcificación renal y pérdida ósea después de ocho semanas de exposición. [55] Un estudio de seres humanos expuestos en sesiones de 2,5 horas demostró efectos negativos significativos en las capacidades cognitivas a concentraciones tan bajas como 0,1% (1000 ppm) de CO2, probablemente debido a aumentos inducidos por el CO2 en el flujo sanguíneo cerebral. [51] Otro estudio observó una disminución en el nivel de actividad básica y el uso de la información a 1000 ppm, en comparación con 500 ppm. [52]
Sin embargo, una revisión de la literatura encontró que un subconjunto confiable de estudios sobre el fenómeno del deterioro cognitivo inducido por el dióxido de carbono solo mostró un pequeño efecto en la toma de decisiones de alto nivel (para concentraciones inferiores a 5000 ppm). La mayoría de los estudios se vieron afectados por diseños de estudio inadecuados, comodidad ambiental, incertidumbres en las dosis de exposición y diferentes evaluaciones cognitivas utilizadas. [56] De manera similar, un estudio sobre los efectos de la concentración de CO2 en los cascos de motocicleta ha sido criticado por tener una metodología dudosa al no anotar los autoinformes de los motociclistas y tomar mediciones utilizando maniquíes. Además, cuando se alcanzaron las condiciones normales de la motocicleta (como velocidades de autopista o ciudad) o se levantó la visera, la concentración de CO2 disminuyó a niveles seguros (0,2%). [57] [58]

La mala ventilación es una de las principales causas de concentraciones excesivas de CO2 en espacios cerrados, lo que conduce a una mala calidad del aire interior . El diferencial de dióxido de carbono por encima de las concentraciones exteriores en condiciones de estado estable (cuando la ocupación y el funcionamiento del sistema de ventilación son lo suficientemente largos como para que la concentración de CO2 se haya estabilizado) a veces se utiliza para estimar las tasas de ventilación por persona. [60] Las concentraciones más altas de CO2 se asocian con la salud de los ocupantes, la comodidad y la degradación del rendimiento. [61] [62] Las tasas de ventilación de la Norma ASHRAE 62.1–2007 pueden dar lugar a concentraciones interiores de hasta 2100 ppm por encima de las condiciones ambientales exteriores. Por lo tanto, si la concentración exterior es de 400 ppm, las concentraciones interiores pueden alcanzar las 2500 ppm con tasas de ventilación que cumplan con esta norma de consenso de la industria. Se pueden encontrar concentraciones incluso superiores a esto en espacios mal ventilados (rango de 3000 o 4000 ppm).
Los mineros, que son especialmente vulnerables a la exposición a gases debido a la ventilación insuficiente, se referían a las mezclas de dióxido de carbono y nitrógeno como " humedad negra ", "humedad asfixiante" o "estiba". Antes de que se desarrollaran tecnologías más efectivas, los mineros solían controlar los niveles peligrosos de humedad negra y otros gases en los pozos de las minas llevando consigo un canario enjaulado mientras trabajaban. El canario es más sensible a los gases asfixiantes que los humanos y, cuando perdía el conocimiento, dejaba de cantar y se caía de su percha. La lámpara Davy también podía detectar altos niveles de humedad negra (que se hunde y se acumula cerca del suelo) al arder con menos intensidad, mientras que el metano , otro gas asfixiante y con riesgo de explosión, hacía que la lámpara ardiese con más intensidad.
En febrero de 2020, tres personas murieron por asfixia en una fiesta en Moscú cuando se añadió hielo seco (CO2 congelado ) a una piscina para enfriarla. [63] Un accidente similar ocurrió en 2018 cuando una mujer murió a causa de los vapores de CO2 que emanaban de la gran cantidad de hielo seco que transportaba en su automóvil. [64]
Los seres humanos pasan cada vez más tiempo en un ambiente confinado (entre el 80 y el 90 % del tiempo en un edificio o en un vehículo). Según la Agencia Francesa de Seguridad Alimentaria, Medioambiental y de Salud en el Trabajo (ANSES) y diversos actores en Francia, la tasa de CO2 en el aire interior de los edificios (vinculada a la ocupación humana o animal y a la presencia de instalaciones de combustión ), ponderada por la renovación del aire, se sitúa "normalmente entre unas 350 y 2.500 ppm". [65]
En los hogares, escuelas, guarderías y oficinas no existen relaciones sistemáticas entre los niveles de CO2 y otros contaminantes, y el CO2 en interiores no es estadísticamente un buen predictor de los contaminantes relacionados con el tráfico vial (o aéreo, etc.) en exteriores. [66] El CO2 es el parámetro que cambia más rápidamente (junto con la higrometría y los niveles de oxígeno cuando los humanos o los animales están reunidos en una habitación cerrada o mal ventilada). En los países pobres, muchos hogares abiertos son fuentes de CO2 y CO emitidos directamente al entorno vital. [67]
Las concentraciones locales de dióxido de carbono pueden alcanzar valores elevados cerca de fuentes potentes, especialmente aquellas que están aisladas por el terreno circundante. En las aguas termales de Bossoleto, cerca de Rapolano Terme en Toscana , Italia, situadas en una depresión en forma de cuenco de unos 100 m (330 pies) de diámetro, las concentraciones de CO2 aumentan por encima del 75% durante la noche, lo suficiente para matar insectos y animales pequeños. Después del amanecer, el gas se dispersa por convección. [68] Se cree que las altas concentraciones de CO2 producidas por la perturbación del agua de un lago profundo saturado de CO2 causaron 37 muertes en el lago Monoun , Camerún, en 1984 y 1700 víctimas en el lago Nyos , Camerún, en 1986. [69]
El cuerpo produce aproximadamente 2,3 libras (1,0 kg) de dióxido de carbono por día por persona, [71] que contiene 0,63 libras (290 g) de carbono.En los seres humanos, este dióxido de carbono se transporta a través del sistema venoso y se exhala a través de los pulmones, lo que da como resultado concentraciones más bajas en las arterias . El contenido de dióxido de carbono de la sangre a menudo se expresa como presión parcial , que es la presión que habría tenido el dióxido de carbono si solo ocupara el volumen. [72] En los seres humanos, los contenidos de dióxido de carbono en la sangre se muestran en la tabla adyacente.
El CO2 se transporta en la sangre de tres formas diferentes. Los porcentajes exactos varían entre la sangre arterial y la venosa.
La hemoglobina , la principal molécula transportadora de oxígeno en los glóbulos rojos , transporta tanto oxígeno como dióxido de carbono. Sin embargo, el CO 2 unido a la hemoglobina no se une al mismo sitio que el oxígeno. En cambio, se combina con los grupos N-terminales de las cuatro cadenas de globina. Sin embargo, debido a los efectos alostéricos en la molécula de hemoglobina, la unión del CO 2 disminuye la cantidad de oxígeno que se une para una presión parcial de oxígeno dada. Esto se conoce como el efecto Haldane y es importante en el transporte de dióxido de carbono desde los tejidos hasta los pulmones. Por el contrario, un aumento en la presión parcial de CO 2 o un pH más bajo provocarán la descarga de oxígeno de la hemoglobina, lo que se conoce como el efecto Bohr .
El dióxido de carbono es uno de los mediadores de la autorregulación local del riego sanguíneo. Si su concentración es alta, los capilares se expanden para permitir un mayor flujo sanguíneo a ese tejido. [74]
Los iones de bicarbonato son cruciales para regular el pH de la sangre. La frecuencia respiratoria de una persona influye en el nivel de CO2 en su sangre. Una respiración demasiado lenta o superficial provoca acidosis respiratoria , mientras que una respiración demasiado rápida provoca hiperventilación , que puede causar alcalosis respiratoria . [75]
Aunque el cuerpo necesita oxígeno para el metabolismo, los niveles bajos de oxígeno normalmente no estimulan la respiración, sino que la misma es estimulada por niveles más altos de dióxido de carbono. Como resultado, respirar aire a baja presión o una mezcla de gases sin oxígeno en absoluto (como nitrógeno puro) puede provocar pérdida de conciencia sin experimentar nunca la falta de aire . Esto es especialmente peligroso para los pilotos de combate de gran altitud. También es por eso que los auxiliares de vuelo instruyen a los pasajeros, en caso de pérdida de presión en la cabina, a colocarse primero la máscara de oxígeno ellos mismos antes de ayudar a los demás; de lo contrario, se corre el riesgo de perder la conciencia. [73]
Los centros respiratorios intentan mantener una presión arterial de CO2 de 40 mmHg . Con la hiperventilación intencionada, el contenido de CO2 de la sangre arterial puede reducirse a 10-20 mmHg (el contenido de oxígeno de la sangre se ve poco afectado) y el impulso respiratorio se reduce. Por eso, uno puede contener la respiración durante más tiempo después de la hiperventilación que sin ella. Esto conlleva el riesgo de que se produzca una pérdida de conocimiento antes de que la necesidad de respirar se vuelva abrumadora, por lo que la hiperventilación es especialmente peligrosa antes del buceo en apnea. [76]

En la atmósfera de la Tierra , el dióxido de carbono es un gas traza que juega un papel integral en el efecto invernadero , el ciclo del carbono , la fotosíntesis y el ciclo del carbono oceánico . Es uno de los tres principales gases de efecto invernadero en la atmósfera de la Tierra . El vapor de agua es el principal gas de efecto invernadero , a partir de 2010, contribuyendo con el 50% del efecto invernadero, seguido por el dióxido de carbono con el 20%. [77] La concentración media global actual de dióxido de carbono (CO 2 ) en la atmósfera es de 421 ppm (0,04 %) a mayo de 2022. [78] Este es un aumento del 50% desde el inicio de la Revolución Industrial , frente a las 280 ppm durante los 10.000 años anteriores a mediados del siglo XVIII. [79] [78] [80] El aumento se debe a la actividad humana . [81]
En marzo de 2024, la concentración media mensual de CO 2 alcanzó un nuevo récord de 425,22 partes por millón (ppm), lo que supone un aumento de 4,7 ppm con respecto a marzo de 2023. Según la última medición, los niveles habían aumentado aún más hasta 427,48 ppm. [82] Este aumento continuo de las concentraciones de CO 2 es un claro indicador del estrés ambiental global en curso, impulsado principalmente por la quema de combustibles fósiles , que es la principal causa de este aumento y también un importante contribuyente al cambio climático . [83] Otras actividades humanas importantes que emiten CO 2 incluyen la producción de cemento , la deforestación y la quema de biomasa .
El dióxido de carbono es un gas de efecto invernadero. Absorbe y emite radiación infrarroja en sus dos frecuencias vibratorias activas en el infrarrojo. Las dos longitudes de onda son 4,26 μm (2347 cm −1 ) ( modo vibratorio de estiramiento asimétrico ) y 14,99 μm (667 cm −1 ) (modo vibratorio de flexión). El CO 2 desempeña un papel importante en la influencia de la temperatura de la superficie de la Tierra a través del efecto invernadero. [84] La emisión de luz de la superficie de la Tierra es más intensa en la región infrarroja entre 200 y 2500 cm −1 , [85] a diferencia de la emisión de luz del Sol mucho más caliente, que es más intensa en la región visible. La absorción de luz infrarroja en las frecuencias vibratorias del CO 2 atmosférico atrapa la energía cerca de la superficie, calentando la superficie de la Tierra y su atmósfera inferior. Menos energía llega a la atmósfera superior, que por lo tanto es más fría debido a esta absorción. [86]
El aumento de las concentraciones atmosféricas de CO 2 y otros gases de efecto invernadero de larga duración, como el metano , aumenta la absorción y emisión de radiación infrarroja por parte de la atmósfera. Esto ha provocado un aumento de la temperatura media global y la acidificación de los océanos . Otro efecto directo es el efecto de fertilización del CO 2 . El aumento de las concentraciones atmosféricas de CO 2 provoca una serie de efectos adicionales del cambio climático sobre el medio ambiente y las condiciones de vida de los seres humanos.
La concentración atmosférica actual de CO2 es la más alta en 14 millones de años. [87] Las concentraciones de CO2 en la atmósfera fueron tan altas como 4.000 ppm durante el período Cámbrico hace unos 500 millones de años, y tan bajas como 180 ppm durante la glaciación cuaternaria de los últimos dos millones de años. [79] Los registros de temperatura reconstruidos para los últimos 420 millones de años indican que las concentraciones atmosféricas de CO2 alcanzaron un máximo de aproximadamente 2.000 ppm. Este pico ocurrió durante el período Devónico (hace 400 millones de años). Otro pico ocurrió en el período Triásico (hace 220-200 millones de años). [88]
El dióxido de carbono se disuelve en el océano para formar ácido carbónico ( H2CO3 ) , bicarbonato ( HCO3 ) .−3) y carbonato ( CO2−3). En los océanos hay aproximadamente cincuenta veces más dióxido de carbono disuelto que el que existe en la atmósfera. Los océanos actúan como un enorme sumidero de carbono y han absorbido aproximadamente un tercio del CO 2 emitido por la actividad humana. [90]
La acidificación de los océanos es la disminución continua del pH de los océanos de la Tierra . Entre 1950 y 2020, el pH promedio de la superficie del océano cayó de aproximadamente 8,15 a 8,05. [91] Las emisiones de dióxido de carbono de las actividades humanas son la causa principal de la acidificación de los océanos, con niveles de dióxido de carbono atmosférico (CO 2 ) que superan las 422 ppm (a partir de 2024 [update]). [92] El CO 2 de la atmósfera es absorbido por los océanos. Esta reacción química produce ácido carbónico ( H 2 CO 3 ) que se disocia en un ion bicarbonato ( HCO−3) y un ion hidrógeno ( H + ). La presencia de iones hidrógeno libres ( H + ) reduce el pH del océano, aumentando la acidez (esto no significa que el agua de mar sea ácida todavía; sigue siendo alcalina , con un pH superior a 8). Los organismos marinos calcificantes , como los moluscos y los corales , son especialmente vulnerables porque dependen del carbonato de calcio para construir conchas y esqueletos. [93]
Un cambio de 0,1 en el pH representa un aumento del 26% en la concentración de iones de hidrógeno en los océanos del mundo (la escala de pH es logarítmica, por lo que un cambio de uno en las unidades de pH equivale a un cambio de diez veces en la concentración de iones de hidrógeno). El pH de la superficie del mar y los estados de saturación de carbonatos varían según la profundidad y la ubicación del océano. Las aguas más frías y de latitudes más altas son capaces de absorber más CO 2 . Esto puede hacer que la acidez aumente, reduciendo el pH y los niveles de saturación de carbonatos en estas áreas. Hay varios otros factores que influyen en el intercambio de CO 2 entre la atmósfera y el océano y, por lo tanto, en la acidificación local de los océanos. Estos incluyen las corrientes oceánicas y las zonas de surgencia , la proximidad a grandes ríos continentales, la cobertura de hielo marino y el intercambio atmosférico con nitrógeno y azufre provenientes de la quema de combustibles fósiles y la agricultura . [94] [95] [96]
Los cambios en la química del océano pueden tener amplios efectos directos e indirectos sobre los organismos y sus hábitats. Una de las repercusiones más importantes del aumento de la acidez del océano se relaciona con la producción de conchas a partir de carbonato de calcio ( CaCO 3 ). [93] Este proceso se llama calcificación y es importante para la biología y la supervivencia de una amplia gama de organismos marinos. La calcificación implica la precipitación de iones disueltos en estructuras sólidas de CaCO 3 , estructuras para muchos organismos marinos, como cocolitóforos , foraminíferos , crustáceos , moluscos , etc. Después de que se forman, estas estructuras de CaCO 3 son vulnerables a la disolución a menos que el agua de mar circundante contenga concentraciones saturantes de iones de carbonato ( CO2−3).
Muy poco del dióxido de carbono adicional que se añade al océano permanece en forma de dióxido de carbono disuelto. La mayor parte se disocia en bicarbonato adicional e iones de hidrógeno libres. El aumento de hidrógeno es mayor que el de bicarbonato, [97] lo que crea un desequilibrio en la reacción:
Para mantener el equilibrio químico, algunos de los iones de carbonato que ya se encuentran en el océano se combinan con algunos de los iones de hidrógeno para formar más bicarbonato. De esta manera, se reduce la concentración de iones de carbonato en el océano, lo que elimina un componente esencial para que los organismos marinos construyan conchas o se calcifiquen:
El dióxido de carbono también se introduce en los océanos a través de los respiraderos hidrotermales. El respiradero hidrotermal Champagne , que se encuentra en el volcán Eifuku del Noroeste en la Fosa de las Marianas , produce dióxido de carbono líquido casi puro, uno de los dos únicos sitios conocidos en el mundo en 2004, el otro se encuentra en la Fosa de Okinawa . [98] El hallazgo de un lago submarino de dióxido de carbono líquido en la Fosa de Okinawa se informó en 2006. [99]
El dióxido de carbono es un subproducto de la fermentación del azúcar en la elaboración de cerveza , whisky y otras bebidas alcohólicas y en la producción de bioetanol . La levadura metaboliza el azúcar para producir CO2 y etanol , también conocido como alcohol, de la siguiente manera:
Todos los organismos aeróbicos producen CO2 cuando oxidan carbohidratos , ácidos grasos y proteínas . La gran cantidad de reacciones involucradas son extremadamente complejas y no se describen fácilmente. Consulte la respiración celular , la respiración anaeróbica y la fotosíntesis . La ecuación para la respiración de la glucosa y otros monosacáridos es:
Los organismos anaeróbicos descomponen la materia orgánica produciendo metano y dióxido de carbono junto con trazas de otros compuestos. [100] Independientemente del tipo de materia orgánica, la producción de gases sigue un patrón cinético bien definido . El dióxido de carbono constituye alrededor del 40-45% del gas que emana de la descomposición en los vertederos (denominado " gas de vertedero "). La mayor parte del 50-55% restante es metano. [101]
El dióxido de carbono se puede obtener por destilación del aire, pero el método es ineficiente. En la industria, el dióxido de carbono es predominantemente un producto de desecho no recuperado, producido por varios métodos que pueden practicarse en diversas escalas. [102]
La combustión de todos los combustibles basados en carbono , como el metano ( gas natural ), los destilados de petróleo ( gasolina , diésel , queroseno , propano ), el carbón, la madera y la materia orgánica en general, produce dióxido de carbono y, excepto en el caso del carbono puro, agua. Como ejemplo, la reacción química entre el metano y el oxígeno :
El hierro se reduce a partir de sus óxidos con coque en un alto horno , produciendo arrabio y dióxido de carbono: [103]
El dióxido de carbono es un subproducto de la producción industrial de hidrógeno mediante reformado con vapor y la reacción de desplazamiento del gas de agua en la producción de amoníaco . Estos procesos comienzan con la reacción del agua y el gas natural (principalmente metano). [104] Esta es una fuente importante de dióxido de carbono de calidad alimentaria para su uso en la carbonatación de cerveza y refrescos , y también se utiliza para aturdir animales como las aves de corral . En el verano de 2018, surgió una escasez de dióxido de carbono para estos fines en Europa debido al cierre temporal de varias plantas de amoníaco para su mantenimiento. [105]
Se produce por descomposición térmica de la piedra caliza, CaCO3 , mediante calentamiento ( calcinación ) a unos 850 °C (1.560 °F), en la fabricación de cal viva ( óxido de calcio , CaO), un compuesto que tiene muchos usos industriales:
Los ácidos liberan CO2 de la mayoría de los carbonatos metálicos, por lo que se puede obtener directamente de manantiales naturales de dióxido de carbono , donde se produce por la acción del agua acidificada sobre la piedra caliza o la dolomita . La reacción entre el ácido clorhídrico y el carbonato de calcio (piedra caliza o tiza) se muestra a continuación:
El ácido carbónico ( H2CO3 ) luego se descompone en agua y CO2 :
Estas reacciones van acompañadas de formación de espuma o burbujeo, o de ambos, a medida que se libera el gas. Tienen usos muy extendidos en la industria porque pueden utilizarse para neutralizar corrientes de ácidos residuales.
El dióxido de carbono se utiliza en la industria alimentaria, la industria petrolera y la industria química. [102] El compuesto tiene diversos usos comerciales, pero uno de sus mayores usos como químico es en la producción de bebidas carbonatadas; proporciona el brillo a las bebidas carbonatadas como el agua con gas, la cerveza y el vino espumoso.
En la industria química, el dióxido de carbono se consume principalmente como ingrediente en la producción de urea , y una fracción más pequeña se utiliza para producir metanol y una variedad de otros productos. [106] Algunos derivados del ácido carboxílico, como el salicilato de sodio, se preparan utilizando CO2 mediante la reacción de Kolbe-Schmitt . [107]
Además de los procesos convencionales que utilizan CO2 para la producción química, también se están explorando métodos electroquímicos a nivel de investigación. En particular, el uso de energía renovable para la producción de combustibles a partir de CO2 ( como el metanol) es atractivo, ya que podría dar lugar a combustibles que podrían transportarse y usarse fácilmente dentro de las tecnologías de combustión convencionales, pero que no tienen emisiones netas de CO2 . [ 108]
Las plantas necesitan dióxido de carbono para realizar la fotosíntesis. Las atmósferas de los invernaderos pueden (si son de gran tamaño, deben) enriquecerse con CO2 adicional para sostener y aumentar la tasa de crecimiento de las plantas. [109] [110] En concentraciones muy altas (100 veces la concentración atmosférica o más), el dióxido de carbono puede ser tóxico para la vida animal, por lo que aumentar la concentración a 10 000 ppm (1 %) o más durante varias horas eliminará plagas como moscas blancas y ácaros en un invernadero. [111] Algunas plantas responden más favorablemente al aumento de las concentraciones de dióxido de carbono que otras, lo que puede provocar cambios en el régimen de vegetación, como la invasión de plantas leñosas . [112]

El dióxido de carbono es un aditivo alimentario que se utiliza como propulsor y regulador de la acidez en la industria alimentaria. Su uso está aprobado en la UE [113] (con el número E E290), EE. UU. [114], Australia y Nueva Zelanda [115] (con el número INS 290).
Un caramelo llamado Pop Rocks se presuriza con gas de dióxido de carbono [116] a unos 4000 kPa (40 bar ; 580 psi ). Cuando se coloca en la boca, se disuelve (al igual que otros caramelos duros) y libera las burbujas de gas con un chasquido audible.
Los agentes leudantes hacen que la masa suba al producir dióxido de carbono. [117] La levadura de panadería produce dióxido de carbono mediante la fermentación de los azúcares dentro de la masa, mientras que los leudantes químicos como el polvo de hornear y el bicarbonato de sodio liberan dióxido de carbono cuando se calientan o si se exponen a ácidos .
El dióxido de carbono se utiliza para producir refrescos carbonatados y agua con gas . Tradicionalmente, la carbonatación de la cerveza y el vino espumoso se producía mediante la fermentación natural, pero muchos fabricantes carbonatan estas bebidas con dióxido de carbono recuperado del proceso de fermentación. En el caso de la cerveza embotellada y en barril, el método más común utilizado es la carbonatación con dióxido de carbono reciclado. Con la excepción de la cerveza real ale británica , la cerveza de barril suele transferirse desde los barriles en una cámara frigorífica o bodega a los grifos de dispensación en la barra utilizando dióxido de carbono presurizado, a veces mezclado con nitrógeno.
El sabor del agua con gas (y las sensaciones gustativas relacionadas con otras bebidas carbonatadas) es un efecto del dióxido de carbono disuelto, más que de las burbujas del gas que estallan. La anhidrasa carbónica 4 convierte el dióxido de carbono en ácido carbónico, lo que produce un sabor agrio , y el dióxido de carbono disuelto también induce una respuesta somatosensorial . [118]

El dióxido de carbono en forma de hielo seco se utiliza a menudo durante la fase de maceración en frío en la elaboración del vino para enfriar los racimos de uvas rápidamente después de la recolección y ayudar a prevenir la fermentación espontánea por levaduras silvestres . La principal ventaja de utilizar hielo seco en lugar de hielo de agua es que enfría las uvas sin añadir agua adicional que pueda reducir la concentración de azúcar en el mosto de uva y, por tanto, la concentración de alcohol en el vino terminado. El dióxido de carbono también se utiliza para crear un entorno hipóxico para la maceración carbónica , el proceso utilizado para producir vino Beaujolais .
El dióxido de carbono se utiliza a veces para rellenar las botellas de vino u otros recipientes de almacenamiento , como los barriles, para evitar la oxidación, aunque tiene el problema de que puede disolverse en el vino, lo que hace que un vino que antes estaba quieto tenga un ligero sabor burbujeante. Por este motivo, los enólogos profesionales prefieren otros gases, como el nitrógeno o el argón , para este proceso.
El dióxido de carbono se utiliza a menudo para "aturdir" a los animales antes del sacrificio. [119] "Aturdir" puede ser un nombre inapropiado, ya que los animales no quedan inconscientes inmediatamente y pueden sufrir angustia. [120] [121]
El dióxido de carbono es uno de los gases comprimidos más utilizados para sistemas neumáticos (gas presurizado) en herramientas de presión portátiles. El dióxido de carbono también se utiliza como atmósfera para soldar , aunque en el arco de soldadura reacciona para oxidar la mayoría de los metales. Su uso en la industria automotriz es común a pesar de la evidencia significativa de que las soldaduras hechas en dióxido de carbono son más frágiles que las hechas en atmósferas más inertes. [122] Cuando se usa para soldadura MIG , el uso de CO2 a veces se conoce como soldadura MAG, para Metal Active Gas, ya que el CO2 puede reaccionar a estas altas temperaturas. Tiende a producir un charco más caliente que las atmósferas verdaderamente inertes, mejorando las características de flujo. Aunque esto puede deberse a reacciones atmosféricas que ocurren en el sitio del charco. Esto suele ser lo opuesto al efecto deseado al soldar, ya que tiende a fragilizar el sitio, pero puede no ser un problema para la soldadura de acero dulce en general, donde la ductilidad final no es una preocupación importante.
El dióxido de carbono se utiliza en muchos productos de consumo que requieren gas presurizado porque es barato y no inflamable, y porque sufre una transición de fase de gas a líquido a temperatura ambiente a una presión alcanzable de aproximadamente 60 bar (870 psi ; 59 atm ), lo que permite que quepa mucho más dióxido de carbono en un recipiente determinado de lo que cabría de otra manera. Los chalecos salvavidas a menudo contienen botes de dióxido de carbono presurizado para un inflado rápido. Las cápsulas de aluminio de CO 2 también se venden como suministros de gas comprimido para pistolas de aire , marcadores/pistolas de paintball , inflado de neumáticos de bicicleta y para hacer agua carbonatada . También se pueden utilizar altas concentraciones de dióxido de carbono para matar plagas. El dióxido de carbono líquido se utiliza en el secado supercrítico de algunos productos alimenticios y materiales tecnológicos, en la preparación de muestras para microscopía electrónica de barrido [123] y en la descafeinización de granos de café .

El dióxido de carbono se puede utilizar para extinguir las llamas inundando el entorno alrededor de la llama con el gas. No reacciona por sí mismo para extinguir la llama, sino que la priva de oxígeno al desplazarla. Algunos extintores , especialmente los diseñados para incendios eléctricos , contienen dióxido de carbono líquido bajo presión. Los extintores de dióxido de carbono funcionan bien en pequeños incendios de líquidos inflamables y eléctricos, pero no en incendios de combustibles ordinarios, porque no enfrían significativamente las sustancias en llamas y, cuando el dióxido de carbono se dispersa, pueden incendiarse al exponerse al oxígeno atmosférico . Se utilizan principalmente en salas de servidores. [124]
El dióxido de carbono también se ha utilizado ampliamente como agente extintor en sistemas fijos de protección contra incendios para la aplicación local de peligros específicos y la inundación total de un espacio protegido. [125] Las normas de la Organización Marítima Internacional reconocen los sistemas de dióxido de carbono para la protección contra incendios de bodegas y salas de máquinas de los barcos. Los sistemas de protección contra incendios basados en dióxido de carbono se han relacionado con varias muertes, porque puede causar asfixia en concentraciones suficientemente altas. Una revisión de los sistemas de CO2 identificó 51 incidentes entre 1975 y la fecha del informe (2000), que causaron 72 muertes y 145 lesiones. [126]
El dióxido de carbono líquido es un buen disolvente para muchos compuestos orgánicos lipofílicos y se utiliza para descafeinar el café . [18] El dióxido de carbono ha atraído la atención en las industrias farmacéutica y de otros procesos químicos como una alternativa menos tóxica a los disolventes más tradicionales, como los organoclorados . También lo utilizan algunas tintorerías por este motivo. Se utiliza en la preparación de algunos aerogeles debido a las propiedades del dióxido de carbono supercrítico.
En medicina, se añade hasta un 5% de dióxido de carbono (130 veces la concentración atmosférica) al oxígeno para estimular la respiración después de la apnea y para estabilizar el equilibrio O 2 /CO 2 en la sangre.
El dióxido de carbono se puede mezclar con hasta un 50% de oxígeno, formando un gas inhalable; esto se conoce como carbógeno y tiene una variedad de usos médicos y de investigación.
Otro uso medicinal son las mofettes , balnearios secos que utilizan el dióxido de carbono procedente de descargas post-volcánicas con fines terapéuticos.
El CO2 supercrítico se utiliza como fluido de trabajo en el motor de ciclo de potencia de Allam .
El dióxido de carbono se utiliza en la recuperación mejorada de petróleo , donde se inyecta en pozos de petróleo en producción o adyacentes a ellos, generalmente en condiciones supercríticas , cuando se vuelve miscible con el petróleo. Este enfoque puede aumentar la recuperación original de petróleo al reducir la saturación de petróleo residual en un 7-23% adicional a la extracción primaria . [127] Actúa como agente presurizador y, cuando se disuelve en el petróleo crudo subterráneo , reduce significativamente su viscosidad y cambia la química de la superficie permitiendo que el petróleo fluya más rápidamente a través del yacimiento hasta el pozo de extracción. [128] En los campos petrolíferos maduros, se utilizan extensas redes de tuberías para llevar el dióxido de carbono a los puntos de inyección.
En la recuperación mejorada de metano de lechos de carbón , se bombearía dióxido de carbono a la veta de carbón para desplazar el metano, a diferencia de los métodos actuales que se basan principalmente en la eliminación de agua (para reducir la presión) para hacer que la veta de carbón libere el metano atrapado. [129]
Se ha propuesto que el CO2 generado por la generación de energía se inyecte en estanques para estimular el crecimiento de algas que luego podrían convertirse en combustible biodiésel . [130] Una cepa de la cianobacteria Synechococcus elongatus ha sido modificada genéticamente para producir los combustibles isobutiraldehído e isobutanol a partir de CO2 mediante la fotosíntesis. [131]
Los investigadores han desarrollado una técnica electrocatalítica que utiliza enzimas aisladas de bacterias para impulsar las reacciones químicas que convierten el CO2 en combustibles. [132] [133] [134]
El dióxido de carbono líquido y sólido son refrigerantes importantes , especialmente en la industria alimentaria, donde se emplean durante el transporte y almacenamiento de helados y otros alimentos congelados. El dióxido de carbono sólido se denomina "hielo seco" y se utiliza para envíos pequeños en los que no es posible utilizar equipos de refrigeración. El dióxido de carbono sólido siempre está por debajo de los -78,5 °C (-109,3 °F) a presión atmosférica normal, independientemente de la temperatura del aire.
El dióxido de carbono líquido (nomenclatura industrial R744 o R-744) se utilizó como refrigerante antes del uso de diclorodifluorometano (R12, un compuesto de clorofluorocarbono (CFC)). [135] El CO 2 podría disfrutar de un renacimiento porque uno de los principales sustitutos de los CFC, el 1,1,1,2-tetrafluoroetano ( R134a , un compuesto de hidrofluorocarbono (HFC)) contribuye al cambio climático más que el CO 2. Las propiedades físicas del CO 2 son muy favorables para fines de refrigeración, enfriamiento y calefacción, ya que tiene una alta capacidad de enfriamiento volumétrico. Debido a la necesidad de operar a presiones de hasta 130 bares (1900 psi; 13 000 kPa), los sistemas de CO 2 requieren depósitos y componentes altamente resistentes mecánicamente que ya se han desarrollado para la producción en masa en muchos sectores. En el aire acondicionado de los automóviles, en más del 90% de las condiciones de conducción para latitudes superiores a 50°, el CO2 ( R744) funciona de manera más eficiente que los sistemas que utilizan HFC (por ejemplo, R134a). Sus ventajas medioambientales ( GWP de 1, no daña la capa de ozono, no es tóxico, no es inflamable) podrían convertirlo en el futuro fluido de trabajo que sustituya a los HFC actuales en automóviles, supermercados y calentadores de agua con bomba de calor, entre otros. Coca-Cola ha presentado enfriadores de bebidas a base de CO2 y el ejército de los EE. UU. está interesado en la tecnología de refrigeración y calefacción con CO2. [ 136] [137]

El dióxido de carbono es el medio láser en un láser de dióxido de carbono , que es uno de los primeros tipos de láser.
El dióxido de carbono se puede utilizar como un medio para controlar el pH de las piscinas, [138] añadiendo continuamente gas al agua, evitando así que el pH suba. Entre las ventajas de esto está la de evitar la manipulación de ácidos (más peligrosos). De manera similar, también se utiliza en el mantenimiento de acuarios de arrecife , donde se utiliza comúnmente en reactores de calcio para reducir temporalmente el pH del agua que se pasa sobre carbonato de calcio con el fin de permitir que este se disuelva en el agua más libremente, donde algunos corales lo utilizan para construir su esqueleto.
Se utiliza como refrigerante principal en el reactor británico avanzado refrigerado por gas para la generación de energía nuclear.
Carbon dioxide induction is commonly used for the euthanasia of laboratory research animals. Methods to administer CO2 include placing animals directly into a closed, prefilled chamber containing CO2, or exposure to a gradually increasing concentration of CO2. The American Veterinary Medical Association's 2020 guidelines for carbon dioxide induction state that a displacement rate of 30–70% of the chamber or cage volume per minute is optimal for the humane euthanasia of small rodents.[139]: 5, 31 Percentages of CO2 vary for different species, based on identified optimal percentages to minimize distress.[139]: 22
Carbon dioxide is also used in several related cleaning and surface-preparation techniques.

Carbon dioxide was the first gas to be described as a discrete substance. In about 1640,[140] the Flemish chemist Jan Baptist van Helmont observed that when he burned charcoal in a closed vessel, the mass of the resulting ash was much less than that of the original charcoal. His interpretation was that the rest of the charcoal had been transmuted into an invisible substance he termed a "gas" (from Greek "chaos") or "wild spirit" (spiritus sylvestris).[141]
The properties of carbon dioxide were further studied in the 1750s by the Scottish physician Joseph Black. He found that limestone (calcium carbonate) could be heated or treated with acids to yield a gas he called "fixed air". He observed that the fixed air was denser than air and supported neither flame nor animal life. Black also found that when bubbled through limewater (a saturated aqueous solution of calcium hydroxide), it would precipitate calcium carbonate. He used this phenomenon to illustrate that carbon dioxide is produced by animal respiration and microbial fermentation. In 1772, English chemist Joseph Priestley published a paper entitled Impregnating Water with Fixed Air in which he described a process of dripping sulfuric acid (or oil of vitriol as Priestley knew it) on chalk in order to produce carbon dioxide, and forcing the gas to dissolve by agitating a bowl of water in contact with the gas.[142]
Carbon dioxide was first liquefied (at elevated pressures) in 1823 by Humphry Davy and Michael Faraday.[143] The earliest description of solid carbon dioxide (dry ice) was given by the French inventor Adrien-Jean-Pierre Thilorier, who in 1835 opened a pressurized container of liquid carbon dioxide, only to find that the cooling produced by the rapid evaporation of the liquid yielded a "snow" of solid CO2.[144][145]
Carbon dioxide in combination with nitrogen was known from earlier times as Blackdamp, stythe or choke damp.[b] Along with the other types of damp it was encountered in mining operations and well sinking. Slow oxidation of coal and biological processes replaced the oxygen to create a suffocating mixture of nitrogen and carbon dioxide.[146]
(Rubisco) is the most prevalent enzyme on this planet, accounting for 30–50% of total soluble protein in the chloroplast
{{cite report}}: CS1 maint: unfit URL (link){{cite report}}: CS1 maint: unfit URL (link)The victims were connected to Instagram influencer Yekaterina Didenko.
Figure 1f
{{cite book}}: |website= ignored (help)