El ciclohexano-1,2,3,4,5,6-hexol es una familia de compuestos químicos con fórmula C 6 H 12 O 6 , cuya molécula consiste en un anillo de seis átomos de carbono , cada uno unido a un átomo de hidrógeno y un grupo hidroxilo (–OH). Hay nueve estereoisómeros , que se diferencian por la posición de los grupos hidroxilo con respecto al plano medio del anillo. Todos estos compuestos a veces se denominan inositol , aunque este nombre (especialmente en bioquímica y ciencias relacionadas) se refiere con mayor frecuencia a un isómero particular, el mio -inositol , que tiene muchas funciones fisiológicas importantes y usos médicos.
Estos compuestos se clasifican como azúcares , específicamente azúcares carbocíclicos o alcoholes de azúcar , para distinguirlos de las aldosas más comunes como la glucosa . Generalmente tienen un sabor dulce. [2]
Estos compuestos forman varios ésteres con importancia bioquímica e industrial, como el ácido fítico y el fosfato de fosfatidilinositol .
Los nueve estereoisómeros del ciclohexano-1,2,3,4,5,6-hexol se distinguen por los prefijos: myo - , scyllo -, muco -, D - chiro -, L - chiro -, neo - , allo -, epi - y cis -inositol .
Como indican sus nombres, el L- y el D - quiroinositol son enantiómeros quirales ( formas de imagen especular). Todos los demás son compuestos meso (indistinguibles de sus formas especulares). [3]
La designación rac - chiro -inositol se ha utilizado para la mezcla racémica (racemato) de partes iguales de los dos isómeros quiro . Cristaliza como una sola fase, en lugar de cristales D y L separados, que se funde a 250 °C (que es 4-5 °C más alto que el punto de fusión de los enantiómeros puros) y se descompone entre 308 y 344 °C. La estructura cristalina es monoclínica con el grupo . Los parámetros de la celda cristalina son a = 1014,35 pm , b = 815,42 pm, c = 862,39 pm, β = 92,3556 ° , Z = 4. El volumen de la celda es 0,71270 nm 3 , o aproximadamente 0,178 nm 3 por molécula (que es un poco más pequeño que los volúmenes típicos de otros isómeros). [4]
Al igual que en el ciclohexano , el anillo C6 de estos compuestos puede tener dos conformaciones , "barco" y "silla". La estabilidad relativa de las dos formas varía con el isómero, generalmente favoreciendo la conformación donde los hidroxilos están más alejados entre sí. [5]
Algunos de los estereoisómeros cristalizan en más de un polimorfo , con diferentes densidades y puntos de fusión, que varían desde 225 °C para el mio -inositol hasta aproximadamente 360 °C para el polimorfo "B" del escilo -inositol. [4] Existe una clara correlación entre los puntos de fusión y el número y tipo de cadenas de hidroxilos unidos por enlaces de hidrógeno. [6]
Todos los isómeros excepto allo- y cis- se encuentran en la naturaleza, aunque el mioinositol es sustancialmente más abundante e importante que los demás. [7] [8]
En los seres humanos, el mioinositol se sintetiza principalmente en los riñones , a partir de glucosa 6-fosfato . [9] Luego, pequeñas cantidades de mioinositol son convertidas por una epimerasa específica en D - quiroinositol , [10] que es una molécula mensajera importante en la señalización de la insulina. [11]
Un estudio de 2020 encontró cantidades detectables de epi -, neo -, chiro -, scyllo - y myo -inositol en la orina de mujeres, embarazadas o no. Las concentraciones de myo y scyllo aumentaron significativamente en el tercer trimestre del embarazo, y scyllo varió entre el 20% y el 40% de myo . Las concentraciones de epi , neo y chiro siempre fueron un pequeño porcentaje de las de myo , excepto que chiro - alcanzó el 20% de myo en el segundo trimestre del embarazo. [8]
La bacteria Bacillus subtilis puede metabolizar mio- , escilo- y D- quiro -inositol y convertir hacia y desde estos tres isómeros. [12]
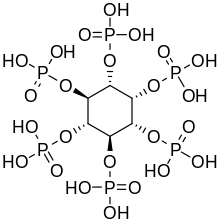
Las plantas sintetizan hexakis- dihidrogenofosfato de inositol , también llamado ácido fítico o IP6, como almacenamiento de fósforo [13]. El penta- (IP5), tetra- (IP4) y trifosfato (IP3) de inositol también se denominan "fitatos".
{{cite web}}: CS1 maint: URL no apta ( enlace )