
En biología molecular , la agregación de proteínas es un fenómeno en el que las proteínas intrínsecamente desordenadas o mal plegadas se agregan (es decir, se acumulan y se agrupan) ya sea intra o extracelularmente. [1] [2] Los agregados de proteínas se han visto implicados en una amplia variedad de enfermedades conocidas como amiloidosis , incluidas la ELA , el Alzheimer , el Parkinson y la enfermedad priónica . [3] [4]
Después de la síntesis, las proteínas normalmente se pliegan en una conformación tridimensional particular que es la más favorable termodinámicamente : su estado nativo . [5] Este proceso de plegado es impulsado por el efecto hidrofóbico : una tendencia de las partes hidrofóbicas (que temen al agua) de la proteína a protegerse del entorno hidrofílico (que ama el agua) de la célula enterrándose en el interior de la proteína. Por lo tanto, el exterior de una proteína es típicamente hidrofílico, mientras que el interior es típicamente hidrofóbico.
Las estructuras de las proteínas se estabilizan mediante interacciones no covalentes y enlaces disulfuro entre dos residuos de cisteína . Las interacciones no covalentes incluyen interacciones iónicas e interacciones débiles de van der Waals . Las interacciones iónicas se forman entre un anión y un catión y forman puentes salinos que ayudan a estabilizar la proteína. Las interacciones de van der Waals incluyen interacciones no polares (es decir, fuerza de dispersión de London ) e interacciones polares (es decir, enlaces de hidrógeno , enlace dipolo-dipolo ). Estas juegan un papel importante en la estructura secundaria de una proteína , como la formación de una hélice alfa o una lámina beta , y la estructura terciaria. Las interacciones entre los residuos de aminoácidos en una proteína específica son muy importantes en la estructura final de esa proteína.
Cuando hay cambios en las interacciones no covalentes, como puede suceder con un cambio en la secuencia de aminoácidos, la proteína es susceptible a plegarse o desplegarse incorrectamente. En estos casos, si la célula no ayuda a la proteína a plegarse nuevamente, o degrada la proteína desplegada, la proteína desplegada o mal plegada puede agregarse, en la que las porciones hidrofóbicas expuestas de la proteína pueden interactuar con las partes hidrofóbicas expuestas de otras proteínas. [6] [7] Hay tres tipos principales de agregados proteicos que pueden formarse: agregados amorfos, oligómeros y fibrillas amiloides . [8]
La agregación de proteínas puede producirse por diversas causas. Existen cuatro clases en las que se pueden clasificar estas causas, que se detallan a continuación.
Las mutaciones que se producen en la secuencia de ADN pueden afectar o no a la secuencia de aminoácidos de la proteína. Cuando la secuencia se ve afectada, un aminoácido diferente puede cambiar las interacciones entre las cadenas laterales que afectan el plegamiento de la proteína. Esto puede dar lugar a que las regiones hidrofóbicas de la proteína queden expuestas y se agrupen con la misma proteína mal plegada o desplegada o con una proteína diferente. [9]
Además de las mutaciones en las propias proteínas afectadas, la agregación de proteínas también podría ser causada indirectamente a través de mutaciones en proteínas en vías reguladoras como la vía de replegamiento ( chaperonas moleculares ) o la vía ubiquitina-proteasoma (ubiquitina ligasas). [10] Las chaperonas ayudan con el replegamiento de proteínas al proporcionar un entorno seguro para que la proteína se pliegue. Las ubiquitina ligasas se dirigen a las proteínas para su degradación a través de la modificación de la ubiquitina. [11]
La agregación de proteínas puede ser causada por problemas que ocurren durante la transcripción o la traducción . Durante la transcripción, el ADN se copia en ARNm, formando una cadena de pre-ARNm que se somete a un procesamiento de ARN para formar ARNm. [12] Durante la traducción, los ribosomas y el ARNt ayudan a traducir la secuencia de ARNm en una secuencia de aminoácidos. [12] Si surgen problemas durante cualquiera de los pasos, generando una cadena de ARNm incorrecta y/o una secuencia de aminoácidos incorrecta, esto puede hacer que la proteína se pliegue incorrectamente, lo que lleva a la agregación de proteínas. [ cita requerida ]
El estrés ambiental, como las temperaturas y el pH extremos, o el estrés oxidativo , también pueden provocar la agregación de proteínas. [13] Una de estas enfermedades es la crioglobulinemia .
Las temperaturas extremas pueden debilitar y desestabilizar las interacciones no covalentes entre los residuos de aminoácidos. Los valores de pH fuera del rango de pH de la proteína pueden cambiar el estado de protonación de los aminoácidos, lo que puede aumentar o disminuir las interacciones no covalentes. Esto también puede provocar interacciones menos estables y provocar el desdoblamiento de la proteína.
El estrés oxidativo puede ser causado por radicales como las especies reactivas de oxígeno (ROS). Estos radicales inestables pueden atacar los residuos de aminoácidos, lo que lleva a la oxidación de las cadenas laterales (por ejemplo, cadenas laterales aromáticas , cadenas laterales de metionina ) y/o la ruptura de los enlaces polipeptídicos. [14] Esto puede afectar las interacciones no covalentes que mantienen unida correctamente a la proteína, lo que puede causar la desestabilización de la proteína y puede hacer que la proteína se despliegue. [13]
Las células tienen mecanismos que pueden replegar o degradar los agregados proteicos. Sin embargo, a medida que las células envejecen, estos mecanismos de control se debilitan y la célula tiene menos capacidad para resolver los agregados. [13]
La hipótesis de que la agregación de proteínas es un proceso causal del envejecimiento es comprobable ahora, ya que se dispone de algunos modelos de envejecimiento retardado. Si el desarrollo de agregados de proteínas fuera un proceso independiente del envejecimiento, ralentizar el envejecimiento no mostraría ningún efecto sobre la tasa de proteotoxicidad a lo largo del tiempo. Sin embargo, si el envejecimiento está asociado con una disminución de la actividad de los mecanismos de protección contra la proteotoxicidad, los modelos de envejecimiento lento mostrarían una agregación y proteotoxicidad reducidas. Para abordar este problema, se han realizado varios ensayos de toxicidad en C. elegans . Estos estudios indicaron que la reducción de la actividad de la señalización de insulina/IGF (IIS), una importante vía reguladora del envejecimiento, protege de la agregación de proteínas tóxicas vinculada a la neurodegeneración. La validez de este enfoque se ha probado y confirmado en mamíferos, ya que la reducción de la actividad de la vía de señalización de IGF-1 protegió a los ratones modelo de Alzheimer de los deterioros conductuales y bioquímicos asociados con la enfermedad. [15]
Varios estudios han demostrado que las respuestas celulares a la agregación de proteínas están bien reguladas y organizadas. Los agregados de proteínas se localizan en áreas específicas de la célula, y se han realizado investigaciones sobre estas localizaciones en procariotas (E. coli) y eucariotas (levaduras, células de mamíferos). [16] Desde el punto de vista macroscópico, los trazadores de tomografía por emisión de positrones se utilizan para ciertas proteínas mal plegadas. [17] Recientemente, un equipo de investigadores dirigido por el Dr. Alessandro Crimi ha propuesto un método de aprendizaje automático para predecir la deposición futura en el cerebro. [18]
Los agregados de las bacterias terminan asimétricamente en uno de los polos de la célula, el "polo más viejo". Después de que la célula se divide, las células hijas con el polo más viejo obtienen el agregado de proteínas y crecen más lentamente que las células hijas sin el agregado. Esto proporciona un mecanismo de selección natural para reducir los agregados de proteínas en la población bacteriana. [19]
La mayoría de los agregados de proteínas en las células de levadura se repliegan por chaperonas moleculares. Sin embargo, algunos agregados, como las proteínas dañadas por oxidación o las proteínas marcadas para degradación, no se pueden replegar. En cambio, hay dos compartimentos en los que pueden terminar. Los agregados de proteínas pueden localizarse en el compartimento de control de calidad yuxtanuclear ( JUNQ ), que está cerca de la membrana nuclear, o en el depósito de proteína insoluble ( IPOD ), cerca de la vacuola en las células de levadura. [13] Los agregados de proteínas se localizan en JUNQ cuando están ubiquitinados y dirigidos a la degradación. Las proteínas agregadas e insolubles se localizan en IPOD como un depósito más permanente. Hay evidencia de que las proteínas aquí pueden eliminarse por autofagia. [20] Estas dos vías trabajan juntas en el sentido de que las proteínas tienden a llegar al IPOD cuando la vía del proteasoma está sobrecargada. [20]
En las células de los mamíferos, estos agregados de proteínas se denominan "agresomas" y se forman cuando la célula está enferma. Esto se debe a que los agregados tienden a formarse cuando hay proteínas heterólogas presentes en la célula, lo que puede surgir cuando la célula está mutada. Diferentes mutaciones de la misma proteína pueden formar agresomas de diferentes morfologías, que van desde la dispersión difusa de especies solubles hasta grandes puntos, que a su vez tienen diferente patogenicidad. [21] La ligasa de ubiquitina E3 es capaz de reconocer proteínas mal plegadas y ubiquinarlas. HDAC6 puede entonces unirse a la ubiquitina y a la proteína motora dineína para llevar los agregados marcados al centro organizador de microtúbulos ( MTOC ). Allí, se empaquetan juntos en una esfera que rodea el MTOC. Traen chaperonas y proteosomas y activan la autofagia. [22]
Existen dos sistemas principales de control de calidad de proteínas en la célula que son responsables de eliminar los agregados de proteínas. Las proteínas mal plegadas pueden ser plegadas nuevamente por el sistema de bichaperona o degradadas por el sistema de ubiquitina proteosomal o por autofagia. [23]
El sistema de bi-chaperona utiliza las chaperonas Hsp70 (DnaK-DnaJ-GrpE en E. coli y Ssa1-Ydj1/Sis1-Sse1/Fe1 en levadura) y Hsp100 (ClpB en E. coli y Hsp104 en levadura) para la desagregación y el plegamiento de proteínas. [24]
La Hsp70 interactúa con los agregados proteicos y recluta a la Hsp100. La Hsp70 estabiliza a la Hsp100 activada. Las proteínas Hsp100 tienen bucles de poros aromáticos que se utilizan para la actividad de enhebrado para desenredar polipéptidos individuales. Esta actividad de enhebrado puede iniciarse en el extremo N, el extremo C o en el medio del polipéptido. El polipéptido se transloca a través de la Hsp100 en una serie de pasos, utilizando un ATP en cada paso. [24] El polipéptido se desdobla y luego se le permite volver a plegarse por sí solo o con la ayuda de proteínas de choque térmico. [25]
Las proteínas mal plegadas pueden eliminarse a través del sistema ubiquitina-proteasoma ( UPS ). Este consiste en una vía E1-E2-E3 que ubiquina las proteínas para marcarlas para su degradación. En eucariotas, las proteínas son degradadas por el proteasoma 26S. En células de mamíferos, la ligasa E3, proteína carboxi-terminal que interactúa con Hsp70 (CHIP), se dirige a las proteínas unidas a Hsp70. En levadura, las ligasas E3 Doa10 y Hrd1 tienen funciones similares en las proteínas del retículo endoplasmático . [26] A nivel molecular, la tasa de degradación de los agregados varía de proteína a proteína debido a sus diferentes entornos internos y, por lo tanto, a la diferente accesibilidad para las moléculas de proteasa. [27]

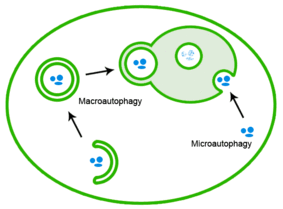
Las proteínas mal plegadas también pueden eliminarse mediante autofagia, en la que los agregados de proteínas se envían al lisosoma. [26]
Aunque se ha pensado que los agregados proteicos maduros son tóxicos por sí mismos, la evidencia sugiere que, de hecho, son los agregados proteicos inmaduros los más tóxicos. [28] [29] Los parches hidrofóbicos de estos agregados pueden interactuar con otros componentes de la célula y dañarlos. Las hipótesis son que la toxicidad de los agregados proteicos está relacionada con mecanismos de secuestro de componentes celulares, la generación de especies reactivas de oxígeno y la unión a receptores específicos en la membrana o mediante la disrupción de membranas. [30] Se ha utilizado un ensayo cuantitativo para determinar que las especies de mayor peso molecular son responsables de la permeación de la membrana. [31] Se sabe que los agregados proteicos in vitro pueden desestabilizar las bicapas artificiales de fosfolípidos , lo que lleva a la permeabilización de la membrana. [ cita requerida ]
La agregación de proteínas también es un fenómeno común en el proceso de fabricación biofarmacéutica, que puede suponer riesgos para los pacientes al generar respuestas inmunes adversas. [32]