
En electroquímica , la cronoamperometría es una técnica analítica en la que se escalona el potencial eléctrico del electrodo de trabajo y se monitorea la corriente resultante de los procesos faradaicos que ocurren en el electrodo (causados por el escalón de potencial) en función del tiempo. La relación funcional entre la respuesta de la corriente y el tiempo se mide después de aplicar un escalón de potencial simple o doble al electrodo de trabajo del sistema electroquímico. Se puede obtener información limitada sobre la identidad de las especies electrolizadas a partir de la relación entre la corriente de oxidación máxima y la corriente de reducción máxima . Sin embargo, como ocurre con todas las técnicas pulsadas, la cronoamperometría genera corrientes de carga altas, que decaen exponencialmente con el tiempo como cualquier circuito RC . La corriente faradaica , que se debe a eventos de transferencia de electrones y es con mayor frecuencia el componente de corriente de interés, decae como se describe en la ecuación de Cottrell . En la mayoría de las celdas electroquímicas , esta decaimiento es mucho más lenta que el decaimiento de la carga; las celdas sin electrolito de soporte son excepciones notables. Lo más común es utilizar un sistema de tres electrodos . Dado que la corriente se integra en intervalos de tiempo relativamente más largos, la cronoamperometría proporciona una mejor relación señal-ruido en comparación con otras técnicas amperométricas.

[1] [2] [3]
Existen dos tipos de cronoamperometría que se utilizan habitualmente: la cronoamperometría de potencial controlado y la cronoamperometría de corriente controlada . Antes de realizar la cronoamperometría de potencial controlado, se realizan voltamperometrías cíclicas para determinar el potencial de reducción de los analitos . En general, la cronoamperometría utiliza electrodos de área fija, que son adecuados para estudiar los procesos de electrodos de reacciones químicas acopladas, especialmente el mecanismo de reacción de la electroquímica orgánica. [4]
El antraceno en dimetilformamida desoxigenada (DMF) se reducirá (An + e − -> An − ) en la superficie del electrodo que se encuentra a un determinado potencial negativo . La reducción estará limitada por la difusión , lo que hará que la corriente disminuya con el tiempo (proporcionalmente al gradiente de difusión que se forma por difusión).
Puedes realizar este experimento varias veces aumentando los potenciales de los electrodos de bajo a alto. (Entre los experimentos, debes agitar la solución). Cuando mides la corriente i(t) en un punto de tiempo fijo τ después de aplicar el voltaje, verás que en un momento determinado la corriente i(τ) ya no aumenta; has alcanzado la región limitada por la transferencia de masa. Esto significa que el antraceno llega tan rápido como la difusión puede llevarlo al electrodo.
En 1902, FG Cottrell dedujo la difusión lineal en un electrodo plano según la ley de difusión y la transformada de Laplace , y obtuvo la ecuación de Cottrell :
dónde
En circunstancias de difusión controlada, el gráfico de corriente-tiempo refleja el gradiente de concentración de la solución cerca de la superficie del electrodo. La corriente es directamente proporcional a la concentración en la superficie del electrodo.
En 1922, Jaroslav Heyrovský reiteró el método cronoamperométrico cuando inventó el método polarográfico. Puede utilizar el circuito básico del polarógrafo . Para conectar el registrador rápido o el osciloscopio , no se utiliza el electrodo de goteo de mercurio , en su lugar, se utilizan los electrodos estáticos como el mercurio suspendido, el mercurio de polo o el platino , el oro y el grafito . Además, la solución no se agita. En presencia de los electrolitos inertes, el proceso de transferencia de masa es principalmente difusión. [5] Jarroslav Herovsky derivó el método cronopotenciométrico de la ecuación de Cottrell. La cronopotenciometría [6] es un método electroquímico que puede generar una corriente estable que puede fluir entre dos electrodos diferentes. [7]

Una de las aplicaciones de la cronoamperometría es la electrólisis de potencial controlado (en masa), que también se conoce como coulometría potenciostática. Durante este proceso, se aplica un potencial constante al electrodo de trabajo y se controla la corriente a lo largo del tiempo. El analito en un estado de oxidación se oxidará o reducirá a otro estado de oxidación. La corriente disminuirá hasta la línea base (acercándose a cero) a medida que se consume el analito. Este proceso muestra la carga total (en culombios) que fluye en la reacción. La carga total (valor n) se calcula mediante la integración del área bajo el gráfico de corriente y la aplicación de la ley de Faraday.
La celda para la electrólisis a potencial controlado (en masa) suele ser una celda de dos compartimentos (dividida), que contiene un ánodo auxiliar de varilla de carbono y está separada del compartimento del cátodo por un tapón electrolítico de frita de vidrio grueso y disolvente de metilcelulosa. [8] La razón de la celda de dos compartimentos es separar la reacción catódica y anódica. El electrodo de trabajo para la electrólisis en masa podría ser un disco RVC, que tiene una superficie más grande para aumentar la velocidad de la reacción. [9]
La electrólisis de potencial controlado se utiliza normalmente con voltamperometría cíclica. La voltamperometría cíclica es capaz de analizar el comportamiento electroquímico del analito o de la reacción. Por ejemplo, la voltamperometría cíclica podría indicarnos el potencial catódico de un analito. Dado que se obtiene el potencial catódico de este analito, la electrólisis de potencial controlado podría mantener este potencial constante para que se produzca la reacción. [10] [11]

La cronoamperometría de doble paso de potencial (DPSCA) es la técnica cuyo electrodo de trabajo se aplica mediante el paso de potencial hacia adelante durante un período de tiempo determinado y hacia atrás durante un período de tiempo. La corriente se monitorea y se grafica con respecto al tiempo. Este método comienza con un período de inducción. En este período, se aplicarán varias condiciones iniciales a la celda electroquímica para que la celda pueda equilibrarse con esas condiciones. [12] El potencial del electrodo de trabajo se mantendrá en el potencial inicial bajo estas condiciones durante un período específico (es decir, generalmente 3 segundos). Cuando finaliza el período de inducción, las celdas de trabajo cambian a otro potencial durante una cierta cantidad de tiempo. Después de que se completa el primer paso, el potencial del electrodo de trabajo retrocede, generalmente al potencial anterior al paso hacia adelante. [13] [14] Todo el experimento termina con un período de relajación. En este período, la condición predeterminada implica mantener el potencial del electrodo de trabajo del estado inicial durante aproximadamente otro segundo. [15] [16] Cuando finaliza el período de relajación, se aplican a la celda las condiciones de reposo posteriores al experimento para que el instrumento pueda volver al estado de reposo1. Después de representar gráficamente la corriente en función del tiempo, se genera un cronoamperograma que también se puede utilizar para generar gráficos de Cottrell. [17]
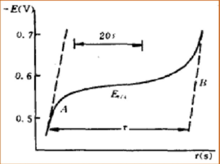
La aplicación de la cronopotenciometría se puede dividir en dos partes. Como método analítico, el rango de análisis normalmente está en el rango de 10 −4 mol/L a 10 −2 mol/L, y a veces será tan preciso como 10 −5 mol/L. Cuando el análisis está en el rango extremadamente bajo de concentración, se puede utilizar una densidad de corriente más baja. Además, para obtener una determinación precisa de la concentración, se puede extender el tiempo de transición. En esta área de determinación del análisis, la cronopotenciometría es similar a la polarografía . Las ondas que son separables en la polarografía también lo son en la cronopotenciometría.
La cronopotenciometría es un método eficaz para estudiar el mecanismo de los electrodos. Diferentes electrodos tendrán diferentes relaciones entre E y t en el gráfico de cronopotenciometría. En esta situación, E es el potencial del electrodo en voltaje y t es el tiempo de reacción en segundos. Mediante el método de estudiar la relación entre E y t en el gráfico de cronopotenciometría, podemos obtener la información de los mecanismos de las reacciones de los electrodos, como la reacción del electrodo del peróxido de hidrógeno y el ácido oxálico . El experimento de cronopotenciometría se puede realizar en un período de tiempo muy corto, por lo que es un buen método para estudiar el comportamiento de adsorción en la superficie del electrodo. Al estudiar el gráfico de cronopotenciometría del electrodo después de la adsorción de iones de hierro , se demuestra que existe la adsorción de platino sobre iones de hierro. Al estudiar el gráfico de cronopotenciometría del electrodo de platino que adsorbe yodo , se demuestra que la adsorción de yodo ocurre en forma de moléculas de yodo, no de átomos de yodo.
La cronoculometría es un método analítico que tiene un principio similar al de la cronoamperometría, pero que monitorea la relación entre la carga y el tiempo en lugar de la corriente y el tiempo. La cronoculometría tiene las siguientes diferencias con la cronoamperometría: la señal aumenta con el tiempo en lugar de disminuir; el acto de integración minimiza el ruido, lo que da como resultado una curva de respuesta hiperbólica suave; y las contribuciones de la carga de doble capa y las especies absorbidas se observan fácilmente.
{{cite journal}}: Falta o está vacío |title=( ayuda ){{cite journal}}: Falta o está vacío |title=( ayuda )