
En electrofisiología , el término "gating" se refiere a la apertura ( activación ) o cierre (por desactivación o inactivación) de los canales iónicos . [1] Este cambio en la conformación es una respuesta a los cambios en el voltaje transmembrana. [2]
Cuando los canales iónicos están en un estado "cerrado" (no conductor), son impermeables a los iones y no conducen corriente eléctrica. Cuando los canales iónicos están en su estado abierto, conducen la corriente eléctrica al permitir que tipos específicos de iones pasen a través de ellos y, por lo tanto, a través de la membrana plasmática de la célula . La activación es el proceso por el cual un canal iónico pasa de su estado abierto a su estado cerrado. [3]
Una variedad de cambios celulares pueden desencadenar la activación, dependiendo del canal iónico, incluidos los cambios en el voltaje a través de la membrana celular ( canales iónicos activados por voltaje ), las sustancias químicas que interactúan con el canal iónico ( canales iónicos activados por ligando ), los cambios de temperatura, [4] el estiramiento o la deformación de la membrana celular, la adición de un grupo fosfato al canal iónico ( fosforilación ) y la interacción con otras moléculas en la célula (por ejemplo, proteínas G ). [5] La velocidad a la que ocurre cualquiera de estos procesos de activación en respuesta a estos desencadenantes se conoce como cinética de activación. Algunos fármacos y muchas toxinas de los canales iónicos actúan como "modificadores de la activación" de los canales iónicos activados por voltaje al cambiar la cinética de la activación. [6]
Los canales iónicos dependientes del voltaje del potencial de acción se describen a menudo como que tienen cuatro procesos de activación: activación, desactivación, inactivación y reactivación (también llamado "recuperación de la inactivación"). La activación es el proceso de apertura de la compuerta de activación, que ocurre en respuesta a que el voltaje dentro de la membrana celular (el potencial de membrana ) se vuelve más positivo con respecto al exterior de la célula ( despolarización ), y la "desactivación" es el proceso opuesto al cierre de la compuerta de activación en respuesta a que el interior de la membrana se vuelve más negativo (repolarización). La "inactivación" es el cierre de la compuerta de inactivación y ocurre en respuesta a que el voltaje dentro de la membrana se vuelve más positivo, pero más lentamente que la activación. La "reactivación" es lo opuesto a la inactivación y es el proceso de reapertura de la compuerta de inactivación. [7]
Estos cambios de función dependientes del voltaje son críticos para una gran cantidad de procesos en células excitables y no excitables. [2]
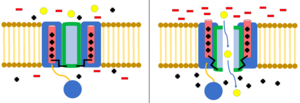
Los canales iónicos dependientes de voltaje se abren y se cierran en respuesta al potencial eléctrico a través de la membrana celular. Porciones del dominio del canal actúan como sensores de voltaje. A medida que cambia el potencial de membrana, esto da como resultado cambios en las fuerzas electrostáticas , moviendo estos dominios de detección de voltaje. Esto cambia la conformación de otros elementos del canal a la posición abierta o cerrada. [8] Cuando se mueven de la posición cerrada a la posición abierta, esto se llama "activación". Los canales iónicos dependientes de voltaje subyacen a muchos de los comportamientos eléctricos de la célula, incluidos los potenciales de acción, los potenciales de membrana en reposo y la transmisión sináptica. [9]
Los canales iónicos regulados por voltaje suelen ser específicos de iones como Na + , K + , Ca2 + y Cl− . Cada uno de estos iones desempeña un papel importante en el comportamiento eléctrico de la célula. [9] Las compuertas también tienen propiedades únicas con importantes implicaciones fisiológicas. Por ejemplo, los canales de Na + se abren y cierran rápidamente, mientras que las compuertas de K + se abren y cierran mucho más lentamente. La diferencia de velocidad entre estos canales subyace a las fases de despolarización y repolarización del potencial de acción. [10]
Los canales de sodio (Na + ) dependientes del voltaje son importantes para la propagación de potenciales de acción en neuronas y otras células excitables, y se utilizan principalmente para la propagación de potenciales de acción en axones, fibras musculares y el compartimento somatodendrítico neuronal. [11] Los canales de sodio (Na + ) son algunos de los principales canales iónicos responsables de los potenciales de acción. [9] Al ser complejos, están formados por subunidades α más grandes que luego se emparejan con dos subunidades β más pequeñas. [11] Contienen segmentos transmembrana conocidos como S1-6. Los segmentos S4 cargados son los sensores de voltaje de los canales. Cuando se exponen a una determinada diferencia de potencial mínima, los segmentos S4 se mueven a través de la membrana. [12] Esto provoca el movimiento del conector S4-S5, lo que hace que el conector S5-S6 se tuerza y abra el canal. [13]
Los canales de potasio (K + ) desempeñan un papel importante en el establecimiento del potencial de membrana en reposo. [9] Cuando la membrana celular se despolariza, la parte intracelular del canal se carga positivamente, lo que hace que la configuración abierta del canal se convierta en un estado más estable que la configuración cerrada. Existen algunos modelos de activación del canal de potasio:
Los canales de calcio (Ca 2+ ) regulan la liberación de neurotransmisores en las sinapsis, controlan la forma de los potenciales de acción generados por los canales de sodio y, en algunas neuronas, generan potenciales de acción. [9] Los canales de calcio constan de seis hélices transmembrana. S4 actúa como sensor de voltaje al rotar cuando se expone a ciertos potenciales de membrana, abriendo así el canal. [15]

Los neurotransmisores se almacenan y sintetizan inicialmente en vesículas en la sinapsis de una neurona. Cuando se produce un potencial de acción en una célula, la señal eléctrica llega a la terminal presináptica y la despolarización hace que se abran los canales de calcio, liberando calcio para que viaje a través de su gradiente electroquímico. Esta afluencia de calcio es posteriormente lo que hace que las vesículas de neurotransmisores se fusionen con la membrana presináptica. [16] Los iones de calcio inician la interacción de las proteínas cofactoras obligatorias con las proteínas SNARE para formar un complejo SNARE. [16] Estos complejos SNARE median la fusión de vesículas al juntar las membranas, filtrando los neurotransmisores hacia la hendidura sináptica. Las moléculas de neurotransmisores pueden entonces enviar señales a la siguiente célula a través de receptores en la membrana postsináptica. Estos receptores pueden actuar como canales iónicos o GPCR (receptores acoplados a proteína G). [17] En general, el neurotransmisor puede provocar una respuesta excitatoria o inhibidora, dependiendo de lo que ocurra en el receptor.
Los canales de cloruro son otro grupo de canales iónicos regulados por voltaje, de los cuales se comprenden menos. Están involucrados en procesos como el músculo liso esquelético y cardíaco, la regulación del volumen celular, el ciclo celular y la apoptosis. [18] Una familia importante de proteínas de cloruro se denominan proteínas CLC, que funcionalmente se clasifican en canal o transportador. [19] Comparten una estructura homodímera con una vía de permeación iónica independiente en cada una de las subunidades. [20] Según la caracterización funcional, existen dos mecanismos de regulación conocidos: regulación del protoporo y regulación común. La regulación del protoporo, también conocida como regulación rápida, está asociada con la oclusión del poro a través de una cadena lateral de glutamato conservado. Mientras que la regulación común, también conocida como regulación lenta, inactiva o reactiva ambos poros a través de un mecanismo desconocido. [21] Esta familia transporta dos cloruros por un protón o simplemente permite el flujo a lo largo de su gradiente electroquímico. [22] Con este canal, la despolarización y repolarización correctas a través de iones de cloruro es esencial para la propagación de un potencial de acción. [18]
Los canales iónicos regulados por ligando se encuentran en las neuronas postsinápticas. Por defecto, adoptan su conformación cerrada. Cuando la neurona presináptica libera neurotransmisores al final de un potencial de acción, estos se unen a los canales iónicos regulados por ligando. Esto hace que los canales adopten su conformación abierta, lo que permite que los iones fluyan a través de ellos en función de su gradiente de concentración. Los canales iónicos regulados por ligando son responsables de la transmisión sináptica rápida en el sistema nervioso y en la unión neuromuscular. [23] Cada canal iónico regulado por ligando tiene una amplia gama de receptores con diferentes propiedades biofísicas, así como patrones de expresión en el sistema nervioso. [24]
La inactivación se produce cuando el flujo de iones se bloquea por un mecanismo distinto al cierre del canal. [8] Un canal en su estado abierto puede dejar de permitir el flujo de iones, o un canal en su estado cerrado puede inactivarse preventivamente para evitar el flujo de iones. [25] La inactivación ocurre típicamente cuando la membrana celular se despolariza y finaliza cuando se restablece el potencial de reposo . [8]
En los canales de sodio, la inactivación parece ser el resultado de las acciones de las hélices III-VI, donde la III y la IV actúan como una especie de tapa articulada que bloquea el canal. El mecanismo exacto no se conoce bien, pero parece depender de una partícula que tiene una alta afinidad por el interior expuesto del canal abierto. [26] La inactivación rápida permite que el canal detenga el flujo de sodio muy poco después de asumir su conformación abierta. [27]
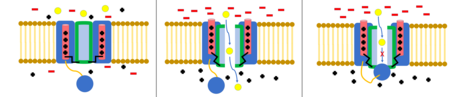
El modelo de bola y cadena , también conocido como inactivación de tipo N o inactivación de tapa articulada, es un mecanismo de activación de algunos canales iónicos activados por voltaje. Los canales iónicos activados por voltaje están compuestos por 4 [ dudoso – discutir ] subunidades α, una o más de las cuales tendrán un dominio de bola ubicado en su extremo N citoplasmático . [28] El dominio de bola es atraído electrostáticamente al dominio del canal interno. Cuando se activa el canal iónico, el dominio del canal interno queda expuesto y, en milisegundos, la cadena se doblará y la bola ingresará al canal, ocluyendo la permeación iónica. [29] El canal regresa a su estado cerrado, bloqueando el dominio del canal, y la bola sale del poro. [30]

La desactivación es el retorno de un canal iónico a su conformación cerrada. En el caso de los canales regulados por voltaje, esto ocurre cuando el diferencial de voltaje que originalmente provocó la apertura del canal vuelve a su valor de reposo. [31]
En los canales de sodio dependientes de voltaje, la desactivación es necesaria para recuperarse de la inactivación. [26]
En los canales de potasio dependientes del voltaje, ocurre lo contrario y la desactivación ralentiza la recuperación del canal tras su activación. [32] La conformación cerrada se asume por defecto e implica el enderezamiento parcial de la hélice VI por el enlace IV-V. Los mecanismos que provocan la apertura y el cierre no se comprenden por completo. La conformación cerrada parece ser una conformación de mayor energía que la conformación abierta, lo que también puede ayudar a explicar cómo se activa el canal iónico. [33]
La carga de activación se puede calcular resolviendo la ecuación de Poisson . Estudios recientes han sugerido un método basado en simulación de dinámica molecular para determinar la carga de activación midiendo las propiedades de los condensadores eléctricos de las proteínas embebidas en la membrana. [2] La actividad de los canales iónicos ubicados en la membrana plasmática se puede medir simplemente uniendo un electrodo capilar de vidrio de manera continua con la membrana. [34] Otros canales iónicos ubicados en las membranas de las mitocondrias, los lisosomas y el aparato de Golgi se pueden medir mediante una técnica emergente que implica el uso de una membrana lipídica bicapa artificial unida a un dispositivo de 16 electrodos que mide la actividad eléctrica. [34]
{{cite journal}}: CS1 maint: DOI inactivo a partir de julio de 2024 ( enlace )